4-氨基吡啶对MPP+诱导帕金森病细胞具有神经保护作用
2023-02-06马媛媛周畅陈枫蕾容琼文
马媛媛,周畅,陈枫蕾,容琼文
4-氨基吡啶对MPP+诱导帕金森病细胞具有神经保护作用
马媛媛1,2,周畅2,3,陈枫蕾2,3,容琼文1,2
1.海南医学院第一附属医院神经内科,海南海口 570102;2.海南热带脑科学研究与转化重点实验室,海南海口 571199; 3.海南医学院第一临床学院,海南海口 571199
探究4-氨基吡啶(4-aminopyridine,4-AP)对1-甲基-4-苯基吡啶离子(1-methyl-4-phenylpyridinium,MPP+)诱导的帕金森病细胞模型是否存在保护作用。利用不同浓度的MPP+孵育SH-SY5Y细胞,探究不同浓度MPP+对细胞活性的影响。单独利用4-AP孵育细胞,探究4-AP是否影响细胞活性。利用4-AP预处理SH-SY5Y细胞系24h后,随后选取合适浓度的MPP+孵育细胞24h,CCK8测定细胞活性并进行统计学分析。随着MPP+药物浓度的升高,SH-SY5Y细胞活性下降。不同浓度的4-AP单独孵育SH-SY5Y细胞系对细胞活性不产生影响。不同浓度的4-AP预处理细胞24h后,加入1mol/L的MPP+孵育24h,当4-AP浓度在0.3~10mol/L时SH-SY5Y细胞的活性增加,在1mol/L时细胞活性增加最佳,为正常细胞的66%。一定浓度范围内的4-AP可减少MPP+对SH-SY5Y细胞的毒性作用,具有神经保护作用。
细胞活性;4-氨基吡啶;帕金森病;神经保护
帕金森病是一种慢性进行性中枢神经系统疾病,主要病理表现为中脑黑质致密区多巴胺能神经元丢失和路易小体形成,导致患者出现运动功能障碍和非运动功能障碍,可存在静止性震颤、运动迟缓、便秘、睡眠障碍等临床症状,帕金森病多发于60岁以上人群,且随着年龄的增加帕金森病的发病率不断升高[1]。现有的治疗手段仅能缓解症状,尚不能治愈帕金森病。帕金森病的发病机制至今尚未明确,其发病机制和治疗方案一直是脑科学研究的重点。冻结步态是帕金森病患者临床表现中常见且最具有致残性的病理步态[2]。研究发现4-氨基吡啶(4-aminopyridine,4-AP)可改善帕金森病患者的冻结步态[3]。4-AP是一种非选择性的电压门控钾通道(voltage-gated potassium channel,Kv通道)阻滞剂,目前被用于多发性硬化、脊髓小脑共济失调等神经系统疾病引起的运动症状的对症治疗[4,5]。研究发现,4-AP除具有改善症状的作用外,还具有神经保护作用[6-8]。本研究拟探讨4-AP对1-甲基-4-苯基吡啶离子(1-methyl-4-phenylpyridinium,MPP+)诱导的帕金森病细胞模型是否存在保护作用,探讨Kv通道阻滞剂是否可能是治疗帕金森病的潜在靶点,为Kv通道与帕金森病发病相关性提供线索。
1 材料与方法
1.1 实验细胞、主要耗材及仪器
人神经母细胞瘤细胞系(SH-SY5Y细胞系,购自武汉普诺赛生命科技有限公司);MPP+(购自美国Sigma公司)、4-AP(购自美国Sigma公司)、CCK8试剂盒(购自中国abcam公司)、酶标仪(购自美国Bio Tek)、细胞计数板(购自中国Axygen公司)、胎牛血清和DMEM/F12(购自中国Gibco公司)。
1.2 细胞复苏、培养、传代
液氮中取出细胞并进行细胞复苏:快速放入37℃水浴锅内,晃动冻存管1min内使冻存细胞的冻存液溶解,1000转/min离心5min,酒精擦拭外壁后放入超净台。弃上清液,加入培养基制成悬浮液后,加入至T25瓶放置于37℃含5%CO2的恒温孵育箱内进行培养。24h后观察细胞形态,1~2d更换培养基,根据细胞生长情况1周传代2次,传代到第10次开始进行实验。
1.3 实验分组
1.3.1 MPP+浓度筛选 为了筛选合适的MPP+制备帕金森病细胞模型,分别采用0.1、0.3、1mol/L的MPP+孵育SH-SY5Y细胞系24h后,根据测量的细胞活性比值,筛选出细胞活性下降约50%的MPP+浓度。
1.3.2 评估4-AP对SH-SY5Y细胞系的作用 以浓度的log对数值均分,设置不同的4-AP干预浓度梯度,即空白对照、0.01、0.03、0.1、0.3、1、3、10mol/L,评估不同浓度的4-AP对细胞活性的影响作用。
1.3.3 MPP++4-AP共同干预对SH-SY5Y细胞系的作用 根据1.3.1实验筛选出的MPP+浓度为1mol/L;根据1.3.2实验结果4-AP对细胞活性无影响。综合1.3.1和1.3.2实验结果进行后续实验。分为空白对照组、MPP+组、1mol/L MPP++0.01mol/L 4-AP组、1mol/L MPP++0.03mol/L 4-AP组、1mol/L MPP++ 0.1mol/L 4-AP组、1mol/L MPP++0.3mol/L 4-AP组、1mol/L MPP++1mol/L 4-AP组、1mol/L MPP++3mol/L 4-AP组、1mol/L MPP++10mol/L 4-AP组,探究4-AP对MPP+诱导帕金森病细胞模型的作用。
1.4 细胞活性检测方法
CCK8细胞活性测定,严格按试剂盒操作方法及步骤说明进行:①提前准备好96孔板,每孔加入100µl 5000个细胞。按照实验需要进行培养,并分别给予不同浓度的药物(MPP+、4-AP、MPP+和4-AP)干预24h。②干预24h后,每孔加入10µl CCK8溶液,设置空白对照组。③继续孵育0.5~4 h。④450nm测定吸光度。
1.5 统计学方法
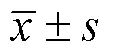
2 结果
2.1 不同浓度MPP+诱导帕金森病细胞模型的细胞活性存在差异
与空白对照组相比,0.1、0.3、1mol/L三种不同浓度的MPP+干预SH-SY5Y细胞系24h后,三组细胞活性仅为正常细胞的83%、67%、49%,各组间比较差异有统计学意义(=37.8,<0.05)。选取细胞活性下降至49%的1mol/L MPP+进行下一步实验。
2.2 不同浓度4-AP孵育细胞24h不影响SH-SY5Y细胞系的细胞活性
利用不同浓度(0.01、0.03、0.1、0.3、1、3、10mol/L)4-AP孵育SH-SY5Y细胞系24h后,其细胞活性与正常对照组相比无差异(>0.05),提示4-AP不影响SH-SY5Y细胞系的细胞活性,对SH-SY5Y细胞系无毒副作用。
2.3 4-AP预处理可提高MPP+诱导的帕金森病细胞模型的细胞活性
7种不同浓度(0.01、0.03、0.1、0.3、1、3、10mol/L)4-AP预处理SH-SY5Y细胞系24h后,再利用1 mol/L的MPP+孵育细胞24h诱导帕金森病细胞模型。空白对照组、1mol/L MPP+组、1mol/L MPP++0.01mol/L 4-AP组、1mol/L MPP++0.03mol/L 4-AP组、1mol/L MPP++0.1mol/L 4-AP组、1mol/L MPP++0.3mol/L 4-AP组、1mol/L MPP++1mol/L 4-AP组、1mol/L MPP++3mol/L 4-AP组、1mol/L MPP++ 10mol/L 4-AP组的细胞活性分别为100%、51%、55%、57%、60%、63%、66%、64%、61%。单因素方差分析提示多组间比较差异有统计学意义(= 20.04,<0.001)。进一步的多重比较提示0.1、0.3、1、3、10mol/L 4-AP预处理SH-SY5Y细胞系24h后其细胞活性比MPP+诱导的帕金森病细胞模型的细胞活性显著增加,差异有统计学意义(<0.05)。
3 讨论
MPP+诱导的SH-SY5Y细胞是体外作为多巴胺能神经元研究帕金森病的主流帕金森病细胞模型,因为SH-SY5Y细胞具有中脑多巴胺能神经元的特点,如表达酪氨酸羟化酶、自发放电和具有多巴胺转运体等特点[9]。在体内1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)代谢成活性产物MPP+,通过多巴胺转运体转运至中脑黑质致密区的多巴胺能神经元内,MPP+可特异性损害多巴胺能神经元,引起多巴胺能神经元线粒体功能障碍,导致多巴胺能神经元坏死从而诱发帕金森病;不同研究中MPP+诱导的帕金森病模型细胞选用的浓度和孵育时间存在差异,常用浓度有0.05、0.1、0.2、0.25、0.3、0.4、0.5、0.8、1、2、3mol/L等,孵育时长从12~72h不等,研究表明不同浓度和不同时长的MPP+孵育细胞对细胞活性的影响存在差异,可根据实验目的选取不同的模型制备方案[10-14]。本研究观察0.1、0.3、1mol/L的MPP+孵育SH-SY5Y细胞系24h后SH-SY5Y细胞活性的变化,结果发现MPP+孵育的浓度越高细胞活性下降越明显,提示MPP+浓度越高对细胞的毒性作用越强,根据细胞活性测定结果,1mol/L的MPP+孵育SH-SY5Y细胞系24h后,SH-SY5Y细胞活性下降至49%,故后续实验选取1mol/L的MPP+孵育SH-SY5Y细胞系24h诱导帕金森病细胞模型。
研究发现在中脑黑质中的多巴胺能神经元表达各种Kv通道,如Kv4.3、Kv2.1和Kv1.2通道,其中Kv2.1通道与多巴胺转运体结合,并介导发生凋亡的多巴胺能神经元中的K+流出,参与多巴胺能神经元的凋亡[15]。而K+外流是细胞凋亡所必须经历的过程[16]。提示Kv通道与细胞凋亡密切相关,可能参与帕金森病的发生。研究发现Kv通道阻滞剂可减少多巴胺转运体介导6-羟基多巴氧化剂诱导的Kv通道依赖性的细胞死亡途径[17]。Kv通道亦参与调节中脑多巴胺能神经元的凋亡,减轻6-羟基多巴胺对多巴胺能神经元的毒性作用,对中脑多巴胺能神经元发挥保护作用[18]。研究发现抑制Kv4通道可增强黑质多巴胺神经元的自发放电频率,诱导从强直放电到突发放电的过渡,并促进纹状体中多巴胺的释放,且在帕金森病患者中发现Kv4通道相应的mRNA表达增多;Kv7通道可调节神经元兴奋性,增加多巴胺的释放,并减轻运动症状[19]。以上研究均表明Kv通道参与多巴胺能神经元的凋亡过程,调节神经元的兴奋性和多巴胺的释放,与帕金森病存在相关性。
为验证Kv通道是否参与帕金森病的发生发展,笔者利用一种非选择性的Kv通道阻滞剂4-AP来干预SH-SY5Y细胞系,验证其对帕金森病模型细胞的作用。研究表明4-AP可改善神经损伤诱导的运动功能障碍,减少肌肉萎缩,增加肌肉纤维直径和收缩力[20-21]。在自身免疫性脑脊髓炎模型小鼠中,预防性和治疗性应用4-AP治疗可改善小鼠足印和旋转棒运动的活动性[22]。4-AP除具有改善运动症状的作用外,还具有神经保护特征[6]。除外多系统萎缩,4-AP也可改善脊髓小脑共济失调引起的步态异常[23]。一定浓度的4-AP可改善中枢神经系统脱髓鞘疾病的症状。除了治疗作用,4-AP对人和动物亦存在毒性,在鸟类和哺乳动物的高剂量实验中,4-AP的毒性反应在给药后15min出现,包括癫痫发作、震颤、共济失调、呼吸困难、瞳孔放大、流涎和虚脱,甚至死亡。在人类中同样存在4-AP过量的毒性反应,包括虚弱、恶心、大量出汗、口渴、呼吸困难和呕吐,失去知觉并表现出强直-阵挛性癫痫发作、高血压、代谢性酸中毒和血清谷草酰乙酸转氨酶浓度升高[24]。为了能更好地研究4-AP对帕金森病细胞活性的影响,笔者利用不同浓度的4-AP孵育SH-SY5Y细胞24h,观察药物单独孵育对细胞活性的影响,结果提示在10mol/L浓度内的4-AP孵育细胞24h是安全的,可用于下一步的实验研究。
本研究结果表明使用4-AP预处理细胞24h后,再利用MPP+制备帕金森病细胞模型可减少MPP+毒性,提高其诱导的帕金森病细胞模型的细胞活性。本研究初步探索4-AP对帕金森病细胞模型的作用,证明4-AP在帕金森病细胞模型中发挥一定的保护作用,且这种保护作用存在浓度依赖性。当使用4-AP预处理浓度范围在0.3~10mol/L时,SH-SY5Y细胞系的细胞活性比MPP+组的细胞活性明显升高;当4-AP预处理浓度为0.3mol/L时其细胞活性升高存在差异;当4-AP干预浓度为1mol/L时,其细胞活性为正常细胞的66%,活性升高最为明显;当4-AP浓度为3、10mol/L时其细胞活性为正常细胞的64%、61%,比MPP+组的细胞活性明显增高,但比1mol/L的4-AP预处理组的细胞活性稍低。提示对于MPP+诱导的帕金森病模型细胞4-AP的最佳干预浓度为1mol/L,同时4-AP预处理SH-SY5Y细胞系存在浓度相关性,当超过1mol/L时,其细胞活性增加的比值下降,这提示4-AP过量可能存在某种潜在的毒副作用。当4-AP浓度超过10mol/L时是否能继续发挥神经保护作用,减少MPP+诱导的细胞活性的降低,本研究中并未涉及,需要后续的实验来继续补充研究。同时本文并未解释4-AP预处理SH-SY5Y细胞系是通过何种机制来减少MPP+诱导的细胞活性的降低,这也是后续研究的重点,希望通过本研究为未来治疗帕金森病提供新的治疗靶点。
[1] CHURCH F C. Treatment options for motor and non- motor symptoms of Parkinson's disease[J]. Biomolecules, 2021, 11(4): 612.
[2] RAHIMPOUR S, GAZTANAGA W, YADAV A P, et al. Freezing of gait in Parkinson's disease: Invasive and noninvasive neuromodulation[J]. Neuromodulation, 2021, 24(5): 829-842.
[3] LUCA C C, SINGER C. 4-Aminopyridine improves freezing of gait in Parkinson's disease[J]. J Neurol, 2013, 260(10): 2662-2664.
[4] RODRÍGUEZ-RANGEL S, BRAVIN A D, RAMOS- TORRES K M, et al. Structure-activity relationship studies of four novel 4-aminopyridine K+channel blockers[J]. Sci Rep, . 2020, 10(1): 52.
[5] KALLA R, STRUPP M. Aminopyridines and acetyl- DL-leucine: New therapies in cerebellar disorders[J]. Curr Neuropharmacol, 2019, 17(1): 7-13.
[6] DIETRICH M, HARTUNG H P, ALBRECHT P. Neuroprotective properties of 4-aminopyridine[J]. Neurol Neuroimmunol Neuroinflamm, 2021, 8(3): e976.
[7] STRIJBIS E M, NIJ-BIJVANK J A, KILLESTEIN J. 4-Aminopyridine is not just a symptomatic therapy, it has a neuroprotective effect-Yes[J]. Mult Scler, 2020, 26(11): 1309-1310.
[8] GÖBEL K, WIENDL H. 4-Aminopyridine is not just a symptomatic therapy, it has a neuroprotective effect- No[J]. Mult Scler, 2020, 26(11): 1311-1312.
[9] XIE H R, HU L S, LI G Y. SH-SY5Y human neuroblastoma cell line: In vitro cell model of dopaminergic neurons in Parkinson's disease[J]. Chin Med J (Engl), 2010, 123(8): 1086-1092.
[10] LI R, WANG S, LI T, et al. Salidroside protects dopaminergic neurons by preserving complex I activity via DJ-1/Nrf2-mediated antioxidant pathway[J]. Parkinsons Dis, 2019, 2019: 6073496.
[11] CARRASCO E, WERNER P. Selective destruction of dopaminergic neurons by low concentrations of 6- OHDA and MPP+: Protection by acetylsalicylic acid aspirin[J]. Parkinsonism Relat Disord, 2002, 8(6): 407-411.
[12] WANG M, SUN H, YAO Y, et al. MicroRNA-217/ 138-5p downregulation inhibits inflammatory response, oxidative stress and the induction of neuronal apoptosis in MPP+-induced SH-SY5Y cells[J]. Am J Transl Res, 2019, 11(10): 6619-6631.
[13] AMO T, OJI Y, SAIKI S, et al. Metabolomic analysis data of MPP+-exposed SH-SY5Y cells using CE- TOFMS[J]. Data Brief, 2020, 34: 106707.
[14]JHUO C F, HSIEH S K, CHEN C J, et al. Teaghrelin protects SH-SY5Y cells against MPP+-induced neurotoxicity through activation of AMPK/SIRT1/PGC-1α and ERK1/2 pathways[J]. Nutrients, 2020, 12(12): 3665.
[15] Wang G, Zeng J, Ren R, et al. Potassium channels in the basal ganglia: Promising new targets for the treatment of Parkinson's disease[J]. Front Biosci, 2008, 13: 3825-3838.
[16] SHAH N H, AIZENMAN E. Voltage-gated potassium channels at the crossroads of neuronal function, ischemic tolerance, and neurodegeneration[J]. Transl Stroke Res, 2014, 5(1): 38-58.
[17] WANG Y, YANG P L, TANG J F, et al. Potassium channels: Possible new therapeutic targets in Parkinson's disease[J]. Med Hypotheses, 2008, 71(4): 546-550.
[18] REDMAN P T, JEFFERSON B S, ZIEGLER C B, et al. A vital role for voltage-dependent potassium channels in dopamine transporter-mediated 6-hydroxydopamine neuro- toxicity[J]. Neuroscience, 2006, 143(1): 1-6.
[19] Chen X, Xue B, Wang J, et al. Potassium channels: A potential therapeutic target for Parkinson's disease[J]. Neurosci Bull, 2018, 34(2): 341-348.
[20] STEPHENS G J, GARRATT J C, ROBERTSON B, et al. On the mechanism of 4-Aminopyridine action on the cloned mouse brain potassium channel mKv1. 1[J]. J Physiol, 1994, 477(Pt 2): 187-196.
[21] YUE L, TALUKDER M A H, GURJAR A, et al. 4-Aminopyridine attenuates muscle atrophy after sciatic nerve crush injury in mice[J]. Muscle Nerve, 2019, 60(2): 192-201.
[22] GURJAR A A, MANTO K M, ESTRADA J A, et al. 4-Aminopyridine: A single-dose diagnostic agent to differentiate axonal continuity in nerve injuries[J]. Mil Med, 2021, 186(Suppl 1): 479-485.
[23] SCHNIEPP R, WUEHR M, NEUHAEUSSER M, et al. 4-Aminopyridine and cerebellar gait: A retrospective case series[J]. J Neurol, 2012, 259(11): 2491-2493.
[24] HAYES K C. The use of 4-aminopyridine (fampridine) in demyelinating disorders[J]. CNS Drug Rev, 2004, 10(4): 295-316.
Neuroprotective effect of 4-aminopyridine in 1-methyl 4-phenylpyridinium induced Parkinson’s disease cells model
MA Yuanyuan, ZHOU Chang, CHEN Fenglei, RONG Qiongwen
1.Department of Neurology, the First Affiliated Hospital of Hainan Medical University, Haikou 570102, Hainan, China; 2.Key Laboratory of Brain Science Research & Transformation in Tropical Environment of Hainan Province, Haikou 571199, Hainan, China; 3.The First Clinical Medical College, Hainan Medical University, Haikou, 571199, Hainan, China
To explore the protective effect of 4-aminopyridine (4-AP) on 1-methyl-4-phenylpyridinium (MPP+) induced Parkinson’s disease cell mode.SH-SY5Y cells were incubated with different concentrations of MPP+to explore the effect of different concentrations of MPP+on cell viability. SH-SY5Y cells were incubated with different concentrations of 4-AP to explore the effect of different concentrations of drugs on cells. SH-SY5Y cells were pretreated with 4-AP for 24h, then incubated with MPP+at an appropriate concentration for 24h, and cell viability was measured by CCK8 assay.With the increase of MPP+concentration, the activity of SH-SY5Y cells decreased. Different concentrations of 4-AP alone incubating SH-SY5Y cell line had no effect on cell viability. After the cells were pretreated with different concentrations of 4-AP for 24 h, and then incubated with 1 mol/L MPP+for 24 h, the activity of SH-SY5Y cells increased when the concentration of 4-AP was 0.3-10mol/L, and the best increase was 66% of the control cells when the concentration of 4-AP was 1mol/L.In a certain concentration range, 4-AP can reduce the toxic effect of MPP+on SH-SY5Y cells and has neuroprotective effect.
Cellular activity; 4-Aminopyridine; Parkinson’s disease; Neuroprotection
R742.5
A
10.3969/j.issn.1673-9701.2023.01.008
海南医学院第一附属医院青年培育基金项目(HYYFYPY202107);海南省高等学校科学研究项目(Hnky2020-39);海南省临床医学中心建设项目资助
容琼文,电子信箱:13907580113@163.com
(2022–07–13)
(2022–12–07)
