高迁移率族蛋白1对失血性休克大鼠缺血再灌注后肠屏障功能影响
2023-02-04王鑫宇高广荣柳云恩
王鑫宇,李 达,高广荣,马 锐,张 成,柳云恩
1.锦州医科大学 北部战区总医院 研究生培养基地,辽宁 沈阳 110016;2.北部战区总医院 普通外科,辽宁 沈阳 110016;3.沈阳医学院,辽宁 沈阳 110034
尽管,通过损伤控制性手术辅以合理的液体复苏策略,可使多数失血性休克(hemorrhagic shock,HS)患者得到成功救治,但仍有部分患者因循环衰竭或多器官功能障碍(multiple organ dysfunction syndrome,MODS)死亡[1-2]。既往研究报道,肠黏膜对缺血较为敏感,是缺血-再灌注损伤时最易受累的器官[3]。其中,值得关注的是,尽管在合理液体复苏的支持下,仍有部分患者的肠上皮因无氧代谢和乳酸中毒而受损,导致屏障功能受损,引起大量炎性介质过度释放及细菌移位,最终发生MODS等严重并发症。在复苏期间采取诱导性低温(inducible hypothermia,IH)可以明显改善HS引起的有氧代谢紊乱及炎症反应,是改善HS患者预后、降低病死率的一种重要治疗手段[4-5]。高迁移率族蛋白1(high-mobility group box-1,HMGB1)已经被证实是一种能参与炎症反应的重要介质[6]。在应激状态下,HMGB1可作为细胞早期警报素,启动损伤相关分子机制,后期在氧化应激等刺激条件下,HMGB1可以从胞核中通过胞浆分泌到细胞外,促进炎症反应,加重组织缺血再灌注损伤。然而,其在HS条件下是否同样能诱发肠道炎性因子释放,损伤肠道屏障,目前相关报道较少。因此,笔者从HS发病的分子生物学角度着手,意图探究HMGB1是否具有调控HS鼠肠道细胞、损伤肠道屏障功能作用,为临床发展针对性治疗及研发新型药物奠定理论基础。现报道如下。
1 材料与方法
1.1 材料及试剂 成年Wistar大鼠[体质量180~200 g,平均体质量(189.0±5.7)g]),由北部战区总医院动物实验室提供;低温离心机(沈阳医疗器械有限公司);BL-420E多导联生理记录仪(成都金凤有限公司);压力传感器(新加坡Biosensors公司);动物肛温计(北京冀诺泰科技发展有限公司);大鼠手术器械(沈阳医疗器械有限公司);聚合酶链反应(polymerase chain reaction,PCR)扩增仪(德国Biometra公司);紫外线分光光度计(英国UV-visible Spectrometer公司);血气分析仪(德国Bayer公司);荧光定量PCR试剂盒(北京宝日医生物有限公司);HMGB1引物合成(上海生工生物工程有限公司);HMGB1抗体(英国Abcam公司)。
1.2 大鼠HS模型的建立 Wistar大鼠32只,随机分为常温复苏(N)组和低温复苏(H)组,每组各16只。以10%水合氯醛(0.5 ml/100 g)腹腔注射麻醉,进行气管插管辅助呼吸,分离左股动脉及左颈总动脉,分别用于放血及监测平均动脉压(mean arterial pressure,MAP),左股静脉则用于复苏时液体回输。N组和H组放血速度控制在0.5 ml/min,放血量为20 ml/kg,总时间控制在10 min以内,将MAP维持在50 mmHg(1 mmHg=0.133 kPa)左右90 min。抽取的血液储存于肝素化(7.5 U/ml)注射器中,置于4℃冰箱中保存。
1.3 HS复苏模型的建立 N组采用加热设备控制大鼠体温在38℃,H组采用酒精擦浴等方式控制大鼠体温在32℃;同时,回输放出的血液以及3倍放血量的林格液,复苏结束后恢复H组大鼠的体温,检测两组血流动力学变化。3 h后每组各处死8只大鼠,采集血液、肠系膜淋巴结及小肠标本,剩余鼠用于72 h生存分析。
1.4 定量PCR检测HMGB1 mRNA表达 RNA提取:将小肠标本捣碎,加入1 ml Trizol后震荡60 s,加入200 μl氯仿后震荡30 s,低温高速离心机离心15 min。取上清液加入等量异丙醇。再次离心15 min后,用75%乙醇清洗,随后加入40 ml RNase free water混匀,55℃金属浴5 min。使用紫外分光光度仪检测mRNA含量。cDNA反转录:采用TaKaRa反转录试剂盒,制备cDNA。PCR扩增:HMGB1引物序列,forward5-TCTTCCTCTTCTGCTCTGA-3,resever5‘-ATCTTCCTCCTCTTCCTTCT-3′;GAPDH引物序列,forward5-TGGACCTGACCTGCCGTCTA-3,resever5‘-GGAGTGGGTGTCGCTGTTGA-3′。根据CT值按照2-△△CT法计算HMGB1在N组和H组中表达的相对水平。
1.5 蛋白印迹法检测HMBG1等蛋白表达 小肠标本悬液(40 μl)中加入4倍体积的细胞裂解液,12 000 r/min、4℃离心20 min后,收集上清液,使用考马斯蓝法进行蛋白定量。电泳分离样本后转移至硝酸纤维膜上,以BSA封闭,以BSA封闭1 h,分别加入HMBG1、Coroin 1A、活化半胱氨酸蛋白酶-3(cleaved Caspase-3)、白细胞介素(interleukin,IL)-4、神经丝蛋白-M(Neurofilament-M)、肾连蛋白(nephronection)、IL-17、胰岛素样生长因子-1受体(in sulin-like growth factor-1 receptor,IGF-1R)、淀粉样蛋白前体蛋白结合家族A2(the amyloid precursor protein-binding protein A2 gene,APBA2)、IL-10、肌醇需求酶1α(inositol-requiring enzyme 1α,IRE1α)、Bax、CLP、白细胞共同抗原(CD45)及GAPDH的一抗(1∶1 000),室温下沉淀1 h,4℃摇晃过夜;次日加入辣根过氧化物酶标记的抗兔IgG抗体(1∶2 000),于室温下静置2 h;最后利用ECL浸膜。采用图像分析仪对胶片进行分析。
1.6 血清炎性细胞因子检测 采用酶联免疫吸附试剂盒检测大鼠血清中HMGB1、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、IL-1β、IL-6、IL-8、IL-10的表达情况。
1.7 小肠细菌移位检测 将血液及肠系膜淋巴结标本称重,置于含有0.5 ml磷酸缓冲盐溶液中研磨,将匀浆按照300 μl/份均匀涂抹在培养基上,置于37℃培养箱中培养24 h,显微镜观测。
2 结果
2.1 HMGB1 mRNA表达 复苏后3 h,H组和N组小肠组织中HMGB1 mRNA表达均有所升高。H组大鼠小肠组织中HMGB1 mRNA表达水平明显低于N组,差异有统计学意义(P<0.05,图1)。表明HS会刺激小肠细胞HMGB1表达升高,但低温复苏相比于常温复苏能有效降低HMGB1的表达,近而减轻炎症反应。
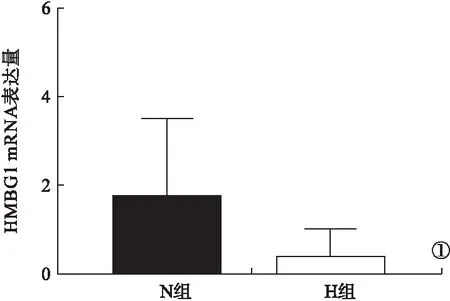
图1 HMBG1 mRNA表达变化
2.2 HMGB1等炎性相关细胞因子蛋白表达 复苏后3 h,N组和H组大鼠均可见小肠组织中包括HMGB1及多种炎症相关细胞因子蛋白的表达。其中,H组大鼠小肠组织中HMGB1、IL-4、Neurofilament-M、nephronection、酰基辅酶A氧化酶2(palmitoyl CoA oxidase 2,ACOX2)、IL-17、IGF-1R、APBA2、IRE1α、Bax、CLP和CD45表达明显低于N组,而Coronin 1A和IL-10表达明显高于N组,差异均有统计学意义(P<0.05)。见图2。表明低温复苏HS鼠的肠组织HMGB1等相关炎性细胞因子蛋白表达相对下调,抑炎因子表达相对上调,低温复苏HS鼠肠道受炎性细胞损伤较轻。
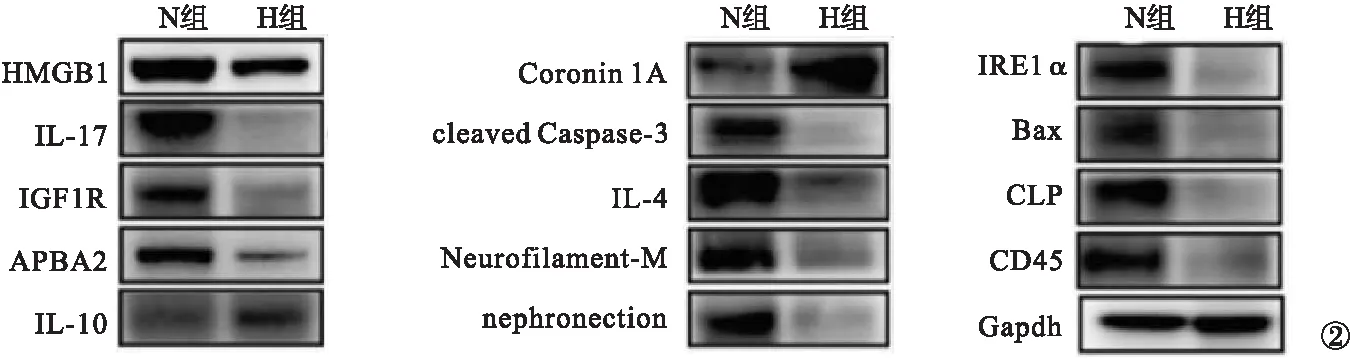
图2 HMGB1等炎性细胞因子蛋白表达变化
2.3 复苏大鼠血清炎性因子含量比较 复苏后3 h,H组大鼠血清中HMGB1、TNF-α、IL-1β、IL-6和IL-8明显低于N组,抑炎因子IL-10高于N组,组间比较,差异有统计学意义(P<0.05,图3)。同样说明低温复苏可以降低HMGB1等炎性相关因子的表达。
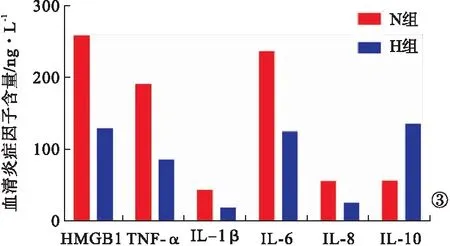
图3 N组和H组大鼠血清炎性因子含量比较
2.4 复苏大鼠肠系膜淋巴结细菌含量比较 H组大鼠肠系膜淋巴结细菌移位个数为2个,平均细菌移位量为(21.34±0.91)×103CFU/ml;而N组大鼠细菌移位个数为5个,平均细菌移位量为(45.25±0.54)×103CFU/ml。两组平均细菌移位量比较,差异有统计学意义(P<0.05)。说明低温复苏可以减少HS大鼠的肠道细菌移位。
2.5 两组大鼠生存情况比较 72 h生存分析结果显示,N组大鼠平均生存时间为(54.6±4.8)h,低于H组的(75.79±3.62)h,差异有统计学意义(P<0.05)。
3 讨论
HS主要表现为患者全身和局部组织灌注明显不足,即使给予积极的复苏治疗有时也难以纠正患者的休克状态。而复苏治疗在纠正休克的同时又极易导致部分组织的再灌注损伤,不当的复苏不仅难以恢复患者的休克状态,反而会加重其组织器官的损伤。有研究报道,顽固性低血压和缺血-再灌注损伤可能是影响HS转归的直接原因[7]。在众多难治性HS患者中,学者们发现,肠黏膜对缺血最为敏感,易在缺血期间堆积大量代谢物质,进而诱发急性炎症反应,而在复苏治疗过程中,大量氧及白细胞会随着血液流入肠黏膜,最终导致难以控制的全身性炎症反应综合征[8]。
在笔者的前期研究中,已经证实了IH能够有效地提高复苏效率,改善HS引起的炎症反应,调整能量代谢平衡[9-10]。实际上,在休克等应激状态下,肠上皮细胞受损会释放警报素,启动炎症相关分子模式,通过多种模式识别受体如Toll样受体(toll-like receptors,TLR)4、糖基化终末产物受体(receptor for advanced glycation end products,RAGE)等,最终释放TNF-α、IL-6等炎性细胞因子,损伤肠黏膜屏障。因而,探究缺血-再灌注损伤导致肠屏障功能的分子机制,能为改善HS患者预后提供理论基础。
HMGB1能在应激状态下从细胞核中释放并进行乙酰化修饰,进而介导炎症反应。有研究报道,在肾发生缺血-再灌注损伤时,HMGB1从肾实质细胞核中大量释放,乙酰化后作用于下游靶点TLR-2/4等受体,引起多种炎性因子释放[11]。为了探究HMGB1对HS鼠肠屏障功能是否具有同样的作用,笔者通过构建N组与H组两组模型,分别检测两组鼠肠上皮HMGB1及其他相关炎性因子的表达情况,结果发现,H组大鼠小肠组织中HMGB1 mRNA及蛋白表达较N组明显降低,相关促炎因子也同样下调,而Coronin 1A和IL-10等抑炎因子表达明显升高,并且H组大鼠平均细菌移位量也明显减少,结果证实了,在IH复苏HS时,大鼠肠上皮细胞核HMGB1表达下调,其向胞质的分泌及乙酰化过程受阻,进而抑制TLR4、RAGE等识别受体,减少炎性因子的释放,减轻了肠屏障损伤,抑制肠道细菌移位,改善全身炎症反应综合征。本研究的结果与众多HMGB1相关研究结果[12-14]一致,初步明析了HMGB1在IH复苏中的相关分子机制。但IH时,机体具体通过何种机制导致HMGB1表达下调尚不可知,仍需后续实验继续探究。
综上所述,HMGB1表达下调可能是导致IH减轻大鼠HS肠屏障功能损伤的重要分子机制,为临床中治疗HS及预防缺血-再灌注损伤提供了一定的理论依据。但关于如何在临床患者中应用HMGB1拮抗剂来应对缺血-再灌注损伤带来的肠屏障功能障碍,仍需要更多的研究来证实。
