聚己内酯-褪黑素支架治疗骨缺损修复效果分析
2023-02-04王志锋朱建华侯林豪杨哲豪殷国辉任炳宇
王志锋,赵 威,朱建华,侯林豪,杨哲豪,殷国辉,任炳宇,崔 岩
中国医科大学附属第四医院 第一骨外科,辽宁 沈阳 110031
骨肿瘤、外伤、骨髓炎、骨坏死等原因均可引起不同程度的骨缺损。骨缺损主要通过骨移植术进行修复,但自体骨移植需要进行额外手术,增加了创伤与感染风险,同时其有限的材料来源限制了其可用性。同种异体骨移植与异种骨移植虽然无需额外手术且克服了材料限制,但会产生免疫排斥反应,影响移植骨的存活率及传染疾病的潜在可能性[1-2]。聚己内酯(polycaprolactone,PCL)支架具有低成本、易加工与降解速率可控等优势[3]。PCL支架逐步吸收的同时,可增强并刺激骨骼的生长及再生,从而为新组织的形成提供空间,但其生物活性较差,限制了新生骨的长入替代[4]。褪黑素(melatonin,MT)是由松果体分泌的一种重要的吲哚类激素[5]。有研究表明,在破骨细胞中,药物剂量的MT可以下调核因子κB受体活化因子(nuclear factor κB receptor activator ligand,RANKL)的表达,提高骨保护素含量,抑制破骨细胞的形成及活化,从而抑制骨吸收,增加年轻小鼠骨小梁骨量及骨密度[6-7]。MT刺激体外培养的人骨细胞及成骨细胞系增殖与I型胶原合成[8-9]。本研究旨在探讨PCL-MT支架治疗骨缺损的修复效果。现报道如下。
1 材料与方法
1.1 实验动物 选取6只8周龄SD雄性大鼠为研究对象。SD雄性大鼠购自吉林大学实验动物中心。动物实验得到中国医科大学动物保护与利用委员会批准。
1.2 PCL支架的三维打印 利用3D打印机,通过SolidWorks 2017 软件与Simplife 3D软件,使用PCL进行打印,形成具有高多孔性、高机械强度的PCL支架。
1.3 三维PCL支架上的MT装载 将MT与SUNP凝胶加入10 ml磷酸缓冲盐溶液中,使混合物完全溶解。冷却至室温后,得到载MT凝胶。将载MT凝胶注入三维PCL支架的空隙中[10]。将支架置于室温下进行液固转化,得到负载MT的PCL支架。
1.4 动物模型构建 制备骨损伤模型:对大鼠进行适应性饲养后5 d,采用随机数字表法将大鼠分为对照组与PCL-MT支架组,每组各3只。将大鼠常规麻醉, 固定于实验台上,双侧上肢备皮、铺无菌巾。沿备皮区域纵行作一2 cm切口,在胫骨近段1/3处截除1 cm,PCL-MT支架组大鼠缺损处植入PCL-MT支架,对照组大鼠抽取骨缺损处0.1 ml自体血,形成小血凝块,植入血凝块,逐层缝合。术后注射抗生素预防感染。
1.5 PCL-MT支架特性研究
1.5.1 体外浸泡试验 将PCL-MT支架放入清洁的浸泡瓶中,然后将Hank溶液加入到浸泡瓶,浸泡瓶置于37℃水浴恒温器中。每天记录pH值。30 d后,PCL-MT支架用吹风机干燥。采用铬酸溶液、蒸馏水与乙醇对PCL-MT支架进行超声清洗10 min。采用吹风机烘干PCL-MT支架后再次称重。
1.5.2 CCK-8实验及生物相容性 处理前,将细胞置于96孔板上24 h。培养72 h后,每孔加入CCK-8溶液,培养1 h。采用酶标仪在450 nm处测定吸光度。采用细胞骨架染色法,将细胞在12孔板上贴壁24 h,然后于37℃、CO2环境下培养7 d。采用4%多聚甲醛固定细胞30 min,0.5%Triton X-100渗透剂室温下渗透5 min。通过加入4-6-二脒基-2-苯基吲哚染色细胞核,在荧光显微镜下观察图像。
1.6 体内外成骨性能
1.6.1 聚合酶链式反应法测定体外成骨性能 通用RNA提取试剂盒分离总RNA,并使用Primescript RT Master Mix逆转录。采用聚合酶链式反应(polymerase chain reaction,PCR)法检测碱性磷酸酶(alkaline phosphatase,ALP)、骨保护素(osteocalcin,OCN)、骨钙素(osteoprotegerin,OPG)在骨缺损细胞中的表达情况。每个实验重复3次。
1.6.2 相对钙沉积 成骨培养基培养14 d后,采用40 mmol/L茜素红溶液染色,测定细胞外基质钙沉积。细胞与结节形成采用相衬显微镜观察。
1.6.3 显微CT扫描 术后4周,无菌切除大鼠胫骨,并用MicroCT扫描评估,测定对照组与PCL-MT支架组骨缺损区的新骨形成情况及新生骨痂量。
1.6.4 伊红染色 组织固定于4%多聚甲醛中。固定后,石蜡包埋前在10%乙二胺四乙酸中脱钙21 d,然后显微切片成一系列系统16 μm切片。标准伊红染色并拍照。
1.7 统计学方法 采用GraphPad Prism 6.02统计学软件对数据进行处理。以P<0.05为差异有统计学意义。
2 结果
2.1 体外浸泡试验结果 体外浸泡试验表明,支架的矿化厚度与腐蚀速率随时间延长逐渐增加。体外浸泡试验30 d后,PCL-MT支架仍具有清晰的轮廓。见图1。
2.2 CCK-8实验及免疫荧光结果 培养72 h后,两组大鼠的CCK-8实验检测结果见图2。PCL-MT支架组大鼠的相对细胞增殖率明显高于对照组,差异有统计学意义(P<0.05)。使用荧光显微镜观察与浸出液共培养24 h的细胞,两组细胞均有良好的铺展形态与显著的肌动蛋白表达,表面修饰后细胞粘附行为不受影响。见图3。

图1 体外浸泡实验结果
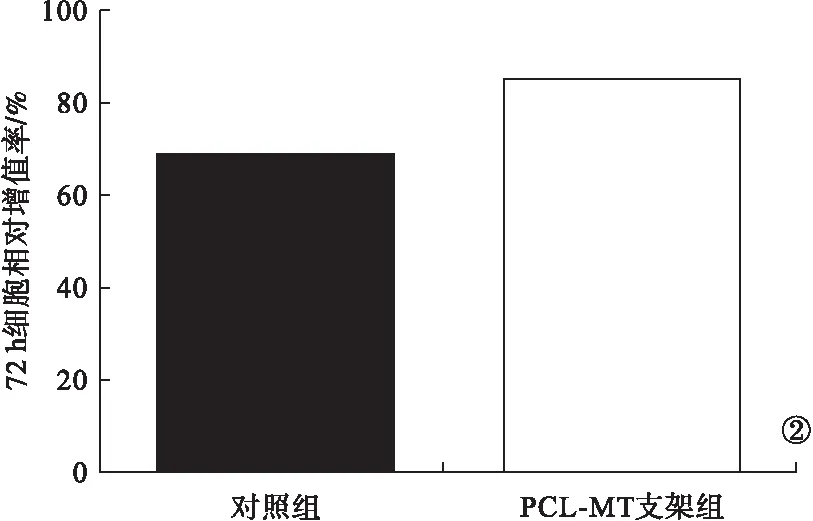
图2 CCK-8实验检测结果
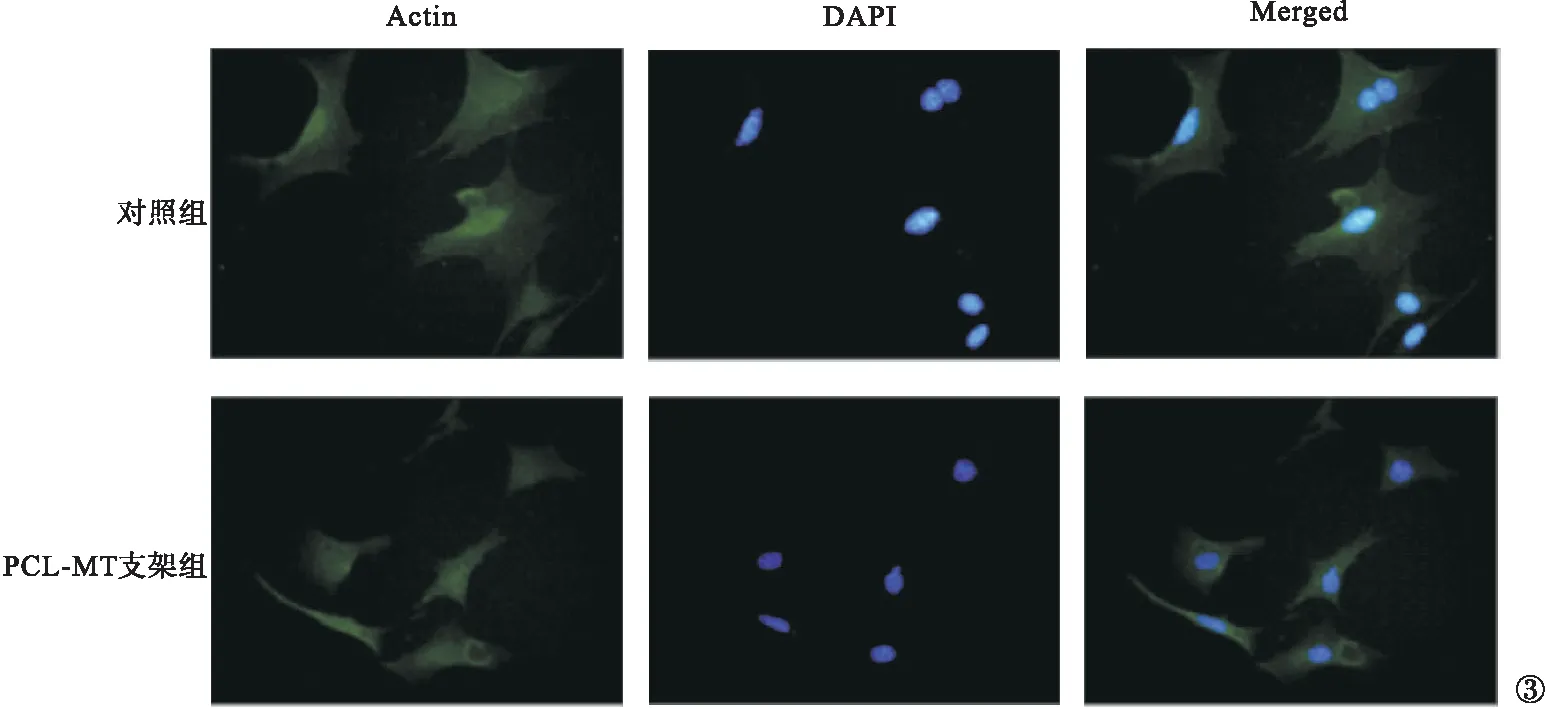
图3 细胞免疫荧光结果
2.3 PCR法检测与茜素红染色法检测结果 PCR法检测结果显示,PCL-MT支架组中的ALP、OCN、OPG mRNA表达高于对照组,差异均有统计学意义(P<0.05)。见图4。茜素红染色法检测结果显示,PCL-MT 支架组中的相对钙沉积量远高于对照组,差异有统计学意义(P<0.05)。见图5。
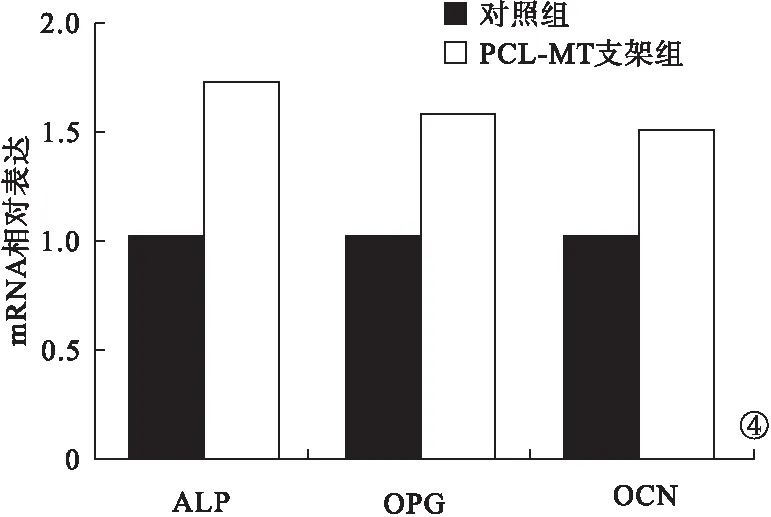
图4 PCR法检测结果

图5 茜素红染色法检测结果
2.4 显微CT扫描 显微CT扫描结果显示:对照组大鼠仍可见骨缺损区,周围有少量新生骨痂;PCL-MT支架组大鼠骨支架旁明显大量新生骨痂充填,色白微透明,表面不平整但较完整,质地较韧。见图6。
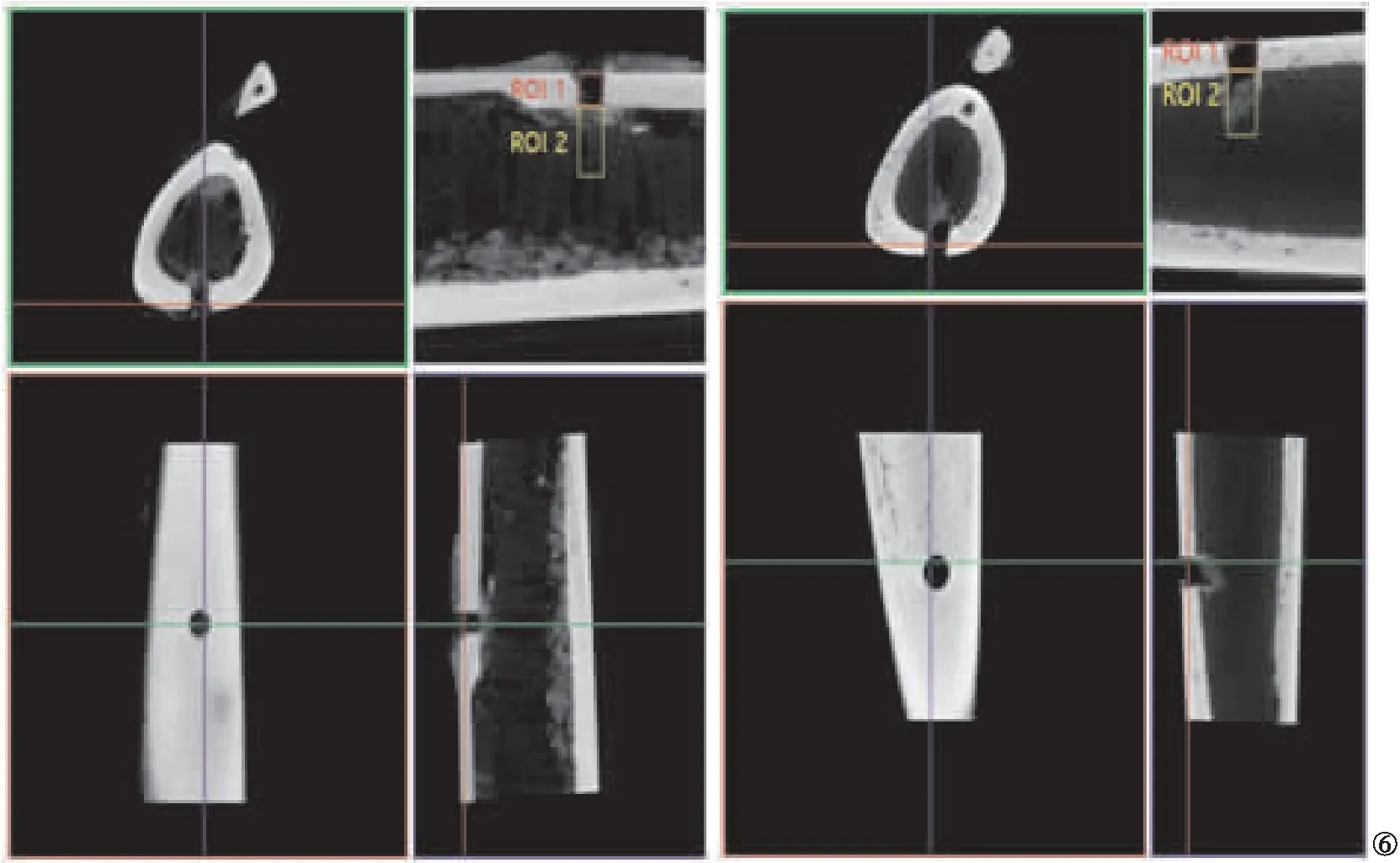
图6 显微CT扫描结果
2.5 骨小梁半定量分析结果 对照组大鼠中骨缺损区不均匀密度的新骨形成,骨小梁散在分布且体积不一,PCL-MT支架组大鼠可见大量纤维结缔组织,以及连续排列的骨小梁,活跃的成骨细胞。骨小梁半定量分析结果显示,PCL-MT支架组大鼠骨小梁数多于对照组,差异有统计学意义(P<0.05)。见图7。
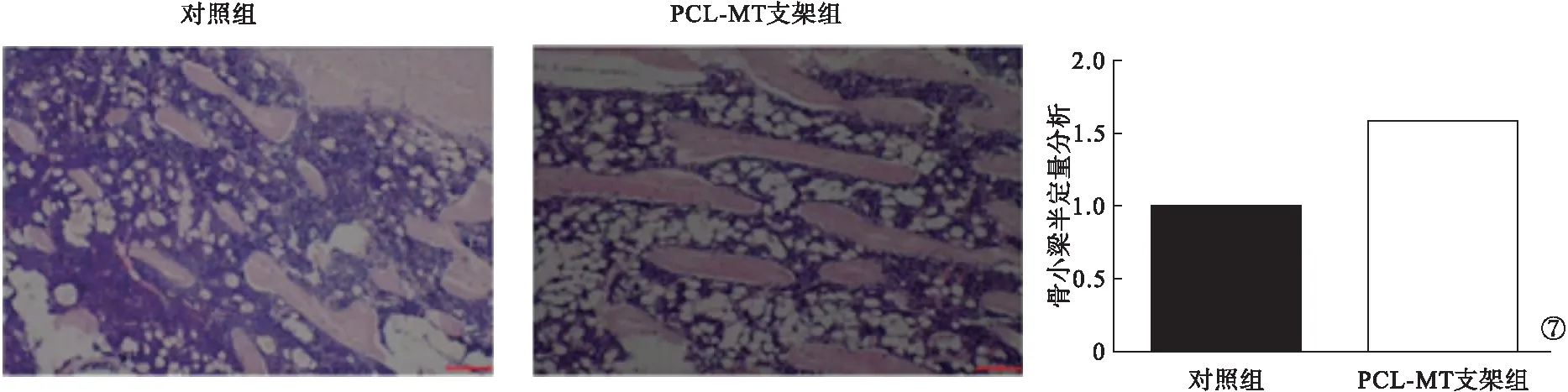
图7 骨小梁半定量分析结果
3 讨论
骨缺损发病率较高,主要通过骨移植术进行修复。自体骨移植虽然排异反应小,但来源有限且术后并发症较多;异体骨移植虽然来源广泛,但是排异反应较大,严重影响移植手术的成功率。PCL为一种生物可吸收聚合物,其性质稳定,价格低廉,但与其他复合材料相比,其生物活性较差,导致新的骨组织无法与聚合物表面紧密贴合,限制了新生骨在骨缺损部位的长入及替代[11-12]。有研究发现,MT具有下调RANKL抑制骨吸收的作用[13]。MT半衰期较短,阻碍了其在医用材料中的临床应用[14]。水凝胶具有高含水量和多孔结构的特点,能够较好地模拟人体组织的细胞外基质,促进营养物质与代谢废物的交换[15]。
本研究体外浸泡试验表明,支架的矿化厚度与腐蚀速率随时间延长逐渐增加,体外浸泡试验30 d后,PCL-MT支架仍具有清晰的轮廓。这提示,PCL-MT支架具有良好的生物活性。CCK-8实验检测结果显示,PCL-MT支架组的相对细胞增殖率明显高于对照组。这提示,PCL-MT支架的细胞活力更强。PCL-MT支架组大鼠的相对细胞增殖率明显高于对照组,差异有统计学意义(P<0.05)。使用荧光显微镜观察与浸出液共培养24 h的细胞,两组细胞均有良好的铺展形态与显著的肌动蛋白表达。这提示,PCL-MT支架具有良好的生物相容性。PCR法检测结果发现,PCL-MT支架组中的ALP、OCN、OPG mRNA表达均高于对照组,差异均有统计学意义(P<0.05)。这表明,PCL-MT支架具有更好的促进骨形成的能力。此外,骨小梁半定量分析结果显示,PCL-MT支架组大鼠骨小梁数多于对照组,差异有统计学意义(P<0.05)。提示PCL-MT支架对骨缺损具有良好的治疗作用。干细胞的成骨分化和成脂分化受到多种转录因子的调控,这些转录因子为调节干细胞成骨分化与成脂分化的开关[16]。在脂肪分化过程中,磷酸化转录调节因子β抗体与过氧化物酶体增殖物激活受体γ均被MT抑制,MT下调终末脂肪细胞分化的标志物,如瘦素、脂蛋白脂酶、脂联素与脂肪细胞蛋白,上调成骨细胞分化的标志物,如ALP、骨桥蛋白和骨钙素[17-20]。
综上所述,PCL-MT支架可有效促进骨缺损区新生骨组织生成。但关于MT介导成骨分化的促成骨诱导机制有待深入研究。
