影响血凝和血凝抑制试验因素的浅析
2023-01-17刘占艳
刘占艳
(山东省滨州市无棣县畜牧兽医管理服务中心,山东滨州 251900)
高致病性禽流感、新城疫等疫病对禽类养殖危害巨大,疫苗的免疫是防控该类疫病的主要途径,鉴于此,可借助检测抗体的方式实现对免疫结果的分析与考核及时掌握群体免疫动态,指导适合本场的免疫程序,以发挥疫苗的理想保护作用,达到最佳的免疫效果。对此,免疫抗体监测的准确性、可靠性、稳定性以及代表性对禽流感、新城疫等疾病的控制工作具有重要的意义与价值[1]。
血凝与血凝抑制试验是当前抗体监测的主要方法,本方法操作简单,但疏忽每一步均会直接影响最终判定结果。因此,为了更好地提高禽流感、新城疫的防控水平,提高抗体监测效果的实效性和试验结果的准确性,现对试验的影响因素做以下简要分析。
1 样品采集与处理
1.1 采样
可采集动物血液2~3mL,也可采集禽蛋蛋黄2mL。采集所使用的器具必须在有效期内,无菌、干燥、清洁;注射器应避免交叉使用,每个样品更换一次注射器或采血针,采血时的环境温度最好为20~25℃,禽类一般在翅静脉采血。
进针要准确,避免动物淤血导致采集血样溶血;采血速度要适中,血液从注射器移入离心管时,应取下针头缓慢注入,避免大量气泡产生。
采集蛋黄时应使禽蛋大头朝下,小头朝上,用酒精棉球将蛋壳表面擦拭干净,轻轻敲破蛋壳,可直接去掉注射器针头,吸取蛋黄,过程中尽量避免污染。
1.2 保存与运输
采集的活禽血样可自然或离心析出血清,应选择2000~3000r/min 离心3~5min 避免溶血。分离析出的血清如在5d 内检测的可放4℃冷藏保存;待检时间超过1 周的,需要冷冻保存。保存样品需密封并做好标记,避免交叉和污染。冷冻保存的血清避免反复冻融,影响抗体效价。
蛋黄为防止凝固最好在1~2d 内做完。鸭鹅血清有时会出现胶冻样血清,可用一次性移液管将胶冻样血清挑到管壁处,挤压几下,会得到所需血清;若挤压后无法析出血清的,可适当离心。
1.3 非特异性凝集和抑制因子的处理
影响非特异性反应的因素很多,鸭鹅血清中常含有非特异性抑制因子,在做试验前有必要去除。消除方法主要有:56℃水浴30min 灭活,受体破坏酶处理法(RDE),高碘酸盐-胰酶处理法,同种动物细胞处理法,红细胞吸附法等。
1.3.1 非特异性凝集素的处理
红细胞吸附法:配制20%鸡红细胞悬液,在清洁、干燥的微量血凝板上,加入50μL 待检血清和50μL 20%鸡红细胞悬液混匀,静置1h 以上,试验时吸取上清液。
1.3.2 非特异性抑制素的处理
受体破坏酶处理法(RDE):用25mL 无菌生理盐水溶解RDE,50μL 血清加200μL RDE 混匀后37℃水浴过液。然后加250μL 柠檬酸钠56℃水浴加热30min 以灭活RDE。待冷却至室温后将50%红细胞50μL和RDE 处理的血清500μL混匀,静置1h,1000r/min 离心10min 取上清液待检。
2 器材选用
2.1 微量血凝板
国标中选用96 孔V 型微量血凝板。一般血凝板可反复使用,也有一次性的。每次试验后要仔细清洗板孔,避免用尖锐物撮孔底导致板孔受损;多次使用后的血凝板应按清洗程序清洗;过分磨损的血凝板应弃置。
2.2 微量移液器
微量液器有单道和多道两种,试验中都需要用到。微量移液器使用也要掌握好技巧,尽可能减少误差。
2.2.1 移液器量程选择
移液器的可用量程范围是移液器最大量程的10%~100%,最佳使用量程范围是其最大量程的1/3 到其最大量程,可根据试验所需选择合适规格的移液器。
2.2.2 移液器使用方法
设定移液体积:调节旋纽从大量程调至小量程,若从小量程调节至大量程则应先调至超过设定体积刻度,再回调至设定体积,以保证移液器的精确度。
装配移液枪头:将移液枪垂直插入枪头,左右旋转上紧即可。严禁移液器撞击枪头。
吸液及放液:枪头尖端垂直浸入液面3mm 以下,吸液前枪头先在液体中预润洗3 次左右。排液时将枪头口贴到容器内壁并保持10~40° 倾斜,平稳地把按钮压到一挡,停约1s 后再压到二挡,排出剩余液体。
2.2.3 注意事项
当移液器枪头内有液体时切勿将移液器水平或倒置放置,以防液体流入活塞室腐蚀移液器活塞。使用完毕,将移液器刻度调至最大量程,并将其垂直挂在移液枪架上。在日常使用中,应避免混用而导致吸取的液体体积不准或放液不完全,严禁使用移液器吹打混匀液体。
安装吸头应稳固,避免漏气和掉落,保证吸取液体液面在同一平行线上。吸头管嘴避免过深插入液体。吸放的力度要均匀,吸取液体应缓慢平稳,以防液体吸入过快而冲入加样器内腐蚀柱塞造成漏气或产生气泡;致使所吸液体数量不准,而放液时应干脆利落。吸头与移液器最好配对,减少误差。
移液应选用洁净、无污染的移液槽,“专液专用”对不同液体应标识清楚,避免污染,影响试验结果。试验后应及时清洗干净,晾干或37℃恒温箱烘干备用。
3 试验操作
3.1 缓冲液
缓冲液体系在整个血凝及血凝抑制试验过程中需要保持一致性,参照国家标准,应选用0.01mol/L pH=7.2 的等渗磷酸缓冲液(PBS)。缓冲液使用HCl和NaOH 调节pH,并需要灭菌处理,PBS 一经使用,于4℃保存不超过2 周。缓冲液的酸碱度会对滴度造成影响,最好选择精确度高的pH 计调节pH。
3.2 1%红细胞悬液
配制红细胞悬液应采集3 只以上成年SPF 鸡或非免疫健康鸡,采血量与等量阿氏液混合,减少个体鸡只对病毒敏感差异以及自凝现象。洗涤红细胞一定要充分,转速1000r/min,离心10min,洗涤3 次。最后一次洗涤后,如果上清液呈红色,说明有溶血现象,则该红细胞悬液不能使用。建议使用与血清来源相同的禽种红细胞,以避免产生非特异性凝集[2]。
1%红细胞悬液4℃冷藏保存,使用1%红细胞悬液时,应轻摇至混合均匀,保证每个孔红细胞浓度一致。
3.3 病毒抗原
采集血样时,应向场主了解该禽群免疫疫苗的情况,为选择病毒抗原提供依据。首先应该选择与禽群免疫疫苗相同亚型株型的病毒抗原;其次选择与疫苗同一厂家的抗原做检测,提高检测的灵敏度。
病毒抗原试剂应严格按规定保存和使用,为避免感染和反复冻融,可无菌操作分成小包装。
3.4 4 个血凝单位(HAU)抗原
先对病毒抗原做血凝试验,能使红细胞完全凝集(100%凝集,++++)的抗原最高稀释度为该抗原的血凝效价,根据该血凝效价,配制4 个血凝单位(HAU)抗原。(如血凝效价为1:512(29)则4HAU=512/4=128,取12.7mLPBS 加抗原0.1mL 即配成1 : 128 的4HAU 抗原。)
4HAU 抗原应现配现用,若有2 孔凝集,2 孔不凝集则视为抗原配置正确。为确保4HAU 抗原准确,应对4HAU 抗原做回归试验,否则应重新确定血凝效价。如图1 所示(第5 孔为对照)
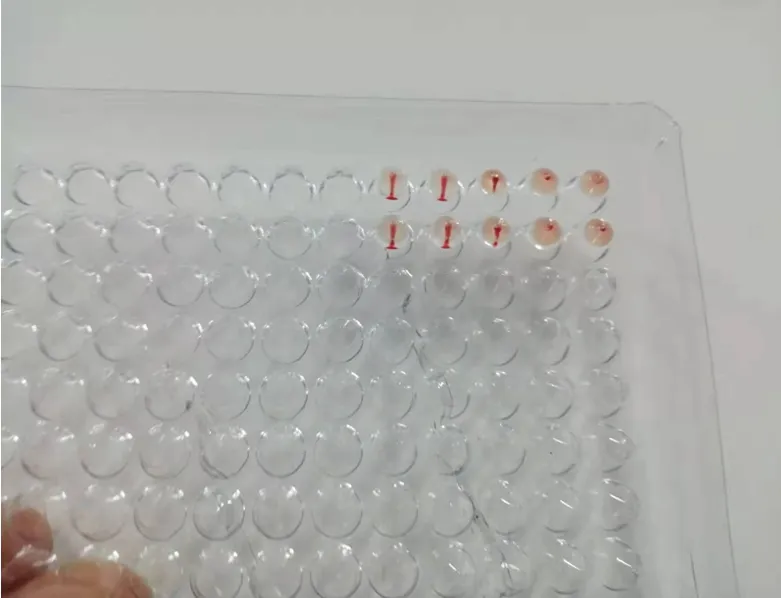
图1 4HAU 回归试验结果
配好的抗原室温下放置不得超过4h,4h 以上再使用时必须做回归试验,确保4HAU 抗原的准确性和下一步血凝抑制试验结果的灵敏度。
4HAU 抗原标定:在96 孔V 型板中第1~5 孔均加入PBS 25μL,然后第1 孔加入待检4HAU 抗原25μL倍比稀释至4 孔,5 孔作为对照,再在第1~5孔均加入1%红细胞悬液25μL混匀。将V 型板放在室温静置40min 读数。4HAU 抗原以凝集到第2 孔(1:4)为准,若凝集效价高于2 孔则表明配置的工作抗原效价偏高,低于2 孔则表示配置工作抗原效价偏低,根据凝集结果进行适当调整。
因此每次试验前要根据待测样品数量计算一下本次试验需要多少4 单位抗原和1%红细胞悬液,依据计算结果适当配制避免因多配而引起浪费。
3.5 加样
在试验中,要向96 孔V 型微量血凝板加样的过程应注意:移液器移取液体体积要准确一致,要加到板孔底部,避免加在孔壁上部,并注意不可溅出;倍比稀释待检血清时,吸头尽量不要离开液面,按压移液器时要匀速力均,避免产生气泡影响吸取体积;加入抗原和1%红细胞悬液时,要充分混匀,按照低倍到高倍的顺序,避免交叉。
3.6 温度和时间
试验前,样品和试剂均需缓慢恢复至室温,充分混匀并避免产生气泡。混浊或有沉淀的血清样品应先离心至澄清后再检测;孵育温度控制在室温20~25℃内,温度过低反应速度变慢,温度过高时反应结果洗脱。孵育时间也有严格要求,时间过短,反应未完全滴度偏低,时间过长,反应红细胞洗脱导致滴度偏高。孵育时间大约在30~40min,以红细胞对照孔完全沉淀前后5min 判定结果最佳[3]。
4 控制策略
为了更好地提高血凝和凝血抑制试验效果,可以采取以下措施进行改进。
4.1 数值处理
首先,确保血凝和血凝抑制试验操作过程的合理性,务必保障每一位检测人员的操作方式、步骤要符合相应标准,对于不合理操作出现的数据均需要重新检测。
其次,要明确血凝和血凝抑制试验的误差处理方式,检测过程中至少需要2 名专业人员(1 名检测、1名审核)对数据进行读取与记录,读数时应注意两点:第一是读取时视线的合理性,将V 型板倾斜成60 度角观察。第二是读取时间的合理性,室温(20~25℃)孵育40min,HA 试验观察红细胞有无泪珠状流淌,HI试验观察对照孔的红细胞呈显著纽扣状时读数。
4.2 结果分析
在血凝和血凝抑制试验中常见有以下2 种异常情况,需要对异常数据进行准确性分析。

图2 完全不凝集

图3 完全凝集
检测人员需要对异常数据的检测过程、结果等进行全面分析,明确异常数据的形成原因,如果异常数据属于检测失误导致的,要围绕这一失误进行总结反思,对结果异常的样本或试剂需要重新检测。工作人员还要根据实际情况采取相应方式进行处理,保障处理结果的准确性。
5 小结
影响血凝和血凝抑制试验效果的因素很多,主要涉及样本采集/处理、试剂配制、仪器的选择和使用、人员的操作和结果判定、环境温度等。因此,要严格按照规程认真操作。
在实际抗体监测中,必须全程进行严格要求和管理,发现问题要及时纠正。试验中除要注意试验操作细节外,平时应多组织实验室人员参加省市级实验室检测能力比对和兄弟县市实验室之间的比对与交流,以助于提高试验质量和结果。只有保障试验结果的可靠性才能真正做好对疫苗免疫效果评价,做好对禽流感、新城疫等病的预防工作,为动物疫病防控工作提供可靠的数据支撑。
