血栓通注射液对氧化应激及低氧条件下神经元的抑制作用及机理研究
2023-01-17任文娟赵晓燕
任文娟 赵晓燕
三七主要用于活血化瘀、消肿止痛等,近来发现其主要药效成分三七总皂苷(panax notoginseng saponins,PNS)用于心脑血管疾病的治疗。 血栓通是中药三七的提取物,其主要成分为三七总皂苷,三七总皂苷中含多种单体皂苷成份。 血栓通注射液具有改善脑供血,增加脑灌注,抑制血小板聚集,降低血黏度等多种作用。 目前,血栓通注射液治疗脑卒中意见不统一。 有学者认为,血栓通注射液有助于脑卒中的恢复,如Meng LP 等[1]发现PNS 可通过miR-155 调控炎症因子的表达,减轻SH-SY5Y 细胞缺血再灌注损伤。 但还有一些学者对血栓通注射液的细胞保护作用持有相反意见,比如聂亚雄等[2]发现血栓通注射液治疗超早期大量脑出血时,可加剧早期脑水肿,引起大鼠神经功能缺损计分增加。 在哺乳动物中,存在三个高度保守的Hedgehog同源基因:SonicHedgehog(Shh)、Indian Hedgehog(Ihh)和Desert Hedgehog(Dhh),它们分别编码Shh、Ihh 和Dhh 蛋白。 Shh 蛋白是一种细胞外的配体,Shh 通路上的启动蛋白。 细胞处于静止状态时,Shh蛋白与7 次跨膜受体Smo 蛋白结合,抑制Smo 活性,从而抑制其下游的反应。 当Shh 激活时,Shh 结合到12 次跨膜受体Ptch 蛋白上,解除Ptch 对 Smo的抑制作用,从而激活下游的Gli 家族蛋白,调节细胞周期进程、对抗凋亡、神经发生、细胞增殖和自我更新,参与损伤组织修复[3-4]。 近年来,Shh 通路在神经系统研究也颇多,如Jin 等[5]人发现Shh 激动剂激活Shh 通路可改善局灶性皮质缺血性损伤导致的行为缺陷。
本实验运用神经母细胞瘤细胞(SY5Y)及小鼠大脑皮层神经元,进行AAPH 氧化应激损伤,并将神经元进行氧糖剥夺(oxygen glucose deprivation,OGD)处理,模拟体外脑卒中,观察神经元氧化应激损伤及缺血缺氧的作用及对Hedgohog-Patched-Smoothened 信号通路的影响,探究血栓通注射液对脑卒中神经元的作用及可能机制。
1 材料与方法
1.1 实验动物和细胞
美国癌症研究所(institute of cancer research,ICR)SPF 级孕15 ~17 天小鼠,购自北京维通利华实验动物有限公司[许可证编号:SCXK(京)2012-0001]。 SC8 细胞、cyclopamine 为陈伟导师馈赠;感受态细胞为北京天坛医院李昊文老师馈赠。
1.2 实验药物与试剂
血栓通注射液为北京天坛医院杜万良老师馈赠,产自广西梧州制药公司。 TRIzol 试剂购自美国Invitrogen 公司;胰蛋白酶、DMEM 培养基、MEM 培养基、马血清(horse serum,HS)、胎牛血清(foetal bovine serum,FBS)购自美国 Gibco 公司;台盼蓝、DNA 酶I 购自美国Sigma 公司;CCK-8 试剂盒购自日本同仁化学研究所,SAG 购自Santa Cruz Biotechnology。
1.3 细胞培养
1.3.1 孕15 ~17 天小鼠胎鼠皮层神经元细胞原代培养 培养板的预处理:25 cm 细胞培养瓶或96孔细胞培养板,加入0.1g/L 多聚-L-赖氨酸包被2小时。 以三蒸水冲洗干燥后待用;孕15 ~17 天ICR 小鼠,常规麻醉消毒,剪开腹部皮肤及腹膜,取出胎鼠,放入预冷的DMEM 基础培养基中;将其放置于解剖显微镜下缓慢剥离胎鼠的头部皮肤与颅骨,暴露两侧大脑半球,用解剖镊小心分离并取出双侧皮层,轻轻剔除血管和脑膜组织,置于含预冷DMEM 基础培养基的6 cm 的培养皿中;将上述组织块移入至15 mL 离心管中,用1 mL 枪轻轻吹打使皮层成碎片,1500 r/分钟,离心5 分钟;去上清,加5 mL 0.25%胰蛋白酶和100 μL DNA 酶 I,在37℃水浴箱中作用15 ~20 分钟,其间振荡2 ~3次,当消化液混浊、不含有组织块时,加含10%FBS和10%HS 的DMEM/F12 培养基终止;将细胞悬液用70 目细胞筛过滤后,1500 r/分钟,离心5 分钟;弃上清,沉淀物中加入神经元接种培养基,台盼蓝染色,细胞计数板计数,以1×105/mL 的密度将细胞种植于培养板中,然后置于37℃、5% 的CO2培养箱中培养;4 小时细胞贴壁后,换神经元维持培养基,以后每周2 ~3次半量换液。
1.3.2 SY5Y 细胞培养 SY5Y 细胞置于含10%胎牛血清的DMEM/F12 培养基中,在37℃、5% CO2的恒温培养箱中培养,每隔2 ~3 天传代1 次。
1.3.3 SC8 细胞培养 SC8 细胞是U2OS 细胞稳定转染的βarr2-GFP 和 Smothened-633(Smo-633)的细胞系。 SC8 细胞置于含10%胎牛血清和抗生素(含100 U/mL 青霉素和 100 mg/mL 链霉素)的 MEM 培养基中,在37℃、5% CO2 的恒温培养箱中培养,每隔2 ~3 天传代1 次。
1.4 CCK-8 检测原代神经元细胞和SY5Y 细胞存活率
1.4.1 原代神经元细胞存活率 原代神经元细胞以1×105/mL 的密度接种于96 孔板,每孔100 μL,培养7 天进行实验,显微镜下观察神经元之间形成神经网络。 实验分为对照组、AAPH 组和AAPH+血栓通注射液组。 AAPH 组AAPH 浓度为20 mmol/L;AAPH+血栓通注射液组AAPH 浓度为20 mmol/L,血栓通注射液浓度分别为 0.125、0.25、0.5、1、2 mg/mL;对照组加同等体积的正常培养基,每组3 个复孔。 置入 37℃、5%CO2培养箱培养4 小时后,每孔加10 μL CCK-8 试剂,在 37℃孵育4 小时,用酶标仪在450 nm 波长处检测每孔的光密度,3 个复孔取平均值,计算细胞存活率。 实验重复3 次。 细胞存活率=[(As-Ab)/(Ac-Ab)]×100%[注:As:实验孔(含有细胞的培养基、CCK-8);Ac:对照孔(含有细胞的培养基、CCK-8);Ab:空白孔(不含细胞和CCK-8)]。 实验分为对照组、OGD 组和血栓通注射液组,对照组神经元培养基换成含糖Earle's 缓冲液,于37℃、5%CO2孵箱中常氧培养,OGD 组神经元培养基换成无糖Earle's 缓冲液,于37℃、5%CO2低氧孵箱中1%O2培养。 血栓通注射液组,培养基换成含 0.25、0.5、1、2 mg/mL 血栓通注射液的无糖Earle's 缓冲液,于37℃、5%CO2低氧孵箱中1%O2培养。 培养20 小时后,CCK-8 检测原代神经元存活率,检测方法同上。
1.4.2 SY5Y 细胞存活率 收集对数期生长的SY5Y 细胞接种于 96 孔板,100 μL/孔(约 2×105/mL),置 37℃,5% CO2细胞培养箱培养过夜。 将SY5Y 细胞分为对照组、AAPH 组和AAPH+血栓通注射液组。 AAPH 组 AAPH 浓度为 20 mmol/L。AAPH+血栓通注射液组AAPH 浓度为20 mmol/L,血栓通注射液浓度分别为0.015625、0.03125、0.0625、0.125、0.25、0.5、 1、2 mg/mL。 对照组加同等体积的正常培养基,每组3 个复孔。 置入37℃、5%CO2培养箱培养6 小时后,CCK-8 检测SY5Y 细胞存活率,检测方法同原代神经元的检测。
1.5 实时定量RT-PCR 的方法检测Gli1 的表达
原代神经元细胞以1×105/mL 的密度接种于6孔板上,每孔2 mL,培养至第7 天进行实验。 实验分为对照组、SAG 组、cyclopamine 组、血栓通注射液组、SAG+cyclopamine 组和SAG+血栓通注射液组。对照组神经元培养基换成无糖Earle's 缓冲液,于37℃ 、5%CO2低氧孵箱中 1% O2培养。 SAG 组,培养基换成含 0.05、0.1、0.25 μmmol/L SAG 的无糖Earle's 缓冲液,于37℃、5%CO2低氧孵箱中1%O2培养。 cyclopamine 组,培养基换成含 2 μmmol/L cyclopamine 的无糖 Earle's 缓冲液,于 37℃、5%CO2低氧孵箱中1% O2培养。 血栓通注射液组,培养基换成含 0.5、1、2 mg/mL 血栓通注射液的无糖Earle's 缓冲液,于37℃、5%CO2低氧孵箱中1%O2培养。 SAG+cyclopamine 组,换成同时含 0.05、0.1 μmmol/LSAG 和含 2 μmmol/L cyclopamine 的无糖Earle's 缓冲液,于37℃、5%CO2低氧孵箱中1%O2培养。 SAG+血栓通注射液组,换成同时含0.05、0.1 μmmol/L SAG 和含 2 mg/mL 血栓通注射液的无糖Earle's 缓冲液,于 37℃、5% CO2低氧孵箱中1%O2培养。 Trizol 法提取 RNA,用实时定量 PCR 仪检测神经元中Gli1 的表达。
1.6 共聚焦显微镜观察SC8 细胞中βarr2-GFP 的分布情况
将 SC8 细胞分为 4 组:对照组、SAG 组、cyclopamine组和血栓通注射液组。 对照组将培养基换成无糖Earle's 缓冲液,于 37℃、5%CO2低氧孵箱中 1%O2培养。 SAG 组,培养基换成含 0.25 μmmol/L SAG 的无糖 Earle's 缓冲液,于 37℃ 、5%CO2低氧孵箱中1%O2培养。 cyclopamine 组,培养基换成含2 μmmol/L cyclopamine 的无糖 Earle's 缓冲液,于37℃、5%CO2低氧孵箱中 1%O2培养。 血栓通注射液组,培养基换成含2 mg/mL 血栓通注射液的无糖Earle's 缓冲液,于37℃、5%CO2低氧孵箱中1%O2培养。 20 小时后,随机选取多个视野,激光共聚焦显微镜观察SC8 细胞中βarr2-GFP 的分布情况。
1.7 统计学处理
所有数据采用SPSS17.0 软件进行分析处理。本研究计量资料经检验均符合正态分布且方差齐,以均数±标准差()表示,数据采用t检验,组间比较用配对t检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 血栓通注射液对AAPH 造成SY5Y 细胞损伤的影响
AAPH 作为一个氧自由基诱发剂,可诱导氧化应激反应。 当20 mmol/L AAPH 作用SY5Y 细胞6小时后,与对照组相比,SY5Y 细胞存活率下降,差异有统计学意义(P<0.01)。 血栓通注射液作用后,加重了AAPH 造成的SY5Y 细胞的损伤,其中血栓通注射液浓度为 0.015625、0.03125、0.0625、0.125 mg/mL 时,细胞存活率与AAPH 组比较无统计学意义(P>0.05)。 当血栓通注射液浓度为0.25、0.5、1、2 mg/mL 时,细胞存活率下降,与 AAPH 组比较有统计学差异(P<0.01)。 见表1。
表1 不同浓度血栓通注射液对AAPH 造成SY5Y 细胞损伤的影响()
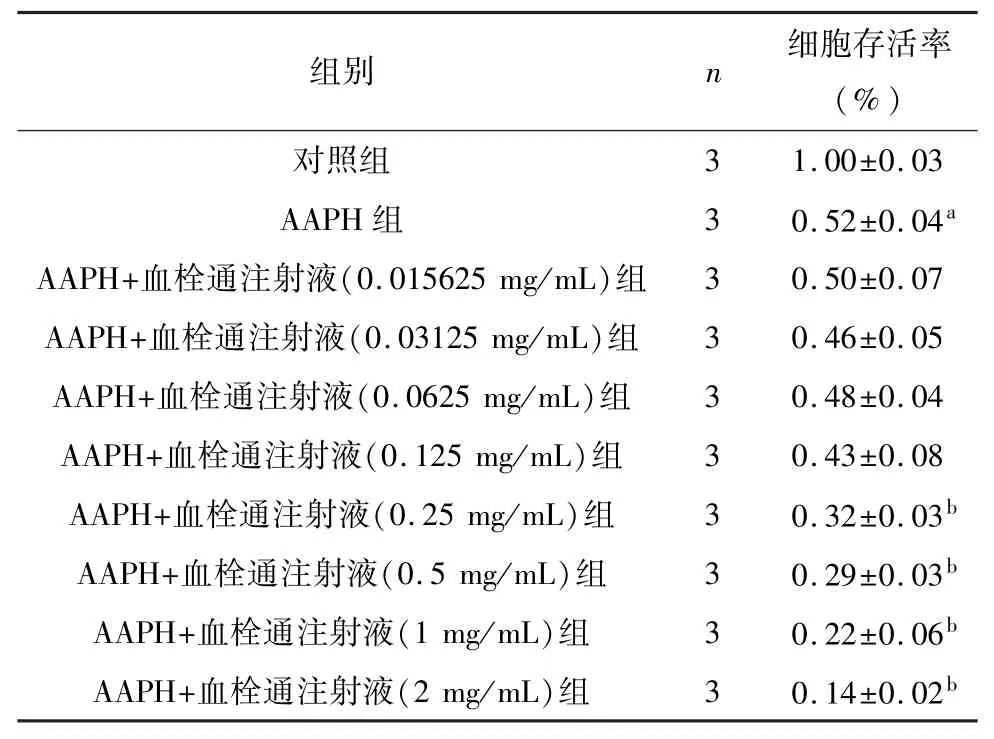
表1 不同浓度血栓通注射液对AAPH 造成SY5Y 细胞损伤的影响()
注: 与对照组比较,aP<0.01;与AAPH 组比较,bP<0.01。
组别 n 细胞存活率(%)3 1.00±0.03 AAPH 组 3 0.52±0.04a AAPH+血栓通注射液(0.015625 mg/mL)组 3 0.50±0.07 AAPH+血栓通注射液(0.03125 mg/mL)组 3 0.46±0.05 AAPH+血栓通注射液(0.0625 mg/mL)组 3 0.48±0.04 AAPH+血栓通注射液(0.125 mg/mL)组 3 0.43±0.08 AAPH+血栓通注射液(0.25 mg/mL)组 3 0.32±0.03b AAPH+血栓通注射液(0.5 mg/mL)组 3 0.29±0.03b AAPH+血栓通注射液(1 mg/mL)组 3 0.22±0.06b AAPH+血栓通注射液(2 mg/mL)组 3 0.14±0.02对照组b
2.2 血栓通注射液对AAPH 造成神经元损伤的影响
当20 mmol/L AAPH 作用神经元4 小时后,与正常对照组相比,神经元存活率下降,差异有统计学意义(P<0.01)。 血栓通注射液作用后,加重AAPH 造成神经元损伤,其中血栓通注射液浓度为0.125、0.25、0.5 mg/mL 时,神经元存活率与 AAPH组比较无统计学意义(P>0.05)。 当血栓通注射液浓度为1、2 mg/mL 时,神经元存活率下降至(0.29±0.06)、(0.16±0.06),与 AAPH 组比较有统计学差异(P<0.01)。 见表 2。
表2 不同浓度血栓通注射液对AAPH造成神经元损伤的影响()
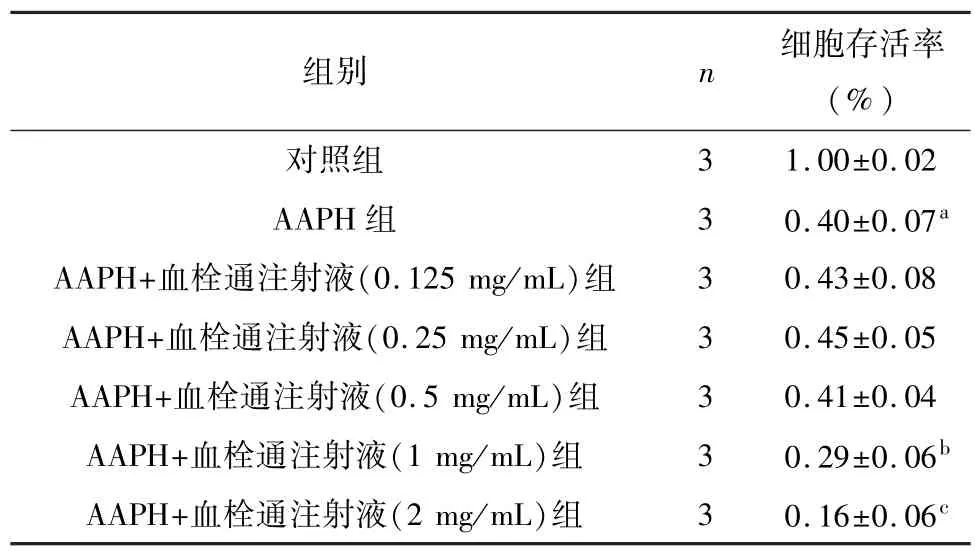
表2 不同浓度血栓通注射液对AAPH造成神经元损伤的影响()
注: 与对照组比较,aP<0.01;与AAPH 组比较,bP<0.05,cP<0.01。
组别 n 细胞存活率(%)3 1.00±0.02 AAPH 组 3 0.40±0.07a AAPH+血栓通注射液(0.125 mg/mL)组 3 0.43±0.08 AAPH+血栓通注射液(0.25 mg/mL)组 3 0.45±0.05 AAPH+血栓通注射液(0.5 mg/mL)组 3 0.41±0.04 AAPH+血栓通注射液(1 mg/mL)组 3 0.29±0.06b AAPH+血栓通注射液(2 mg/mL)组 3 0.16±0.06对照组c
2.3 血栓通注射液对低氧条件下神经元的存活率的影响
神经元的存活率降至(0.76±0.03), 较对照组明显下降(P<0.01)。 血栓通注射液作用后,加重了神经元的损伤,当血栓通注射液浓度为0.5、1、2 mg/mL时,神经元的存活率分别为(0.67±0.02)、(0.57±0.03)、(0.53±0.04),与 OGD 组相比均有统计学差异(P<0.01)。 PSN 可加重低氧条件下神经元的损伤,且呈剂量依赖性,随着血栓通注射液浓度的增加,神经元的存活率降低更加明显。 见表3。
表3 不同浓度下血栓通注射液对低氧条件下神经元存活率的影响()

表3 不同浓度下血栓通注射液对低氧条件下神经元存活率的影响()
注: 与对照组比较,aP<0.01;与OGD 组比较,bP<0.01。
组别 n 细胞存活率(%)3 1.00±0.02 OGD 组 3 0.76±0.03a OGD+血栓通注射液(0.25 mg/mL)组 3 0.72±0.03 OGD+血栓通注射液(0.5 mg/mL)组 3 0.67±0.02b OGD+血栓通注射液(1 mg/mL)组 3 0.57±0.03b OGD+血栓通注射液(2 mg/mL)组 3 0.53±0.04对照组b
2.4 血栓通注射液对低氧条件下神经元Gli1 表达的影响
在低氧环境中,0.25 μmmol/L SAG 可使 Gli1表达明显升高(P<0.01),与对照组比较增加(3.56±0.65 ) 倍。 Hedgehog 通 路 的 抑 制 剂cyclopamine可使Gli1 表达量下降,当cyclopamine 浓度为 2 μmmol/L 时,Gli1 表达量下降至(0.14±0.03)倍。 同样发现 0.5、1、2 mg/mL 血栓通注射液也可抑制 Gli1 的表达,Gli1 表达量分别下降至(0.30±0.08)、(0.16±0.04)、(0.15±0.03)倍,与cyclopamine 作用一致。 见表 4。
表4 不同浓度血栓通注射液对低氧条件下神经元Gli1 的表达的影响()
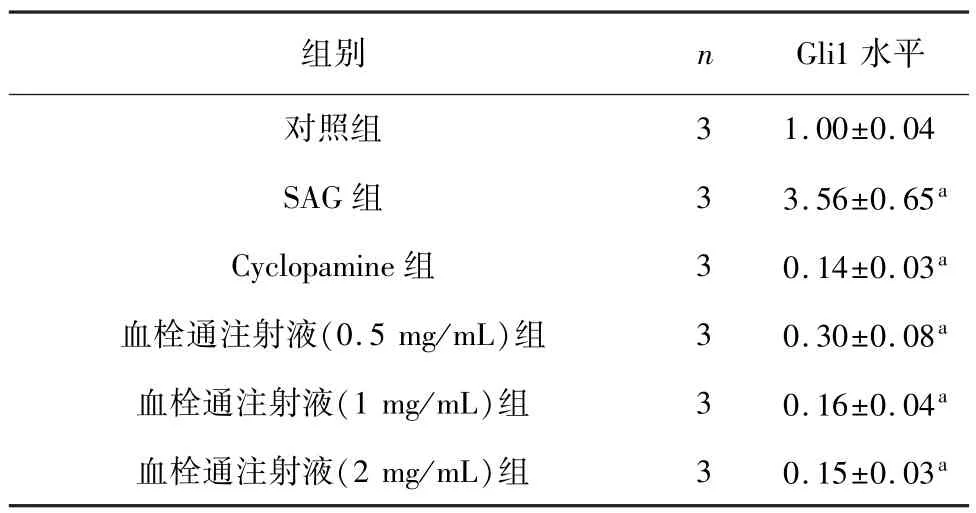
表4 不同浓度血栓通注射液对低氧条件下神经元Gli1 的表达的影响()
注: 与对照组比较,aP<0.01。
3 1.00±0.04 SAG 组 3 3.56±0.65a Cyclopamine 组 3 0.14±0.03a血栓通注射液(0.5 mg/mL)组 3 0.30±0.08a血栓通注射液(1 mg/mL)组 3 0.16±0.04a血栓通注射液(2 mg/mL)组 3 0.15±0.03水平对照组组别 n Gli1 a
2.5 血栓通注射液对低氧条件下SAG 导致的Gli1表达升高的影响
0.05 和 0.1 μmmol/L SAG 均可增加 Gli1 的表达,分别为(3.09±0.31)倍和(5.75±0.68)倍(P均<0.01),0.1 μmmol/L SAG 组 Gli1 增加更明显。 2 mg/mL 血 栓 通 注 射 液 和 2 μ mmol/L cyclopamine 均可降低Gli1 的表达,分别降至(0.19±0.06)倍和(0.08±0.01)倍(P均<0.01),结果与前面实验结果一致。 然而,当SAG 和血栓通注射液或cyclopamine 同时作用神经元时,发现血栓通注射液可抑制SAG 诱导的的Gli1 表达增加,血栓通注射液使0.1 μmmol/L SAG 组 Gli1 增加(5.75±0.68)倍降至增加(2.56±0.35)倍,使 0.05 μmmol/L SAG 组Gli1 增加(3.09±0.31)倍降至增加(1.7±0.21)倍(P均<0.01),作用与 cyclopamine 相似。 见表 5。
表5 血栓通注射液对低氧条件下SAG 导致的Gli1 表达升高的影响()

表5 血栓通注射液对低氧条件下SAG 导致的Gli1 表达升高的影响()
注: 与对照组比较,a P<0.01;与 SAG(0.1 μmmol/L)组比较,bP<0.01;与 SAG(0.05 μmmol/L)组比较,cP<0.01。
3 1.00±0.04 Cyclopamine 组 3 0.08±0.01a血栓通注射液组 3 0.19±0.06a SAG(0.1 μmmol/L)组 3 5.75±0.68a SAG(0.1 μmmol/L)组+Cyclopamine 组 3 2.23±0.38b SAG(0.1 μmmol/L)组+血栓通注射液组 3 2.56±0.35b SAG(0.05 μmmol/L)组 3 3.09±0.31a SAG(0.05 μmmol/L)组+Cyclopamine 组 3 1.95±0.23c SAG(0.05 μmmol/L)组+血栓通注射液组 3 1.71±0.21水平对照组组别 n Gli1 c
2.6 血栓通注射液对Smothened 的影响
根据激光共聚焦显微镜观察SC8 细胞中βarr2-GFP 的分布情况,判断血栓通注射液对Smothened(Smo)的作用。 对照组βarr2-GFP 呈点状聚集分布在细胞质(图 1A)。 当 2 μmmol/L cyclopamine 作用SC8 细胞时,βarr2-GFP 的分布发生变化,在细胞质呈现均匀分布(图1B)。 2 mg/mL 血栓通注射液处理SC8 细胞,βarr2-GFP 仍呈点状聚集分布在细胞质(图1C)。
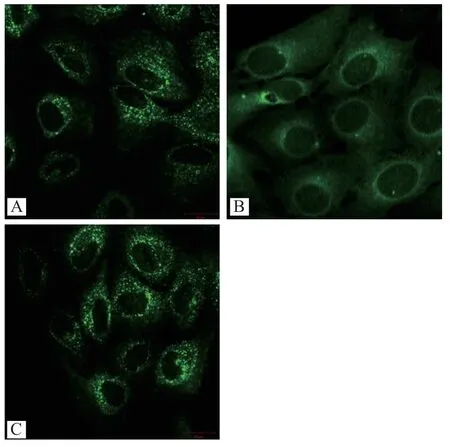
图1 激光共聚焦显微镜观察SC8细胞中βarr2-GFP 的分布情况
3 讨论
脑卒中是由脑血管病变引起的脑部疾病的总称,故又称为“脑血管病”。 脑缺血再灌注损伤是脑卒中很重要的病理生理过程,再灌注损伤主要是通过引起自由基过度产生及其“瀑布式”连锁反应等一系列氧化应激变化,导致细胞内大分子如核酸、脂质、蛋白质等的氧化损伤,从而引起神经细胞死亡[6-7]。
AAPH 作为一个氧自由基引发剂,可以诱导细胞内氧化损伤,产生各种病理变化,在氧化应激疾病模型中广泛应用[8-9]。 目前研究脑卒中的方法主要有体内大脑中动脉阻塞(middle cerebral artery occlusion, MCAO)和体外 OGD[10-11]。 如 MO ZT[11]以PC12 细胞OGD 为模型,模拟脑卒中,并探索石菖蒲提取物β-细辛脑对细胞自噬的作用等。 本研究以AAPH 作用造成氧化应激损伤及OGD 处理模拟体外缺血性脑卒中状态。 AAPH 可造成SY5Y 细胞及神经元损伤;神经元经OGD 处理20 小时后,神经元的存活率较正常对照组明显下降(P<0.01)。 这与缺血性脑卒中后神经细胞受损结果一致。
课题组还发现,血栓通注射液可加重AAPH造成的SY5Y 细胞及神经元细胞损伤;且血栓通注射液降低低氧条件下神经元的存活率,当血栓通注射液 浓度为 0.5、1、 2 mg/mL 时,与 OGD 组相比各组均(P<0.01),且呈剂量依赖性。 血栓通注射液是中药血栓通的主要成分,血栓通的主要成分为血栓通注射液,包含人参皂苷Rg1、人参皂苷Rb1、三七皂苷 R1 等。 在 MCAO 造成的大鼠脑梗死模型中,血栓通注射液能明显改善脑功能,改善脑血管渗漏,减少脑组织内炎性细胞浸润,对大鼠脑微血管内皮细胞进行OGD 处理,发现血栓通注射液可降低TNF-α、IL-8 及RIG-I 受体通路调控的下游细胞因子水平,血栓通注射液可能是通过RIG-I 信号通路发挥脑缺血时抗炎作用[12]。 HU SN 等[13]发现三七皂苷可通过激活PI3K/Akt/Nrf2通路,从而保护脑微血管内皮细胞因缺血再灌注诱导的血脑屏障破坏。 但是,部分学者对血栓通注射液的细胞保护作用持有相反意见。 在探索血栓通注射液对脑出血大鼠脑水肿超早期影响的研究[2]中发现,较脑出血模型组,血栓通注射液可加重大鼠神经缺损症状,增加脑含水量及钠离子含量,说明血栓通注射液治疗超早期脑出血,可加剧脑水肿,加重大鼠神经功能缺损症状。 LI SY等[14]研究发现,人参皂苷Rd 本身对BASMCs 细胞无毒性作用,但可加重H2O2造成BASMCs 细胞存活率的下降,并且呈现浓度依赖性。 H2O2作用BASMCs 细胞后,早期凋亡率为(20.9±3.8)%,10 μmmol/L人参皂苷 Rd 预处理 30 分钟,细胞凋亡率下降到(31.5±3.6)%,人参皂苷可加重H2O2造成的促凋亡蛋白Bax 的增加,抗凋亡蛋白Bcl-2的降低和Bcl-2/Bax 比率的降低,增加细胞色素C的释放和caspase-9/caspase-3 激活,并降低线粒体膜电位的稳定性。
近年来,Shh 通路在缺血性脑病的研究中越来越多。 Shh 通路通过上调紧密连接(TJ)蛋白促进血脑屏障完整性,对卒中后血脑屏障破坏产生保护作用[15]。 ZHANG J 等[16]发现 SD 大鼠经过 MCAO后,立即给予侧脑室注射 Shh 通路抑制剂cyclopamine,24 小时后与对照组比较,cyclopamine组Gli1、Ptch1 与SOD1 表达下降,梗死面积增加,脑水肿明显,神经行为缺损加重。 这些数据表明,抑制Shh 通路后,加重脑卒中的神经损伤。 在本实验中,发现血栓通注射液可以抑制神经元OGD 后Gli1 的表达。 SAG 是 Shh 通路 Smo 的激活剂,可使 Gli1 表达升高,cyclopamine 是Smo 的抑制剂,可使Gli1 表达下降,因此选用SAG 和cyclopamine 作为本实验的阳性对照药物。 神经元经过OGD 处理后,0.25 μmmol/L SAG 可使 Gli1 表达明显升高(P<0.01),2 μmmol/L cyclopamine 可使 Gli1 表达量下降,0.5、1、2 mg/mL血栓通注射液也可抑制Gli1 的表达,与cyclopamine作用一致。 并且,经过进一步研究,课题组发现血栓通注射液可抑制 SAG 导致的 Gli1 的升高。 当SAG 和血栓通注射液或cyclopamine同时作用神经元时,发现血栓通注射液可抑制SAG 诱导的的Gli1 表达增加,作用与cyclopamine 相似。
Smo 受体激动剂具有保护神经和促进缺血性脑损伤后再生的作用[17]。 Smo 激活后对G 蛋白偶联受体(G protein coupled receptor,GPCR)信号通路有重要作用,它可以磷酸化GPCR,招募βarr2 蛋白聚集,发挥内吞作用[18]。 在正常情况下,βarr2 均匀分布于细胞质中,当 Smo 或者 Smo-633 过表达时,βarr2 在细胞质中发生点状聚集,经过cyclopamine处理后,βarr2 又重新均匀分布于细胞质中[18]。 课题组发现,SC8 细胞中由于Smo-633 过表达,βarr2-GFP 呈点状聚集分布在细胞质,给予cyclopamine 处理,发现βarr2-GFP 均匀分布于细胞质中,与之前研究相似。 为了验证血栓通注射液是否通过Smo 抑制Gli1 的降低,故用血栓通注射液作用SC8 细胞,发现血栓通注射液组,βarr2-GFP 呈点状聚集分布在细胞质,说明血栓通注射液不能抑制Smo,可能抑制Smo 下游信号分子。
综上所述,血栓通注射液加重体外低氧后神经元的损伤,可能通过抑制Hedgehog 通路发挥作用,血栓通注射液抑制低氧条件SAG 导致的Gli1 表达升高,而不影响Smo,说明其可能通过抑制Smo 下游因子来抑制Gli 的表达。 因此,中药血栓通注射液应用于脑血管病的治疗时要“辨证论治”,依据中医理论和中药药理学辨证选药,科学、规范、系统地治疗脑血管病。 本实验亦有不足之处,体外低氧状态模拟脑卒中有一定的局限性,需进一步的验证。
