miR-27a-3p靶向表皮生长因子受体减轻脑出血引起的脑损伤
2023-01-16王晓辉刘小玲陕西省人民医院神经内一科西安710068通讯作者maildocjiangfeng163com
王晓辉,刘小玲,胡 军,王 乐,蒋 锋(陕西省人民医院神经内一科,西安 710068;通讯作者,E-mail:docjiangfeng@163.com)
非外伤性脑实质内血管破裂导致的脑出血(intracerebral hemorrhage,ICH)占急性脑血管病的20%~30%,ICH后几乎立即出现血肿周围水肿(perihematomal edema,PHE),并且血肿会导致脑组织受压,从而引发机械损伤和继发性脑损伤,以及炎症反应、神经元死亡和神经功能缺损[1]。在ICH发病率逐年上升的同时,约20%的ICH患者接受手术治疗后仍遭受不同程度的神经功能障碍[2]。
微小RNA(miRNA)是一类内源性长度为18~23个核苷酸的小型非编码RNA,通过与靶mRNA的3′-UTR结合,在转录水平调节靶mRNA表达[3]。血清miRNA水平失调与癌症、心血管疾病、缺血性中风和ICH等脑损伤紧密关联[4-6]。因此,血清miRNA被认为是可靠的疾病诊断生物标记[7,8]。
miRNA阵列分析研究显示miR-27a-3p在ICH患者血清中表达下调[9],并在动脉瘤性蛛网膜下腔出血患者脑脊液中也检测到miR-27a-3p表达水平降低,而血管痉挛患者miR-27a-3p表达水平降低尤为明显[10]。但目前尚不清楚miR-27a-3p能否减轻ICH引起的脑损伤和神经炎症反应。本研究通过构建脑出血大鼠模型,转染miR-27a-3p进而研究miR-27a-3p在大鼠ICH引起的脑损伤中的作用和机制。
1 材料与方法
1.1 材料
成年雄性Sprague-Dawley大鼠购于邯郸康业制药有限公司(许可证:SYXK(冀)2017-004),体质量250~280 g。pcDNA3.1-EGFR重组质粒委托上海吉玛基因合成。原位细胞凋亡检测试剂盒(Roche公司,瑞士),BCA分析试剂盒(上海碧云天生物技术研究所),强型化学发光试剂盒(Thermo Scientific公司,美国),Hairpin-itTMmiR-21/mRNA RT-PCR定量试剂盒(上海吉玛制药技术有限公司)。水合氯醛(Sigma公司,美国),二氨基联苯胺(Sigma,美国),裂解缓冲液(上海碧云天生物技术研究所),LipofectamineTM3000试剂(ThermoFisher公司,美国),TRIzol试剂(Invitrogen公司,美国)。DAPI(北京索莱宝科技有限公司),MPO抗体、一抗Occludin和一抗Claudin-5(武汉博士德生物工程有限公司),OX-42抗体、Cy3标记的山羊抗兔IgG和山羊抗小鼠IgG(上海碧云天生物技术研究所),一抗EGFR和β-actin(Santa Cruz公司,美国)。PVDF膜(Millipore公司,美国),奥林巴斯IX81显微镜(OLYMPUS,日本)。
1.2 ICH大鼠模型构建
ICH模型建模方法如下:大鼠经35 mg/kg水合氯醛腹腔注射麻醉后,取尾动脉不抗凝血50 μl,通过脑立体定向技术注入大鼠脑内右侧尾壳核,术毕后用医用骨蜡封闭针孔,造模完成。40只建模的大鼠共有36只建模成功,成功率为90%。将36只建模成功的大鼠随机分为模型组、miR-27a-3p干预组(miR-27a-3p组)和miR-27a-3p+pcDNA3.1-EGFR干预组(pcEGFR组),每组12只。另取12只大鼠作为假手术组,假手术组大鼠只进针不注血。在诱导ICH模型成功后15 min,将miR-27a-3p或重组质粒pcDNA3.1-EGFR(10 μmol/L)加到LipofectamineTM3000中,通过立体定向技术1 μl/min连续注射,构建miR-27a-3p干预组和miR-27a-3p+pcDNA3.1-EGFR干预组(pcEGFR)。假手术组和模型组大鼠脑内同时注射等量转染试剂。术后缝合创口皮肤,让大鼠恢复并自由进食24 h。本研究经陕西省人民医院伦理委员会审批通过(审批号:SXDL-S20210318-02)。
1.3 免疫荧光染色检测MPO阳性细胞数量变化
在大鼠ICH造模成功后72 h,对4组大鼠采用戊巴比妥钠麻醉处理,然后断头处死,立即将大鼠脑组织取出并分成5个部分超低温冷冻备用。取假手术组、模型组和miR-27a-3p组大鼠部分脑组织经4%多聚甲醛固定液于4 ℃下持续固定24~48 h,再进行常规脱水、透明、浸蜡、包埋,在切片机上连续冠状切片,片厚5 μm。将切片在60 ℃下预热30 min,经二甲苯脱蜡,然后以浓度递减乙醇重新水化。将切片用山羊血清4 ℃封闭过夜。切片于过氧化物酶(myeloperoxidase,MPO)抗体(1 ∶200稀释)在4 ℃缓慢摇动孵育过夜。将切片用免疫染色洗涤液冲洗3次。再将切片与Cy3标记的山羊抗兔IgG(1 ∶300稀释)在黑暗中缓慢摇动孵育1 h。最后,用DAPI对细胞核进行染色。使用奥林巴斯IX81显微镜观察拍照,并对MPO阳性细胞进行定量分析。
1.4 TUNEL分析细胞凋亡
使用原位细胞凋亡检测试剂盒分析假手术组、模型组和miR-27a-3p组大鼠脑血肿周围区域的细胞凋亡情况。脑组织切片与Triton X-100温育去除石蜡化,并用3%过氧化氢淬灭内源性过氧化物酶。根据试剂盒使用说明,将切片与TUNEL反应混合液孵育,标记凋亡细胞中断裂的DNA链。用PBS洗涤3次,滴加二氨基联苯胺显色。荧光显微镜下计数凋亡细胞(激发光波长为450~500 nm,检测波长为515~565 nm,400倍光镜),随机观察并计数血肿周围3个不重复视野内TUNEL阳性细胞数目,计算平均值。
1.5 免疫组织化学分析小胶质细胞活化水平变化
取假手术组、模型组和miR-27a-3p组大鼠的脑组织切片经PBS漂洗后,与3 g/L的Triton X-100孵育脱蜡,用PBS洗涤3次。切片与小鼠抗OX-42抗体(1 ∶3 000稀释)孵育过夜,PBS洗涤3次。将切片与生物素标记的山羊抗小鼠IgG(1 ∶500稀释)孵育4 h,PBS洗涤3次。再将切片与生物素-卵白素-HRP复合物(1 ∶500稀释)浸泡4 h,PBS洗涤3次。用葡萄糖氧化酶-DAB-硫酸镍铵法染色,用蒸馏水冲洗3次。使用奥林巴斯IX81显微镜观察并采集图像,选择血肿周围3个不重复视野,OX-42产物呈蓝色判定为阳性。
1.6 Western blotting分析Occludin、Claudin-5和EGFR蛋白表达水平
取假手术组、模型组和miR-27a-3p组大鼠的脑组织与裂解缓冲液混合后在冰上裂解处理。裂解混合物以10 000g,4 ℃离心10 min,使用BCA分析试剂盒测定上清液中的蛋白质浓度。样品经SDS-PAGE分离后转移至PVDF膜。将膜用5%脱脂牛奶封闭1 h,然后与抗Occludin(1 ∶400稀释)、抗Claudin-5(1 ∶1 000稀释)、抗EGFR(1 ∶400稀释)和β-actin(1 ∶1 000稀释)在4 ℃孵育过夜。膜用0.15%Tween 20-TBS洗涤4次,然后将膜与辣根过氧化物酶标记的山羊抗兔IgG(1 ∶5 000稀释)在37 ℃下孵育45 min。使用增强型化学发光试剂盒显影,使用Media Cybernetics Gel-Pro Analyzer软件(Rockville)通过光密度测定法确定蛋白条带强度。
1.7 qRT-PCR检测基因表达水平
采集假手术组、模型组、miR-27a-3p组和pcEGFR组各6只大鼠的眼眶静脉丛血0.5 ml,在4 ℃下以2 000 r/min离心10 min后获得血清;取假手术组、模型组、miR-27a-3p组和pcEGFR组大鼠的脑组织。使用TRIzol试剂抽提大鼠脑组织和血清的总RNA,使用Hairpin-itTMmiR-21/mRNA RT-PCR定量试剂盒进行cDNA扩增和qRT-PCR检测,使用7500HT PCR系统进行PCR操作,设计相关引物序列(见表1)。所有PCR反应均按照标准PCR条件进行:95 ℃预变性10 min;95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸30 s,40个循环。以U6或β-actin为作内部参考基因。使用Opticon Monitor分析软件(MJ Research)计算循环阈值(Ct值),通过相对定量(2-ΔΔCt)计算表达的倍数变化。

表1 qRT-PCR检测相关基因引物序列Table 1 Primer sequences of related genes for qRT PCR
1.8 miR-27a-3p与EGFR的靶向关系分析
采用Target Scan Human和miRDB在线预测miR-27a-3p与EGFR的靶向关系。
1.9 脑含水量测定
取假手术组、模型组、miR-27a-3p组和pcEGFR组这4组大鼠的脑组织,使用干重法测定各组大鼠脑水分含量。取各组部分备用组织样品放置在铝箔片上分析天平称量获得湿重,然后在电烤箱中于100 ℃干燥24 h,再称量得到干重。使用以下公式计算脑含水量:(湿重-干重)/湿重×100%。
1.10 统计学分析
所有数据表示为平均值±标准偏差,使用SPSS18.0软件进行统计分析,两组间比较采用t检验,多组间比较采用单因素方差分析,两两比较采用LSD检验。P<0.05表示差异具有统计学意义。使用Pearson相关性分析进行miR-27a-3p表达水平和EGFR蛋白表达水平之间的相关性分析。
2 结果
2.1 造模大鼠血清以及血肿周围组织的miR-27a-3p水平变化
结果显示,与假手术组大鼠相比,模型组大鼠的血清中miR-27a-3p表达水平降低(P<0.01),血肿周围组织中miR-27a-3p表达水平降低(P<0.01,见图1)。
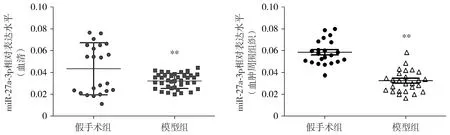
与假手术组比较,**P<0.01图1 ICH模型组和假手术组大鼠的血清和血肿周围组织的miR-27a-3p表达水平检测Figure 1 The miR-27a-3p expression in the serum and the edema around the hematoma in ICH rats and sham rats
2.2 miR-27a-3p干预对大鼠紧密连接蛋白表达的影响
咬合蛋白(Occludin)和闭合蛋白(Claudin)的Western blotting分析结果表明,模型组大鼠的Occludin和Claudin-5蛋白表达水平均低于假手术组(P<0.001),而miR-27a-3p组大鼠Occludin和Claudin-5蛋白表达水平则显著高于模型组(P<0.05,见图2)。
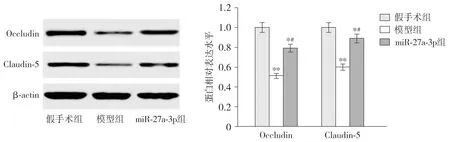
与假手术组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05图2 Western blotting检测miR-27a-3p对大鼠脑组织中紧密连接蛋白表达的影响Figure 2 Effects of miR-27a-3p on expression of tight junction proteins in rat brain tissue by Western blotting
2.3 miR-27a-3p干预对大鼠血肿周围区域神经元凋亡的影响
大鼠脑组织切片原位细胞凋亡检测结果显示,假手术组大鼠脑组织切片几乎没有TUNEL阳性凋亡神经元,模型组大鼠TUNEL阳性凋亡神经元数量显著高于假手术组(P<0.01);与模型组比较,miR-27a-3p组大鼠TUNEL阳性凋亡神经元数量显著降低(P<0.05,见图3)。
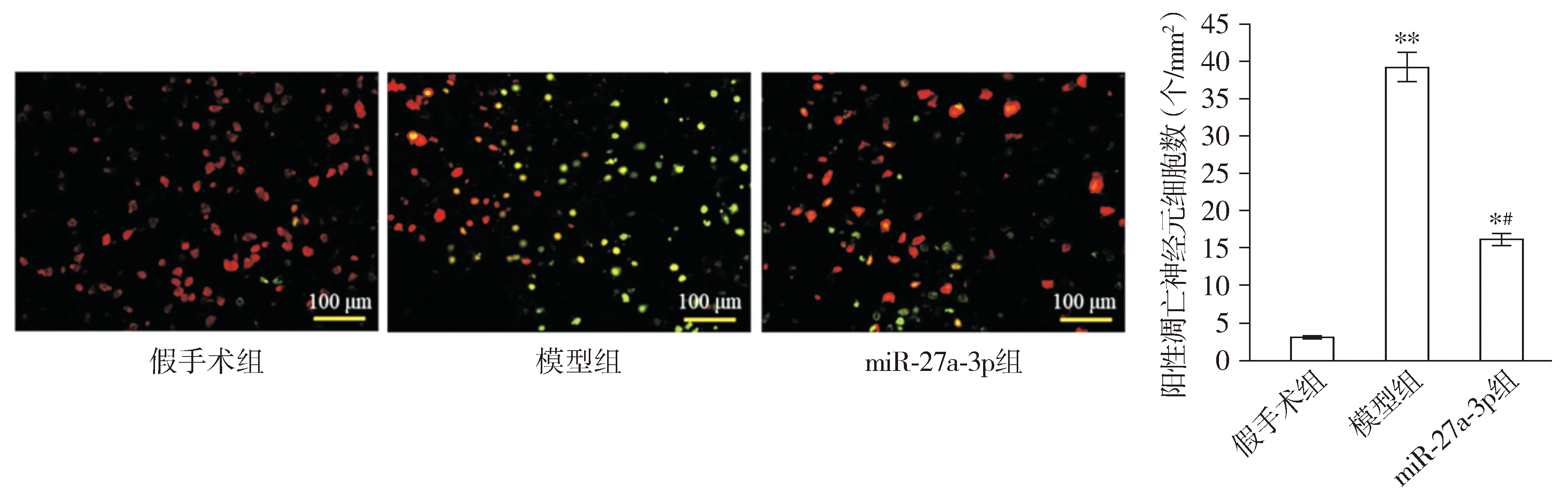
红色为神经元细胞,绿色为凋亡神经元细胞;与假手术组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05图3 大鼠脑组织中神经元NEUN染色和凋亡细胞TUNEL染色Figure 3 NEUN staining and TUNEL staining of apoptotic cells in rat brain tissue
2.4 miR-27a-3p干预对大鼠血肿周围区域白细胞浸润的影响
MPO免疫荧光染色检测结果显示,与假手术组相比,模型组大鼠的MPO阳性细胞数量明显增加(P<0.01);与模型组相比,miR-27a-3p组大鼠的MPO阳性细胞数量降低(P<0.05,见图4)。血肿周围区域OX-42阳性小胶质细胞免疫组织化学检测结果表明,模型组大鼠血肿周围区域OX-42阳性细胞数量显著高于假手术组(P<0.01),而miR-27a-3p组大鼠OX42阳性细胞数量低于模型组(P<0.05,见图4)。
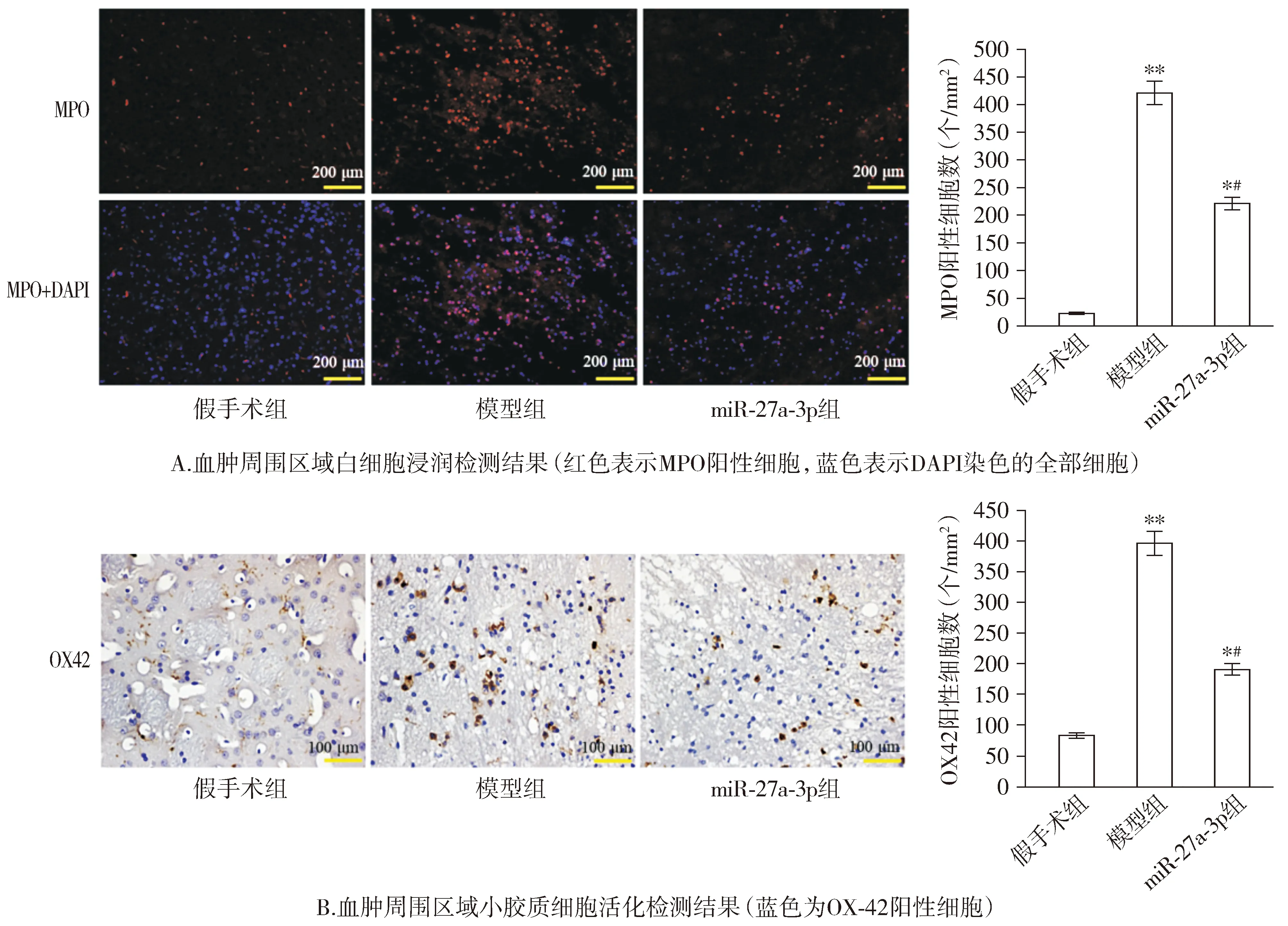
与假手术组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05图4 miR-27a-3p干预对大鼠脑血肿周围区域白细胞浸润和小胶质细胞活化的影响Figure 4 Effect of miR-27a-3p interference on leukocyte infiltration and microglial activation in the pericerebral hematoma of rats
2.5 EGFR是miR-27a-3p的直接效应靶标
使用Target Scan Human和miRDB在线预测,结果发现miR-27a-3p靶向EGFR的3′-UTR(见图5A)。Pearson相关性分析结果显示,在36个ICH大鼠模型中,72 h时血清miR-27a-3p水平和EGFR蛋白表达水平之间呈负相关(r=-0.371,P=0.011,见图5B)。
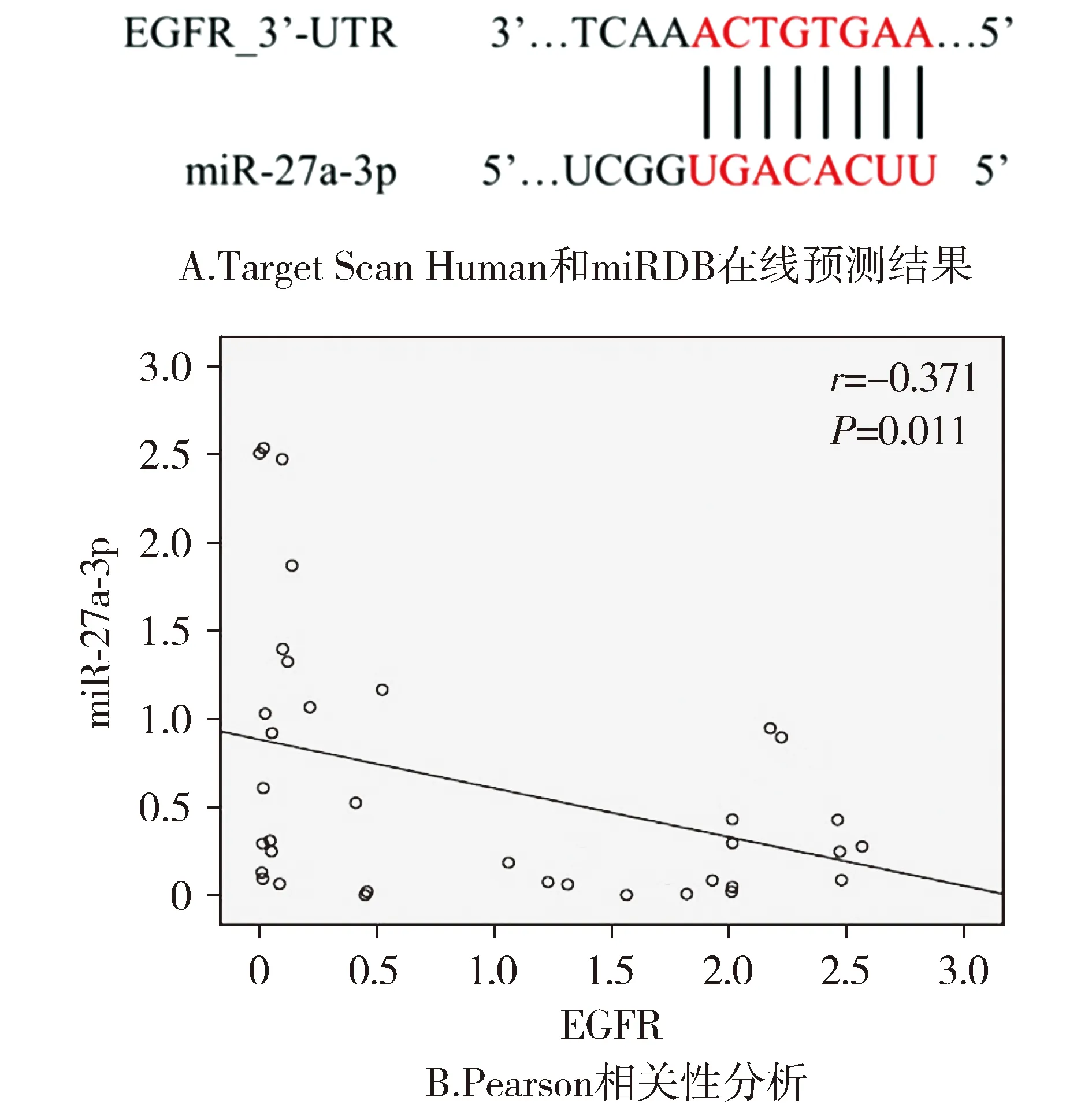
图5 EGFR与miR-27a-3p的靶标关系分析Figure 5 Analysis of target relationship between EGFR and miR-27a-3p
EGFR过表达实验进一步验证了EGFR与miR-27a-3p间的相关性。qRT-PCR结果显示,模型组大鼠EGFR的mRNA表达水平明显高于假手术组(P<0.05),miR-27a-3p组大鼠EGFR的mRNA表达水平相较于模型组显著下降(P<0.05),而pcEGFR组大鼠EGFR的mRNA表达水平明显高于miR-27a-3p组(P<0.05,见图6)。同时,大鼠脑含水量变化趋势与qRT-PCR检测结果一致(见图6)。
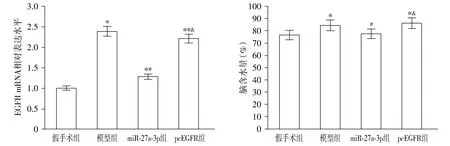
与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与miR-27a-3p组比较,&P<0.05图6 miR-27a-3p对大鼠EGFR和脑含水量的影响Figure 6 Effect of miR-27a-3p on EGFR and brain water content in rats
3 讨论
脑出血(ICH)作为中老年人和高血压病人这一群体的多发疾病,其发病突然,早期的死亡率很高,严重危害人类的身心健康康。ICH发生后出现的血肿会进一步导致脑组织受压,发生继发性脑损伤,从而引发炎症、细胞凋亡和神经损伤等一系列的生理变化。临床上针对患者脑出血早期的诊断,对于患者病情程度的判断和治疗方案的制定十分重要。目前,血清miRNA已被认为是可靠的脑部疾病诊断生物标记,已有研究报道miR-27a-3p在ICH患者血清中表达发生下调[9]。
在本研究结果中,miR-27a-3p在ICH模型大鼠的血清和血肿周围组织中的表达均发生明显下调,这与已报道的临床中miR-27a-3p的数据结果一致[11]。miR-27a-3p干预可显著缓解ICH诱导的脑水肿、神经元凋亡,并抑制白细胞浸润到ICH大鼠血肿周围区域。这表明miR-27a-3p在维持ICH后大脑稳态方面至关重要。
咬合蛋白(Occludin)和闭合蛋白(Claudin)是内皮细胞间紧密连接复合物的主要构成组分[12],对维持血管和血脑屏障(blood-brain barrier,BBB)的正常生理功能尤为重要[13,14]。本研究中免疫荧光和Western blotting实验结果显示,ICH模型大鼠脑组织中Occludin和Claudin-5蛋白的表达水平明显下调,而miR-27a-3p的干预能够显著上调Occludin和Claudin-5蛋白的表达水平。这表明,miR-27a-3p可能通过上调紧密连接复合物表达水平,减轻ICH后期脑损伤程度。
细胞凋亡是ICH血肿周围区域细胞死亡的主要形式[15-17],抑制ICH诱导的神经元凋亡能够显著改善神经功能障碍[18]。在本研究实验结果中,miR-27a-3p干预可以显著降低血肿周围区域神经元的凋亡率。这可能归因于血肿周围区域水肿和炎症的减少[19]。
MPO蛋白水平及活性变化是多形核白细胞的特异性功能标志和激活状态标志[20],并参与调节炎症反应的多个生理过程[21,22],而炎症反应是导致脑损伤的主要因素[23,24]。本研究实验结果显示,miR-27a-3p显著减少了ICH模型大鼠血肿周围区域中MPO阳性细胞数量。结合miR-27a-3p在维持血管和血脑屏障功能方面的作用,表明miR-27a-3p可降低白细胞浸润,从而减少血肿周围的炎症损伤。
小胶质细胞/巨噬细胞在清除死亡神经细胞和恢复神经功能方面发挥着重要作用[25,26]。然而,小胶质细胞的过度活化会加剧ICH诱导的脑损伤[27]。抑制小胶质细胞活化已显示可减轻ICH引起的脑损伤[28]。本研究实验结果显示,miR-27a-3p能显著降低OX-42阳性细胞激活为小胶质细胞数量。这表明miR-27a-3p可能通过抑制小胶质细胞的激活发挥神经保护作用。
随着脑出血时间延长,血肿周围脑组织EGFR表达逐渐上调[29]。而miR-7通过抑制EGFR/STAT3信号通路拮抗星形胶质细胞活化,能够减轻大鼠脑出血后脑损伤[30]。本研究结果也表明,miR-27a-3p可能靶向EGFR的3′-UTR;而miR-27a-3p干预能够显著降低血肿周围区域EGFR表达水平。
综上,miR-27a-3p干预可显著减轻ICH诱导的脑水肿,白细胞浸润和神经元凋亡,以减轻ICH神经功能损伤。miR-27a-3p的神经保护作用可能是通过调节紧密连接复合物和EGFR的表达来维持血脑屏障正常生理功能。miR-27a-3p有望作为一个新的药理学靶点,通过刺激内源性miR-27a-3p表达,或外源性输入其激动剂,作为促进脑出血后神经功能恢复的新型治疗策略。这也是我们下一步以动物为模型,展开miR-27a-3p相关药理治疗研究的重点方向。
