BN-PAGE在棕色脂肪线粒体呼吸链超级复合体分析中的应用
2023-01-15许时鸿王菡颖张智炜王玉刚刘转转徐州医科大学病原生物学与免疫学教研室江苏省免疫与代谢重点实验室徐州221004通讯作者mailliouzhuanzhuan12163com
许时鸿,王菡颖,张智炜,王玉刚,刘转转(徐州医科大学病原生物学与免疫学教研室,江苏省免疫与代谢重点实验室,徐州 221004;通讯作者,E-mail:liouzhuanzhuan12@163.com)
肥胖是世界范围内的重大公共卫生问题,威胁人类的健康[1]。全球约有21亿人受到肥胖影响,每年超过300万人死于肥胖或其相关疾病。肥胖以脂肪组织增生为特征,主要由于能量摄入与消耗之间的不平衡造成[2]。人体包含3种类型的脂肪细胞,即棕色脂肪细胞、米黄色脂肪细胞和白色脂肪细胞。棕色脂肪细胞由小脂滴组成,含有大量线粒体,通过消耗葡萄糖等营养物质提供热量。白色脂肪细胞由大脂滴组成,含线粒体较少,是贮能细胞。米黄色脂肪细胞是白色脂肪细胞棕色化的产物[2-4]。棕色脂肪细胞和米色脂肪细胞是小鼠适应性非颤抖产热反应的重要细胞,调节全身的能量代谢,是预防和治疗肥胖的重要靶标[2,5]。
线粒体通过氧化磷酸化(oxidative phosphorylation,OXPHOS)产生ATP,为细胞代谢活动提供动力,该过程需要呼吸链的蛋白质复合物参与。OXPHOS复合物包括复合物I(complex Ⅰ,CⅠ)、复合物Ⅱ(complex Ⅱ,CⅡ)、复合物Ⅲ(complex Ⅲ,CⅢ)、复合物Ⅳ(complex Ⅳ,CⅣ)、复合物Ⅴ(complex Ⅴ,CⅤ)。它们在线粒体内膜上可以独立定位,也可以相互作用形成超级复合体,例如超级复合体Ⅰ+Ⅲ2+Ⅳ、超级复合体Ⅲ2+Ⅳ等[6]。线粒体超级复合体(supercomplexes,SCs)具有提高呼吸链电子转移效率、减少电子或质子漏、提高线粒体复合体稳定性等功能[7,8]。SCs还可以减少活性氧(reactive oxygen species,ROS)的产生[9-11],ROS被认为是导致胰岛素抵抗的重要原因[12,13],糖尿病患者体内增多的ROS会影响SCs组装并影响线粒体功能[14,15]。此外,线粒体SCs减少可能会导致线粒体功能障碍,引起肥胖及其代谢综合征[16]。因此,建立脂肪组织线粒体SCs的分析方法,对于评估线粒体的功能具有一定价值。
线粒体SCs的传统研究是通过抗体对单个亚基的量化[17]。尽管线粒体SCs是高度保守的,在植物、动物和藻类等均有发现,但其具有动态性和可塑性,在不同生物、不同组织和不同疾病模型下,其组装不尽相同[18]。因此,Jha等[19]建立蓝色非变性聚丙烯酰胺凝胶电泳(blue native polyacrylamide gel electrophoresis,BN-PAGE),客观地反映了线粒体SCs在自然状态的分子量和组装情况。然而,该方法仍存在成本高昂、研究材料制备困难等弊端,本研究将进一步优化实验方案,并用来检测棕色脂肪线粒体SCs的表达和活性变化,为肥胖及其代谢性疾病的研究提供实验技术。
1 材料与方法
1.1 材料
实验所用小鼠为C57BL6/J小鼠,购自北京维通利华实验动物技术有限公司,并于本校动物屏障系统饲养,实验动物许可证号为SCXF(苏)2020-0011。所用试剂如下:Ⅰ型胶原酶、PVDF膜(Sigma公司,美国);考马斯亮蓝R-250、羟乙基呱嗪乙硫磺酸(N’-a-hydroxythylpiperazine-N’-ethanesulfanic acid,HEPES)(北京索莱宝科技有限公司,中国);BCA试剂盒(碧云天生物技术公司,中国);Ⅱ型胶原酶、5%洋地黄皂苷、4%~16%非变性聚丙烯酰胺凝胶、5%考马斯亮蓝G-250添加剂、电泳缓冲液、蛋白标准品、BN-PAGE阳极缓冲液、深蓝色和浅蓝色阴极缓冲液等(Thermo Fisher公司,美国);适用于BN-PAGE的线粒体氧化磷酸化混合抗体(Abcam公司,英国);辣根过氧化物酶标记的羊抗兔IgG抗体(武汉爱博泰克生物科技有限公司,中国);线粒体分离缓冲液、CI、CⅡ、CⅣ的底物液(见试剂配制,各组分均购于生工生物,中国);化学发光超敏显色试剂盒(翌圣生物科技股份有限公司,中国)。
1.2 方法
1.2.1 工作流程 本研究的操作流程如图1所示,收集小鼠的棕色脂肪组织,获取棕色脂肪细胞,然后分离线粒体并检测线粒体蛋白浓度。将线粒体用含有洋地黄皂苷的上样缓冲液充分溶解,加入考马斯亮蓝G-250,完成样品的制备。样品加入凝胶孔内,进行BN-PAGE或无色非变性聚丙烯酰胺凝胶电泳(clear native-PAGE,CN-PAGE)。BN-PAGE在室温下进行,然后经考马斯亮蓝染色或免疫印迹分析线粒体复合体的表达情况;CN-PAGE应在冰上进行,进一步分析线粒体复合体的活性。

图1 实验流程示意图Figure 1 Diagram of experimental procedure
1.2.2 棕色脂肪细胞获取 取6~8周龄小鼠,CO2麻醉后脱臼处死。小心分离肩胛部棕色脂肪组织,尽可能剥离表面结缔组织和白色脂肪组织。将棕色脂肪组织置于磷酸盐缓冲液(phosphate buffer saline,PBS)中清洗3次,转移至无菌1.5 ml离心管中剪碎。50 mg组织加入500 μl消化液(Ⅰ型胶原酶1 mg/ml、Ⅱ型胶原酶1 mg/ml、牛血清白蛋白20 g/L、HEPES 1.2 g/L),置于37 ℃水浴箱中消化1 h,每隔10 min摇晃一次。4 ℃,300g离心10 min。收集上层脂肪层,即为成熟的棕色脂肪细胞。沉淀部分含有血管基质组分,经过滤洗涤后,可用于原代棕色脂肪细胞的培养。
1.2.3 线粒体分离与纯化 收集上述脂肪细胞,用预冷的PBS洗涤并称取细胞湿重,取10~30 mg细胞沉淀,加入200 μl预冷的分离缓冲液(isolation buffer,IB)(6.846 g蔗糖,0.121 g Tris,1 ml 0.1 mol/L EGTA/Tris溶于80 ml水中,用1 mol/L HEPES将pH调节至7.4,定容至100 ml)。线粒体分离之前,添加1×蛋白酶抑制剂。对于肝脏组织,取30 mg组织置于2 ml离心管中,加入200 μl预冷的IB。经组织匀浆器匀浆,匀浆时间4 s,间歇6 s,持续6~8次,至肉眼无明显可见大块颗粒。匀浆后补加1.8 ml预冷的IB并混匀。将匀浆物于4 ℃,600g离心10 min,上清液含线粒体,沉淀为细胞碎片。收集上清液,4 ℃,7 000g离心10 min。弃去上清,沉淀重悬于2 ml预冷的IB中。经离心洗涤后,将线粒体重悬于0.25 ml预冷的IB中。使用BCA试剂盒检测线粒体蛋白质浓度,然后按50 μg每管分装,储存于-80 ℃。使用前于4 ℃,7 000g离心10 min,使用移液器小心弃去上清,沉淀用于BN-PAGE。
1.2.4 蓝色非变性聚丙烯酰胺凝胶电泳 每50 μg蛋白加入20 μl样品缓冲液(含5%洋地黄皂苷8 μl),轻轻吹打溶解沉淀,在冰上孵育20 min。4 ℃,20 000g离心10 min,取上清15 μl,加入2 μl考马斯亮蓝G-250样品添加剂后,置于冰上备用。将4%~16%非变性凝胶放入电泳槽中,用深蓝色阴极缓冲液洗涤凝胶孔,并检查内槽是否泄漏。每孔上样15 μl样品,内槽加入深蓝色阴极缓冲液,外槽加电泳液,150 V电泳30 min。将内槽更换为浅蓝色的阴极缓冲液,250 V电泳60 min。小心取下凝胶,用ddH2O洗涤后,在转膜液中轻轻摇动15 min。PVDF膜在甲醇中浸泡1 min,以激活PVDF膜。使用Bio-Rad小型垂直电泳装置在冰上进行转膜,首先电流130 mA转膜180 min,然后25 V转膜30 min。随后将PVDF膜放入8%的醋酸中,振摇5 min,以固定蛋白。用ddH2O洗涤2次,每次5 min,然后夹住膜的一侧风干。
用甲醇洗PVDF膜3次以去除考马斯亮蓝。然后经ddH2O清洗PVDF膜3次,每次5 min。PVDF膜放入20 ml封闭液(含5%脱脂奶粉)中,室温轻摇孵育1 h。用ddH2O清洗膜2次,每次5 min。PVDF膜与线粒体氧化磷酸化混合抗体孵育,4 ℃过夜。用洗涤缓冲液(Tris 1.21 g,氯化钠5.84 g,吐温-20 1 ml,定容至1 000 ml,调pH至7.5)洗涤2次,每次5 min。ddH2O洗涤2次,每次5 min。PVDF膜与辣根过氧化物酶标记的羊抗兔IgG抗体(1 ∶5 000)孵育,室温1 h。洗涤后,将PVDF膜放入化学发光液中,轻轻摇动使之充分反应,经Bio-Rad扫描仪扫描图像。使用ImageLab 5.2.1软件处理图像。
1.2.5 考马斯亮蓝染色 BN-PAGE后,可以用考马斯亮蓝染色显示线粒体复合物和SCs。将凝胶放入100 ml固定液(40%甲醇,10%醋酸)中,用高功率微波(950~1 100 W)加热45 s,室温轻摇孵育30 min,弃掉固定液,重复此步骤一次。加入100 ml考马斯亮蓝R-250染色液(0.02%考马斯亮蓝R-250,30%甲醇,10%醋酸),微波炉加热45 s,室温轻摇孵育30 min,弃掉染色液。加入100 ml脱色液(8%醋酸),微波炉加热45 s,室温轻摇脱色,直到条带清晰可见。使用凝胶扫描仪或其他装置进行拍照。
1.2.6 线粒体复合体的凝胶内活性测定 整个CN-PAGE过程应在冰上进行,电泳时使用两块凝胶,分别用于免疫印迹和凝胶内酶活性测定。按1.2.4所述的方法制备样品,置于冰上待用。使用浅蓝色阴极缓冲液洗涤凝胶孔并检查内槽是否泄漏。样品上样15 μl,内槽加入200 ml浅蓝色阴极缓冲液,外槽加600 ml电泳缓冲液。150 V电泳30 min。将内槽更换为电泳缓冲液,250 V电泳60 min。将凝胶放入预冷的ddH2O中。
将凝胶置于线粒体复合体对应的底物溶液中进行酶活性染色,约1 h后,弃染色底物溶液,加入10%醋酸终止反应。CⅣ+CⅠ活性可以在同一凝胶上进行,首先将凝胶放入CⅣ底物中孵育,出现适当的棕色或褐色信号后,用冰冷的ddH2O洗涤凝胶,然后在CⅠ底物中孵育。底物溶液配方如下:①CⅠ底物液:1 mol/L Tris·HCl(pH 7.4)40 μl,还原型辅酶Ⅰ 2 mg,氯化硝基四氮唑蓝(nitrotetrazolium blue chloride,NTB)50 mg,加ddH2O定容至20 ml;②CⅡ底物液:1 mol/L琥珀酸钠200 μl,NTB 25 mg,250 mmol/L吩嗪硫酸甲酯8 μl,1 mol/L Tris·HCl 50 μl,ddH2O 9.742 ml;③CⅣ底物液:ddH2O 10 ml,二氨基联苯胺(diaminobenzidine,DAB)50 mg,细胞色素C 100 mg,50 mmol/L磷酸盐缓冲液(pH 7.4)90 ml。
2 结果
2.1 小鼠棕色脂肪线粒体SCs和复合物的表达检测
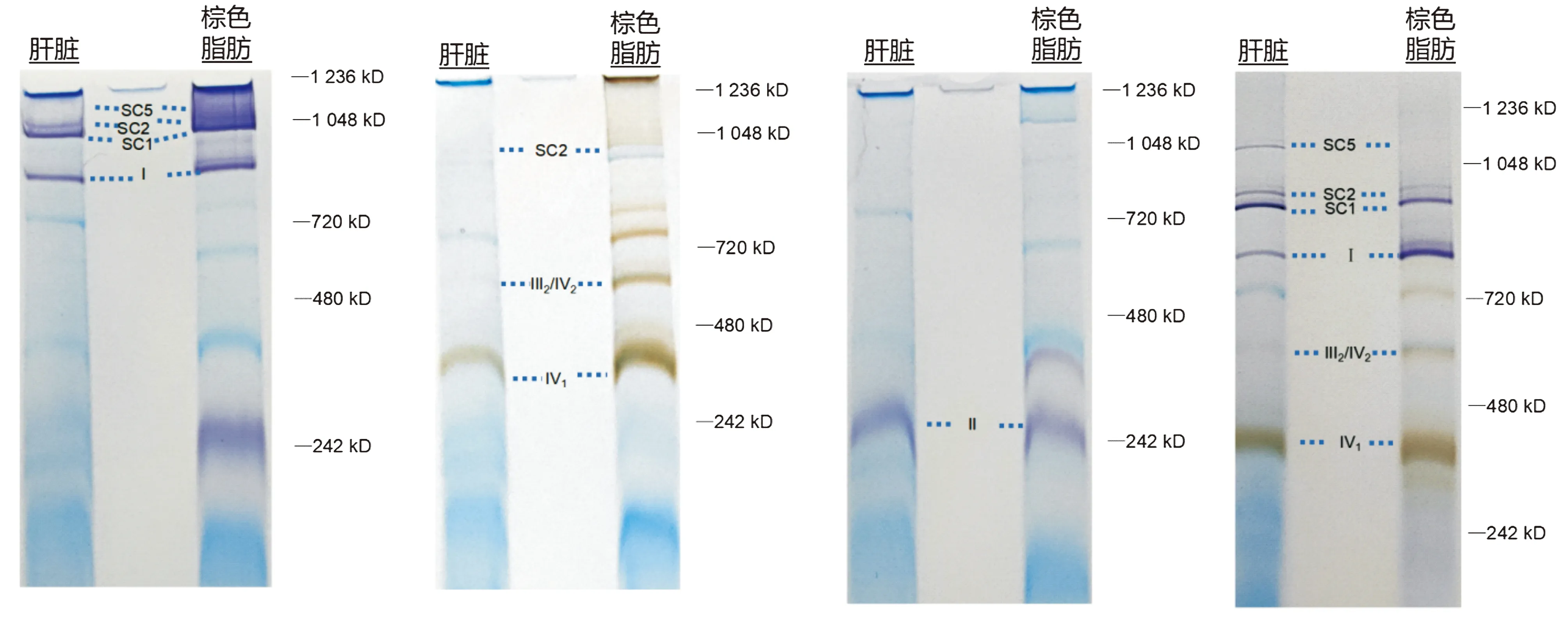
将小鼠棕色脂肪组织和肝脏组织的线粒体进行BN-PAGE,免疫印迹或考马斯亮蓝染色均清晰地呈现了小鼠线粒体SCs的表达(见图2)。由于在SCs形成过程中起主要作用的超复合体组装因子Ⅰ Cox7a2l的突变,C57BL/6小鼠不能形成含有多个复合体Ⅳ的SCs,即缺乏SC3(Ⅰ+Ⅲ2+Ⅳ2)、SC4(Ⅰ+Ⅲ2+Ⅳ3)和复合体Ⅲ2+Ⅳ1[17,18]。经考马斯亮蓝R250染色后,棕色脂肪的线粒体SCs(SC1:Ⅰ+Ⅲ2+Ⅱn,SC2:Ⅰ+Ⅲ2+Ⅳ1,SC5:Ⅰ2+Ⅲ2)均清晰可见,分子量在720~1 236 kDa之间;而其余的线粒体复合体则分布于242~1 048 kDa之间,与预期分子量相符。棕色脂肪Ⅲ2+Ⅳ2、Ⅳ1表达较高,而Vn表达较低(见图2A)。线粒体氧化磷酸化混合抗体,含有5种不同组分,即抗CⅠ-NDUFA9、CⅡ-70 kDa亚基(SDHA)、CⅢ-核心蛋白2(UQCRC2)、CⅣ-亚基Ⅳ(COX Ⅳ)和CⅤ-α亚基(ATP5A)的单克隆抗体,可检测到复合物Ⅰ、Ⅱ、Ⅲ、Ⅳ和ATP合成酶。免疫印迹结果显示棕色脂肪的SCs及单个复合体均可被检测出,其中Ⅲ2+Ⅳ2、Ⅳ1表达较高,而SC2、Vn表达较低(见图2B)。

A.考马斯亮蓝染色结果 B.免疫印迹检测结果图2 棕色脂肪线粒体复合物和肝脏线粒体各组分的表达Figure 2 Expression of mitochondrial complexes in brown adipose tissue and liver tissue
2.2 小鼠棕色脂肪线粒体复合体活性检测
线粒体通过定位于内膜上的5种蛋白复合体传递电子,完成氧化磷酸化,并生成ATP。我们用含有洋地黄皂苷的溶液溶解线粒体,采用CN-PAGE联合酶活性检测实验,分析了棕色脂肪线粒体呼吸链CⅠ、CⅡ和CⅣ活性。CⅠ活性检测反应以NTB为显色底物,有活性的CI及含CI的SCs呈紫色条带。与肝脏不同的是,棕色脂肪在接近CⅡ的位置(约242 kD)也显示有一条具有CⅠ酶活性的条带(见图3A)。CⅣ活性检测反应以细胞色素C为酶反应底物,DAB为显色底物,有酶活性的CⅣ及其超级复合体呈棕色。棕色脂肪CⅣ活性较肝脏高(见图3B)。CⅡ活性检测反应以琥珀酸钠为酶反应底物、NTB为显色底物,具有琥珀酸脱氢酶活性(主要是SDHA亚基活性)的位置呈紫色。与肝脏不同的是,棕色脂肪在Ⅳ1的下方也显示有一个具有CⅡ活性的条带(见图3C)。另外,CⅠ和CⅣ活性可以在同一块凝胶中检测(见图3D)。
A. CⅠ活性测定(紫色条带为含CⅠ的蛋白复合物和SCs的酶反应活性条带) B. CⅣ活性测定(棕色条带为含CⅣ的蛋白复合物和SCs的酶反应活性条带) C. CⅡ活性测定(紫色条带为含CⅡ的蛋白复合物和SCs的酶反应活性条带) D. CⅣ与CⅠ活性测定(棕色和紫色分别为含CⅣ和CI的蛋白复合物和SCs的酶活性)图中所有蓝色条带均为考马斯亮蓝染色的蛋白条带;SC1:Ⅰ+Ⅲ2+Ⅱn;SC2:Ⅰ+Ⅲ2+Ⅳ1; SC5:Ⅰ2+Ⅲ2图3 棕色脂肪线粒体复合物酶活性检测Figure 3 Enzyme activity in mitochondrial complex of brown adipocytes
3 讨论
棕色脂肪的线粒体功能影响着肥胖与代谢性疾病的发生和发展。传统研究线粒体的方法只能研究单一复合体的活性和表达,不能用于线粒体SCs的研究,而且多采用比色法检测线粒体复合体活性,其结果不够直观。BN-PAGE操作简单,使蛋白质复合体在近似天然的状态下分离,且不受样本来源限制,同时分离可溶性、难溶性膜蛋白质复合体。本研究成功构建了棕色脂肪线粒体SCs的分析方法,研究了小鼠棕色脂肪细胞线粒体SCs的组成状况并进行了凝胶内酶活性分析。
本研究选用C57BL/6J小鼠作为棕色脂肪组织来源,采用Ⅰ型和Ⅱ型胶原酶混合消化,上层为棕色脂肪细胞。棕色脂肪细胞含脂滴,不易吸取,可用注射器吸去脂肪层下的液体和沉淀,进一步洗涤获得棕色脂肪细胞。不建议用年老小鼠分离棕色脂肪细胞或培养原代棕色脂肪细胞,因为小鼠脂肪前体细胞向棕色脂肪细胞分化的能力随着年龄的增加而逐渐减退,棕色脂肪的产热活性也逐渐降低[21,22]。另外,在提取线粒体时,先加少量的IB进行匀浆,待匀浆结束后再补足IB,可使匀浆更充分且减少样本的损耗。测定线粒体蛋白浓度前,沉淀需用适量的IB重悬,需根据沉淀量而调整,以免蛋白浓度过低。分装好的线粒体可储存在-80 ℃数年。
BN-PAGE可根据蛋白质复合物的分子大小分离完整的多亚单位复合物。电泳之前,在蛋白质样品中加入考马斯亮蓝G-250使蛋白质带负电荷,同时不会破坏蛋白质复合体天然结构。这项技术由Schägger建立,最初是为了研究哺乳动物和细菌线粒体中的蛋白质复合体[23]。BN-PAGE使用范围广、高效可靠、且不需要昂贵的仪器设备。在考马斯亮蓝染色和脱色过程中,要注意处理时间,避免染色时间或脱色时间过短致使条带不清晰。采用免疫印迹检测时,注意控制转膜的电流和温度。此外,棕色脂肪组织和棕色脂肪细胞所得的条带不如肝脏清晰,即使加大样本量至100 μg,仍不能得到类似肝脏的SCs条带,这可能与棕色脂肪的SCs形成较少有关。
BN-PAGE分析所需的样品量很小,该方法指示酶活性的改变可用于线粒体酶活性的鉴定和定量[24]。BN-PAGE和线粒体复合物的凝胶内活性是测定SCs化学计量的一种有效、简便的方法。与传统的蛋白质免疫印迹相比,BN-PAGE允许在自然条件下分离蛋白质,并保留了蛋白质与蛋白质之间的相互作用,这对研究SCs具有重要意义[19]。基于比色法的试剂盒只能对某一特定线粒体复合体的活性进行定量分析,结果也不够直观;而BN-PAGE可以同时对多个线粒体SCs的表达和单个线粒体复合物的活性进行定性和定量分析。此外,由于棕色脂肪中脂质较多,在分析过程中很难完全去除这些脂质,而这些脂质会严重影响样品OD值,使比色法试剂盒检测的结果不准确,BN-PAGE则几乎不受其影响。
在分析线粒体复合物的表达情况时,利用实验室常用电泳系统进行线粒体各组分的分离,然后进行转膜、封闭、抗体孵育,以及ECL显影。本研究优化的实验方法大大简化了实验操作流程;对于操作者而言,技术门槛较低;对于实验室而言,可以节约有限的实验经费,为研究棕色脂肪细胞功能特性提供了有利的实验手段。
