线粒体活性氧在机械通气导致的膈肌功能障碍中作用的研究进展
2023-01-15张菊梅关发升李学欣西南医科大学附属医院麻醉科泸州646000通讯作者mailniuniudoctorhotmailcom
张菊梅,涂 锐,关发升,李学欣,刘 力(西南医科大学附属医院麻醉科,泸州 646000;通讯作者,E-mail:niuniudoctor@hotmail.com)
机械通气(mechanical ventilation)是一种挽救生命的干预措施,全球每年有超过1 500万患者在外科手术和危重疾病中使用机械通气来提供充足的肺通气[1]。然而,机械通气是一把双刃剑,长期的机械通气会导致膈肌纤维萎缩和收缩力下降从而引起明显的膈肌功能障碍,称为呼吸机诱导的膈肌功能障碍(ventilator-induced diaphragm dysfunction,VIDD)。VIDD不仅对患者生存率和预后有显著不良影响,也是临床上导致脱机困难的主要原因,会产生较大的医疗负担。超过50%的机械通气患者在气管插管24 h之内迅速出现VIDD,其发生率与通气时间的延长、撤机困难、再插管率存在明显相关性[2]。目前,临床尚缺乏预防和治疗VIDD的相应措施,因此对VIDD发生机制的详细了解对防治机械通气诱发的膈肌功能障碍至关重要。虽然导致VIDD发生的机制有多种,但已经确定VIDD的发生发展与线粒体活性氧(reactive oxygen species, ROS)的释放密切相关,ROS是VIDD发病机制的关键上游激活因子,膈肌中活性氧水平的升高进而引起氧化应激损伤是造成膈肌功能障碍的先决条件[3]。长时间的机械通气会导致线粒体ROS释放的显著增加,线粒体是ROS产生的主要来源,而ROS的产生增加与膈肌氧化应激、蛋白水解、自噬与凋亡、线粒体功能障碍等都有紧密联系[4]。本文综述了线粒体ROS在呼吸机诱导的膈肌功能障碍中作用的进展,主要包括ROS与氧化应激、ROS与蛋白水解系统(即泛素-蛋白酶体、自噬、半胱天冬酶-3和钙蛋白酶)之间的相互关系、ROS对胞质磷脂酶A2的激活、活性氧与线粒体功能障碍之间的恶性循环等,希望能为VIDD的治疗和预防提供新的帮助。
1 机械通气时线粒体ROS的产生与氧化应激
1.1 线粒体活性氧
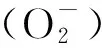
1.2 机械通气中膈肌的氧化应激反应
正常生理情况下体内氧自由基的产生与清除是平衡的,一旦氧自由基产生过量或抗氧化系统出现障碍,体内氧自由基代谢就会紊乱失衡或者称为氧化应激。Hyatt等[10]测量了大鼠在机械通气12 h膈肌过氧化氢和氧化损伤标志物4-羟基壬烯醛(4-hydroxynonenal,4-HNE)表达量明显高于对照组,同时膈肌肌纤维的横截面积和肌力低于对照组。膈肌线粒体活性氧的释放明显增加,超过了抗氧化体系的处理范围,造成氧自由基代谢失衡。多聚不饱和脂肪酸是生物膜磷脂的主要成分,氧自由基对其中多个弱键和不饱和键有非常高的亲和力,尤其能使生物膜的多不饱和脂肪酸发生脂质过氧化。细胞膜脂质过氧化,一方面自由基与膜上的酶和(或)受体共价结合,改变膜成分的活性及其结构,另一方面膜上巯基被氧化,造成膜运动过程紊乱,导致膜流动性下降,膜脆性增加,细胞内外离子交换障碍,出现细胞膜变性、通透性和流动性改变,影响细胞膜的结构和功能[11]。Whidden等[12]用抗氧化剂Trolox治疗大鼠可以防止机械通气导致的膈肌蛋白氧化和脂质过氧化。Powers等[4]研究了在使用了线粒体靶向抗氧化剂时,大鼠机械通气12 h的ROS明显降低,同时氧化损伤标志物也相应的降低,因此,他们认为机械通气导致的线粒体活性氧增加会激活氧化应激系统,导致膈肌组织氧化损伤标志物增加,进而导致膈肌受损而引起膈肌功能障碍。
2 机械通气时线粒体ROS激活膈肌蛋白水解系统
2.1 蛋白水解系统
研究表明,蛋白水解系统,即泛素-蛋白酶体、自噬、半胱天冬酶-3和钙蛋白酶,在机械通气延长期间都在膈肌中被激活[8,13]。已经确定机械通气时膈肌萎缩是由蛋白水解的加速和蛋白合成减少引起,其中蛋白水解增加起主要作用[14]。胞浆蛋白和肌原纤维蛋白的降解都是一个多步骤的过程,需要多种蛋白水解成分的共同作用,包括半胱天冬酶-3、钙蛋白酶、泛素-蛋白酶体和自噬/溶酶体蛋白水解系统[15]。机械通气诱导的活性氧释放增加是激活蛋白水解系统的关键事件(见图1),也导致肌原纤维蛋白降解敏感性增加,使其被氧化修饰从而更易被蛋白水解系统降解。
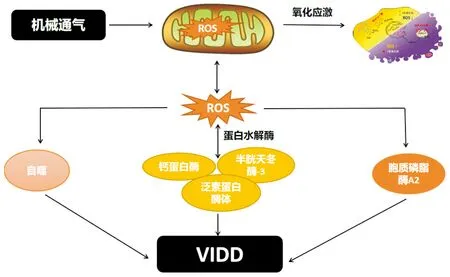
图1 ROS在呼吸机诱导的膈肌功能障碍中的作用
2.2 机械通气时线粒体ROS与钙蛋白酶和半胱天冬酶-3
蛋白水解系统近年来在VIDD被广泛研究,研究发现在机械通气中膈肌萎缩的发生与膈肌蛋白的水解是密不可分的,而线粒体活性氧的产生是机械通气后膈肌蛋白水解系统激活的关键上游调节因子[12]。膈肌本身是非常活跃的肌肉,当机械通气时,膈肌处于废用状态,蛋白水解系统被激活,促进膈肌萎缩和肌无力的发生。
钙蛋白酶是一种半胱氨酸蛋白酶,在许多病理条件下(例如,长时间废弃和败血症等)被激活,钙蛋白酶长期以来一直被称为是能够降解肌肉细胞骨架蛋白的钙依赖蛋白酶。与钙蛋白酶类似,半胱天冬酶-3也是一种半胱氨酸蛋白酶,可通过多种信号通路在细胞内被激活[16]。两者都在机械通气的膈肌中被上调,钙蛋白酶和半胱天冬酶系统在蛋白水解上表现出大量协同作用。研究发现,依赖ATP的泛素蛋白酶体途径参与了机械通气期间膈肌肌原纤维蛋白的降解过程[12,17]。虽然泛素蛋白酶体途径可以降解许多细胞蛋白,但这个蛋白水解系统不能降解完整的肌动-球蛋白复合物[18]。由此可见,肌动-球蛋白复合物必须从肌节中解离释放出来,才能被蛋白酶体系统降解。有证据表明,钙蛋白酶和半胱天冬酶-3能够让肌动-球蛋白解离,钙蛋白酶能够降解大量促进肌丝释放的肌肉蛋白,利于后续肌原纤维的降解[19]。尽管机械通气期间膈肌中有几种蛋白水解系统被激活,但钙蛋白酶和半胱天冬酶-3的激活对机械通气诱导的膈肌萎缩至关重要。Whidden等[12]发现使用抗氧化剂Trolox减弱机械通气诱导的氧化应激,同时也阻止了机械通气期间膈肌中钙蛋白酶和半胱天冬酶-3的激活。此外,避免机械通气诱导的氧化应激不仅减少了这些蛋白酶的激活,而且挽救了机械通气诱导的膈肌肌纤维萎缩和收缩功能障碍。Powers等[7]在大鼠机械通气12 h前通过使用线粒体靶向抗氧化剂可以降低钙蛋白酶和半胱天冬酶-3的活性,而没有使用线粒体靶向抗氧化剂时,钙蛋白酶和半胱天冬酶-3的活性显著高于使用了线粒体靶向抗氧化剂组。使用线粒体靶向抗氧化剂减少机械通气诱导的线粒体ROS释放可以部分减少膈肌纤维中钙蛋白酶和半胱天冬酶-3的激活,所以活性氧是机械通气时激活膈肌中钙蛋白酶和半胱天冬酶-3所需的上游信号分子。活性氧激活蛋白酶的机制可能是活性氧作为一种氧化剂增加胞质钙水平,触发信号通路,激活钙蛋白酶。
相对而言,蛋白水解系统激活也可以导致在长时间机械通气中线粒体功能障碍和活性氧释放增加。研究表明,在大鼠机械通气的模型中抑制了钙蛋白酶的活性,阻止了线粒体活性氧的释放增加,改善了膈肌功能障碍[10]。在机械通气过程中,线粒体活性氧释放增加可以激活蛋白水解酶,而蛋白水解酶激活后同样可以在长时间的机械通气中促进活性氧的产生增加。蛋白水解酶和活性氧可能存在相互促进的关系,共同导致VIDD的发生。
2.3 机械通气时线粒体ROS激活自噬
自噬是一个正常的生理分解代谢过程,主要包括胞质蛋白和细胞器的溶酶体降解过程。一般来说,自噬在肌肉组织中以低水平持续发生,涉及溶酶体降解胞质蛋白和细胞器,对于维持功能失调的细胞溶质的分解很重要[20]。在机械通气延长期间,啮齿动物和人类的膈肌也会激活自噬,表现为自噬蛋白的表达增多和自噬小体的形成[21]。在VIDD中,自噬是一把双刃剑。理论上,根据不同的条件,加速的自噬可以对骨骼肌产生保护或有害作用。具体来说,正常肌肉功能需要基础水平的自噬,特定自噬基因的缺失会导致显著的功能缺陷。然而,在病理条件下,自噬可以大大增加,以促进有害的蛋白质去除速率。机械通气诱导的自噬增加,一方面可以去除受损的细胞器,对机体产生保护作用;另一方面可以通过消除肌肉纤维中正常的结构和胞质蛋白来促进膈肌萎缩[22]。机械通气延长激活了膈肌中的自噬,但自噬在机械通气中的作用在不同研究中有不同的解释,可能原因是动物模型、通气时间和干预方式不同[2,8,23]。研究表明,机械通气期间膈肌中线粒体ROS的产生是关键的自噬基因(即LC3、Atg7、Atg12、Beclin1和p62)表达增加所必需的[24]。目前的研究证明,机械通气诱导的线粒体ROS产生是膈肌自噬蛋白表达增加的必要条件[25]。Smuder等[8]发现,在对机械通气的大鼠提前使用线粒体靶向抗氧化肽SS-31既阻止了机械通气诱导的自噬特异性生物标志物的表达,也阻止了膈肌中自噬小体形成的增加。Smuder等[8]已经预测自噬上调通过消除过氧化物酶体,而导致细胞ROS的增加。相反,自噬抑制减少了机械通气诱导的横膈膜ROS的产生,并阻止了由此导致氧化应激刺激自噬的增加,防止了ROS和自噬的进一步增加,阻止了这个正反馈回路。这些结果表明,在机械通气中,氧化应激和自噬之间存在一种调节交叉作用,通过氧化应激刺激自噬的增加,自噬的增加又导致ROS的产生增多。
2.4 机械通气时线粒体ROS与泛素-蛋白酶体途径
泛素-蛋白酶体途径(ubiquitin-proteasome pathway, UPP)参与调控机体多数生命过程包括生长、发育、基因转录、细胞分化凋亡等活动。泛素-蛋白酶体途径是通过调控蛋白质水平来参与上述生命活动[26]。泛素-蛋白酶体途径在体内是一种十分高效的蛋白分解途径,在很多细胞代谢中起调节作用。研究发现,泛素-蛋白酶体途径参与了机械通气期间肌原纤维蛋白的降解[27]。研究者在机械通气时测量了20S蛋白酶体的活性以及膈肌中两种重要肌肉特异性E3连接酶(Atrogin-1/MAFbx和MuRF-1)的mRNA和蛋白水平。结果表明,通过线粒体靶向抗氧化剂阻止机械通气诱导的线粒体ROS释放,可以阻止机械通气诱导的膈肌20S蛋白酶体活性的增加。此外,数据表明,机械通气延长导致两组膈肌Atrogin-1/MAFbx和MuRF-1 mRNA水平显著升高,目前它们被广泛作为膈肌纤维萎缩的标志物。然而,线粒体靶向抗氧化剂处理的大鼠明显钝化了机械通气诱导的横膈膜Atrogin-1/MAFbx和MuRF-1mRNA水平的升高[21,28]。Smuder等[29]发现泛素-蛋白酶体途径在12 h的机械通气组是活跃的,用蛋白酶体抑制剂处理机械通气的大鼠可以部分减弱机械通气诱导的膈肌收缩力下降,但不能防止机械通气诱导的膈肌纤维萎缩,蛋白酶体抑制剂对机械通气诱导的膈肌收缩功能障碍有部分保护作用,但泛素-蛋白酶体途径激活不是机械通气12 h内VIDD的主要贡献者[29]。研究表明氧化应激促进泛素-蛋白酶体途径功能所需蛋白的表达增加,特别是肌管暴露于过氧化氢足以增加特异性泛素连接酶的表达[27]。因此,活性氧的增加可以通过UPP促进肌肉蛋白质的降解,最后引起膈肌萎缩和功能障碍。研究发现在膈肌中过表达线粒体超氧化物歧化酶2(SOD2)可部分减弱机械通气诱导的E3泛素连接酶MuRF1和Atroin-1 mRNA表达增加[30]。4-HNE在脂质过氧化级联过程中形成,4-HNE修饰的蛋白加合物的测量是肌肉氧化损伤的一个极好的生物标志物,机械通气导致4-HNE修饰的蛋白在大鼠膈肌中的积累显著增加,然而,用泛素-蛋白酶体抑制剂治疗动物未能减少机械通气诱导的膈肌氧化损伤标志物的增加,也没有减少ROS的生成[29]。因此,线粒体活性氧的产生可能会促进泛素-蛋白酶体途径的激活,相反,泛素-蛋白酶体途径对活性氧产生并没有影响。
3 线粒体ROS与胞质磷脂酶A2
胞质磷脂酶A2(cPLA2)介导脂质介体的产生,在炎症和组织损伤、膜通道的活化、信息传递、血流动力学以及调节细胞内外代谢中起了重要作用,因此它被认为参与了很多器官系统的稳态调节过程和疾病的发生机制。据报道,胞质磷脂酶A2对感染诱导的线粒体ROS产生和膈肌功能障碍至关重要[31]。Zhou等[32]发现机械通气12 h诱导了大鼠膈肌cPLA2的激活以及过度线粒体活性氧生成和肌肉无力的发生。膈肌线粒体ROS的形成可能严重依赖于cPLA2的激活,可能是因为cPLA2可破坏线粒体膜上的磷脂,造成线粒体功能障碍,产生过量的活性氧。研究发现用特异性抑制剂抑制cPLA2活性可以导致线粒体活性氧水平降低和膈肌力量改善[32,33]。此外,使用线粒体靶向抗氧化剂在机械通气大鼠体内减弱了呼吸机诱导的线粒体氧化应激并下调了cPLA2活性,抑制cPLA2活化可以减弱呼吸机诱导的蛋白质降解、肌肉萎缩。总的来说,长时间机械通气后膈肌中线粒体活性氧的产生部分依赖于cPLA2的激活,另一方面,线粒体氧化应激也促进膈肌cPLA2激活。因此,cPLA2和线粒体活性氧之间的正反馈回路可能加速了VIDD的发展[32]。
4 线粒体ROS与线粒体功能障碍
在长时间机械通气中,线粒体活性氧的产生增加,活性氧与线粒体膜发生过氧化反应,会使线粒体膜的结构完整性受到破坏。ROS攻击线粒体膜导致线粒体膜通透性的增加,造成线粒体Ca2+内流增多,线粒体Ca2+急剧的升高一方面加速了黄嘌呤脱氢酶和黄嘌呤氧化酶的转化,增加了ROS的生成,另一方面磷脂酶A2和磷脂酶C被激活使线粒体膜磷脂大量降解,导致线粒体膜内花生四烯酸含量成倍增加,降低电子传递链的活性,呼吸链的损伤使线粒体合成ATP的功能发生障碍,氧化磷酸化功能受损,这样又导致Ca2+内流、氧自由基生成,形成一个“恶性循环”,结果造成膜运动过程紊乱,导致膜流动性下降、膜脆性增加、细胞内外离子交换障碍,出现细胞膜变性、线粒体肿胀、空泡化、嵴断裂,通透性和流动性改变,造成线粒体呼吸功能障碍、能量代谢衰竭,膈肌无力的发生[34]。氧化应激在VIDD发病机制中发挥着重要作用,线粒体源性ROS尤其有可能直接损伤线粒体成分,包括mtDNA,而且线粒体生物发生通常伴随着抗氧化机制的上调。Leduc-Gaudet等[35]通过测量羰基化蛋白来评估氧化应激水平,比较了小鼠机械通气6 h和使用线粒体靶向抗氧化剂后再机械通气6 h的氧化应激水平和线粒体功能状况,数据表明线粒体功能障碍是氧化应激和膈肌收缩力受损之间的联系。可能是因为线粒体功能障碍导致活性氧的产生增加和氧化应激增加,ATP生成障碍导致收缩力下降。Morton等[36]通过在膈肌中过表达线粒体抗氧化酶超氧化物歧化酶2(SOD2),研究是否对机械通气诱导的线粒体功能障碍具有保护作用,他们测量了状态3和状态4下的线粒体呼吸。在过表达SOD2的机械通气大鼠中,线粒体呼吸功能得到部分保护,线粒体氧化磷酸化功能得到改善[36]。线粒体功能障碍和活性氧释放增加是VIDD的标志,也是VIDD的一个成因。
5 小结与展望
线粒体活性氧对机械通气诱导的膈肌萎缩和收缩功能障碍是必需的,线粒体活性氧在VIDD的发生发展的许多环节都扮演了重要的角色,且各个环节之间相互联系,共同导致了VIDD的发生。活性氧作为一个关键的激活因子,参与了VIDD的蛋白水解、氧化应激、线粒体功能障碍等多个环节。目前,VIDD临床尚无特异治疗方法,本文总结了活性氧在VIDD中发挥的作用,为临床上线粒体靶向抗氧化剂预防和治疗VIDD提供了可能。机械通气是通过何种机制引起活性氧释放增加,以及活性氧激活蛋白水解系统的具体分子机制还需要在未来深入研究。由于人类伦理的限定,VIDD机制的研究大多是在动物模型上,但随着无创膈肌超声的发展,膈肌功能测定有了更简便无创的办法,使更多关于VIDD的临床研究成为了可能。
