昼夜紊乱对正常及2型糖尿病小鼠体质量、血糖和肝脏生物节律基因表达的影响
2023-01-15刘梦迪刘继文卢婉贤新疆医科大学公共卫生学院劳动卫生与环境卫生学教研室乌鲁木齐830054新疆医科大学第一附属医院临床医学研究院通讯作者mail47433qqcom
刘梦迪,刘继文,王 黎,,卢婉贤(新疆医科大学公共卫生学院劳动卫生与环境卫生学教研室,乌鲁木齐 830054;新疆医科大学第一附属医院临床医学研究院;通讯作者,E-mail:47433@qq.com)
T2DM是以胰岛素抵抗伴随胰岛素进行性分泌不足、持续性高血糖、高胰岛素血症为特征的慢性进展性代谢性疾病,临床典型症状为多尿、多饮、消瘦或体质量减轻。全球糖尿病患者约5.3亿,我国糖尿病患者居全球首位约1.41亿[1,2]。糖尿病医疗费用可占多达20%的国家卫生保健预算,将造成严重的经济问题和社会负担。并且随着人口的老龄化和社会的发展,糖尿病的患病率正急速上升。
倒班作为一种与T2DM相关的环境危险因素变得越来越普遍,据统计,倒班工作者估计占整个劳动人口的20%[3],且全球倒班工作者人数呈上升趋势。倒班工作可增加糖耐量异常的风险,有研究表明倒班的时间和倒班的方式均可增加石油工人罹患T2DM的风险[4]。节律性睡眠障碍患者的睡眠不足可导致其糖耐量降低和高血糖。一项15年队列研究表明,从事倒班工作的护士患糖尿病的风险可大大增加[5]。倒班工作人群作息时间不规律,可引起内源性昼夜节律紊乱[6]。作为维持胰岛素敏感性和葡萄糖稳态的关键器官,肝脏是昼夜节律维持糖代谢的重要器官,有其自身的震荡规律,能响应视交叉上核(suprachiasmatic nucleus,SCN)的调节,与其他外周器官共同维持稳定的昼夜节律。人白蛋白启动子D位点结合蛋白(D-box binding protein,DBP)在肝脏昼夜节律的表达和调控葡萄糖代谢中起重要作用,参与多种时钟输出的调节,包括运动活动、睡眠分布和肝脏基因表达[7]。隐花色素基因1(cryptochrome1,CRY1)基因可以通过编码糖皮质激素受体和调节胰高血糖素的腺苷酸环化酶信号传导,进而调节糖代谢[8,9]。钟控基因昼夜节律蛋白2(period circadian protein2,PER2)和Cry1是一对负调控的生物钟基因,在维持昼夜节律中不可缺少。研究表明Dbp可通过D反应元件(D-box)调节包括Per2在内的基因的表达[10]。但昼夜紊乱如何影响T2DM小鼠肝脏Dbp、Per2、Cry1等生物钟基因表达水平未见报道。本研究以正常C57BL/6J和T2DM小鼠为研究对象,初步揭示昼夜紊乱对正常及T2DM小鼠体质量、血糖以及对肝脏生物节律相关基因Dbp、Cry1、Per2表达的影响。
1 材料与方法
1.1 实验动物
50只8周龄雄性C57BL/6J小鼠,体质量(21±2)g,购于新疆医科大学实验动物中心(SCXK(新)2018-0003)。饲养于新疆医科大学实验动物中心SPF级环境。恒温(24±2)℃、恒湿(40%~70%)、光暗循环(12 h亮/12 h暗),自由饮食与饮水。本实验方案由新疆医科大学第一附属医院伦理委员会审核批准(K202101-19)。
1.2 造模及分组
1.2.1 分组 将50只雄性C57BL/6J小鼠随机分为4组:正常对照组(control组)、2型糖尿病+昼夜正常组(T2DM)组、正常+昼夜节律紊乱组(shift组)、2型糖尿病+昼夜节律紊乱组(T2DM+shift组),每组各取12只。
1.2.2 构建T2DM小鼠模型 实验小鼠使用高脂饲料(45%脂肪,MD12032,江苏美迪森生物医药有限公司)喂养4周,禁食不禁水12 h后腹腔内注射低剂量STZ(S0130,Sigma,美国)诱导T2DM,注射1周后开始监测小鼠空腹血糖,当空腹血糖水平>11.1 mmol/L(200 mg/dl)被认定为2型糖尿病造模成功,并被选作进一步研究。剔除死亡和血糖下降的小鼠后,随机将其分为T2DM组和T2DM+shift组,继续喂养高脂饲料。对照组的小鼠则喂养普通饲料(MD17121,江苏美迪森生物医药有限公司),腹腔内注射相同剂量的柠檬酸-柠檬酸钠缓冲液后,随机将其分为control组和shift组。
1.2.3 构建昼夜节律紊乱小鼠模型 T2DM+shift组和shift组小鼠连续暴露于重复光相移4~6周,在每周前3 d保持光周期提前8 h状态,在后4 d恢复正常的光照周期[11,12]。T2DM组和control组采用正常光照周期。
1.3 指标检测
1.3.1 小鼠体质量及血糖测量 在4个时间点收集小鼠体质量和血糖值数据:基线、第2周、第3周、第4周。第4周与基线体质量的差值即为该小鼠的体质量增加量。取小鼠肝脏组织至-80 ℃冰箱保存,待后续研究,最后对小鼠实行安乐死。
1.3.2 葡萄糖耐量实验(oral glucose tolerance test, OGTT) 四组小鼠禁食但不禁水12 h,按照2 g/kg葡萄糖溶液剂量进行腹腔注射,在注射后0,30,60,90,120 min通过剪尾采集血样,使用血糖试纸和手持式血糖仪(140104,三诺生物传感有限公司)测定小鼠血糖值,绘制相应曲线图并按公式计算曲线下面积(area under curve, AUC)。
1.3.3 胰岛素耐量实验(insulin tolerance test, ITT) 四组小鼠禁食但不禁水6 h,按照0.5 IU/kg的胰岛素溶液剂量进行腹腔注射,在注射后0,30 min通过剪尾采集血样,使用血糖试纸和手持式血糖仪测定小鼠血糖,绘制相应曲线图并按公式计算AUC。
1.4 qRT-PCR检测Dbp、Cry1、Per2的表达


表1 qRT-PCR检测Dbp、Cry1、Per2表达的引物序列Table 1 Primer sequences of Dbp, Cry1, Per2 for qRT PCR
1.5 统计学处理
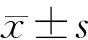
2 结果
2.1 小鼠体质量及血糖的变化
各组小鼠第4周与第1周体质量增加量不同(F=49.81,P<0.001)。与control组相比,T2DM组、shift组和T2DM+shift组小鼠体质量增加量较少,差异有统计学意义(P<0.05);与T2DM组相比,T2DM+shift组小鼠体质量增加量较多,差异有统计学意义(P<0.05,见表2)。
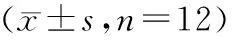
表2 四组小鼠4周体质量增加量比较Table 2 Comparison of weight gain of mice in 4 weeks between
2.2 小鼠造模成功后昼夜节律紊乱干预4周血糖值变化比较
血糖值数据符合球对称性,Mauchly检验P>0.05,重复测量方差分析结果显示各组血糖值之间存在差异(F=699.59,P<0.05);组内4个时间点血糖值差异无统计学意义(F=1.34,P>0.05);血糖值和时间无交互作用(F=1.39,P>0.05)。T2DM组和T2DM+shift组在第1~4周的血糖均高于control组(P<0.05)。与control组相比,shift组在第1和2周的血糖有升高趋势,但差异无统计学意义(P>0.05),在第3和4周的血糖较高,差异有统计学意义(P<0.05)。与T2DM组相比,T2DM+shift组第1~4周血糖值均较低,差异有统计学意义(P<0.05,见表3)。
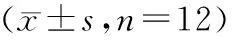
表3 四组小鼠血糖变化值比较Table 3 Comparison of blood glucose changes in four
2.3 各组小鼠OGTT和ITT实验结果
各组小鼠第4周分别进行OGTT和ITT实验。各组小鼠OGTT和ITT实验AUC不同,差异有统计学意义(P<0.05)。与control相比,T2DM组OGTT和ITT实验血糖AUC升高(P<0.05),shift组OGTT和ITT实验血糖AUC差异无统计学意义(P>0.05);与T2DM组相比,T2DM+shift组OGTT和ITT实验血糖AUC升高,差异有统计学意义(P<0.05,见表4)。
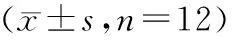
表4 四组小鼠OGTT试验和ITT试验血糖曲线下面积比较Table 4 Comparison of area under blood glucose curve in OGTT test and ITT test between four groups
2.4 肝脏生物节律相关基因Cry1、Per2以及Dbp表达
各组小鼠Cry1(F=1.26,P>0.05)、Per2(F=16.99,P<0.05)、Dbp(F=3.58,P<0.05)的PCR实验结果不同,其中Per2、Dbp各组基因表达差异有统计学意义。与control组相比,T2DM组和shift组Cry1基因表达差异无统计学意义(P>0.05);与T2DM组相比,T2DM+shift组Cry1基因表达差异无统计学意义(P>0.05)。与control组相比,T2DM组和shift组Per2基因表达差异无统计学意义(P>0.05);与T2DM组相比,T2DM+shift组Per2基因表达上调(P<0.05)。与control组相比,T2DM组Dbp基因表达差异无统计学意义(P>0.05),shift组Dbp基因表达上调(P<0.05);与T2DM组相比,T2DM+shift组Dbp基因表达差异无统计学意义(P>0.05,见图1)。
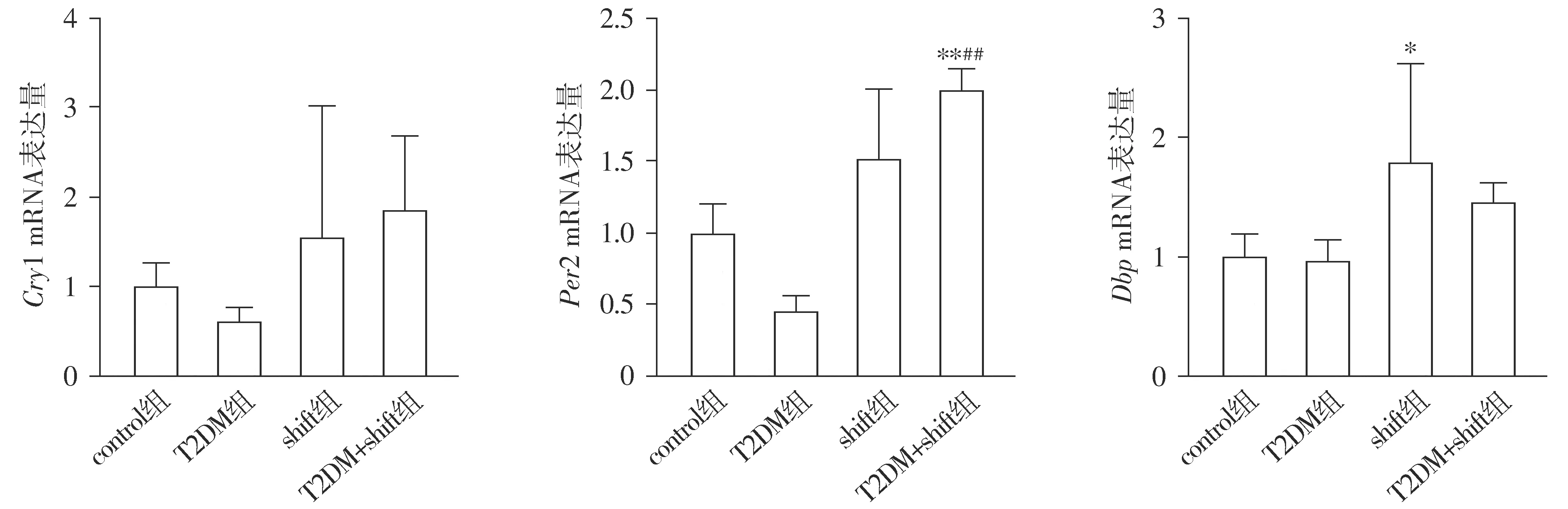
与control组比较,*P<0.05,**P<0.01;与T2DM组比较,##P<0.01图1 qRT-PCR检测四组小鼠Cry1、Per2、Dbp mRNA表达量结果Figure 1 The mRNA expression of Cry1, Per2, Dbp in four groups by qRT PCR
3 讨论
随着人口的老龄化和社会的发展,糖尿病的患病率正急速上升。倒班作为一种与T2DM相关的环境危险因素变得越来越普遍,时钟基因通过其周期性表达诱导昼夜节律并调节多种生理功能。由分子生物钟系统形成的核心环路和辅助环路来调节哺乳动物的昼夜节律[13,14]。光照是重要的授时因素,昼夜改变可以降低人类胰岛素敏感性和葡萄糖代谢,使肥胖和糖尿病风险增加[15]。本研究以正常C57BL/6J和T2DM小鼠为研究对象,初步揭示昼夜紊乱对正常及T2DM小鼠体质量、血糖以及肝脏生物节律相关基因Dbp、Cry1、Per2表达的影响。本研究以期为进一步研究昼夜节律紊乱影响葡萄糖稳态及T2DM的分子机制提供依据,为倒班工作人群糖代谢异常和T2DM提供潜在的防控措施。
本研究发现T2DM组、shift组和T2DM+shift组小鼠体质量增加量均较control组小鼠少。T2DM组小鼠可能因为体内胰岛素的减少[16],故而不能有效利用食物中糖类产生的能量,从而加快蛋白质和脂肪的分解利用,最终降低体质量。研究表明[17]小鼠昼夜节律紊乱能促进体质量增加和肝脂质蓄积。与之前研究[17]不同,本研究比较干预前后体质量增加量的变化,发现shift组体质量增加量较control组少。与T2DM组相比,T2DM+shift组小鼠体质量降低较少,可能是昼夜紊乱可能使糖尿病小鼠瘦素分泌减少[18],继而激发觅食行为从而增加体质量,影响胰高血糖素的分泌,从而使体质量消耗减少[19]。
一项对1 415名倒班工作者的现况调查发现,该人群血糖异常的发生率为21.2%,糖尿病的患病率为8.3%[20]。研究表明当作息改变、睡眠紊乱、饮食时间不规律等外源因素引起生物体昼夜节律紊乱时,可明显增加糖尿病的发病风险[15]。4 d的模拟夜班工作足以降低健康成年人胰岛素敏感性,增加T2DM的风险[21]。研究表明与内源性时钟异相进食会导致中央和外周时钟系统的节律之间以及不同组织时钟(如肝脏)的节律之间失去同步[22]。在最健康的情况下,这些器官的功能节律是同步的。本研究发现与control组相比,昼夜紊乱会使小鼠血糖增加。与T2DM组相比,T2DM+shift组血糖值仅有降低趋势,可能是由于不同的代谢活跃器官之间的失步从而导致葡萄糖稳态的改变[21]。
光照、昼夜节律基因等因素引起的昼夜节律失调会导致糖耐量降低,胰岛素敏感性下降,从而降低糖原合成、加强糖异生、胰岛素抵抗、葡萄糖稳态失衡,最终使血糖升高[23,24]。有研究在光照时间变化模拟的倒班小鼠中发现倒班会使雌性小鼠在光照时间的胰岛素敏感性发生变化[12],虽然每日葡萄糖耐量的平均水平没有降低,但是葡萄糖耐量的阶段提前了2.27 h,振幅降低了20.4%。OGTT期间血糖峰值延迟预示着β细胞功能下降和调节葡萄糖代谢的能力变差。本研究通过葡萄糖耐量试验和胰岛素耐量实验发现与control组相比,shift组AUC面积增加;与T2DM组相比,T2DM+shift组AUC面积增加;表明昼夜紊乱会使β细胞功能下降和调节葡萄糖代谢的能力变差、胰岛素分泌受损、糖耐量受损。这与先前的研究结果一致[25]。
研究发现[8],Per2缺陷小鼠和Cry1缺陷小鼠会出现葡萄糖不耐受,Cry1表达过多可通过抑制胰高血糖素的腺苷酸环化酶信号的传导来抑制肝脏糖异生并使胰岛素敏感性增加,Cry1与小分子物质KL001的结合可以防止泛素化降解从而使生物钟周期变长,并同时抑制胰高血糖素诱导的糖异生作用[26]。肝脏产生正常昼夜节律的关键是细胞色素Cyp2a4(Cytochrome P450 2A4, CYP2A4)和Cyp2a5(Cytochrome P450 2A45,CYP2A5)基因,Dbp与Cyp2a4/5启动子有高度亲和力的结合位点,可通过Cyp2a4/5调控小鼠肝脏中肝脏昼夜节律的表达并对Cyp2a4/5的转录具有抑制作用。Dbp基因敲除会导致小鼠肝脏正常的昼夜节律发生改变[27]。本研究发现与control组相比,T2DM组小鼠肝脏中的生物钟基因Dbp、Per2和Cry1的mRNA水平下调,而shift组和T2DM+shift组小鼠肝脏Dbp、Per2、Cry1基因表达升高;与T2DM组相比,T2DM+shift组小鼠肝脏Dbp、Per2、Cry1基因的表达升高。昼夜紊乱会上调生物钟基因Dbp、Per2、Cry1的mRNA表达水平,从而调控血糖及胰岛素分泌。
综上所述,昼夜紊乱会使正常小鼠体质量增加量减少、血糖升高,糖耐量和胰岛素分泌受损,肝脏生物节律基因Dbp、Per2、Cry1表达下调;使T2DM小鼠体质量增长,血糖水平降低,肝脏生物节律基因Dbp、Per2、Cry1基因表达升高。在本实验中未能进一步阐明昼夜紊乱如何通过具体的分子机制影响糖代谢及促进T2DM的发生发展,在后续试验中将进一步完善不足之处。
