miR-21-5p通过调控自噬减轻肥厚性心肌病小鼠的心肌损伤
2023-01-15张艳涛张晓东西安国际医学中心医院心脏内科西安710100通讯作者mailLchengafmu126com
王 伟,李 炜,韩 杨,张艳涛,张 杰,张晓东,廉 诚(西安国际医学中心医院心脏内科,西安 710100;通讯作者,E-mail:Lchengafmu@126.com)
心力衰竭是因各种心脏疾病导致心功能下降,从而引起心脏循环障碍的一组症候群,在世界范围内有着较高的发病率和死亡率[1]。瓣膜疾病、压力超负荷、心肌缺血和心肌细胞疾病均是其主要病因。其中,压力超负荷相关的肥厚型心肌病(hypertrophic cardiomyopathy, HCM)是导致心力衰竭最常见的病因之一[2]。病理生理学上,HCM是由心肌细胞肥大以及成纤维细胞和细胞外基质的显著增加引起的心肌质量的异常生长。这一过程最初是一种适应性反应,通过减少室壁应力和能量消耗来维持心脏功能[3]。然而,随着心肌细胞肥大和负荷的增加,与维持血液供应的微血管的生长/增殖不相匹配,最终导致心脏代谢失衡,进而发展为失代偿性心力衰竭[4]。
微小RNA(microRNAs, miRNAs)是一种小的非编码RNA,通过RNA干扰途径调节转录后的基因表达[5]。miR-21-5p在不同的人体组织中广泛表达,其表达的变化已在包括心血管疾病在内的多种疾病中得到证实[6]。近年来,越来越多的证据表明,miR-21-5p对缺血/再灌注损伤后的心脏具有明显的保护作用,并且在老年急性心肌梗死患者的血清中miR-21-5p表达水平也显著改变[7,8]。然而,关于miR-21-5p对HCM发挥何种生物学效应目前尚无相关报道。因此,本研究旨在通过主动脉弓缩窄术建立肥厚性心肌病模型,观察miR-21-5p对心肌肥厚小鼠的影响并探讨其潜在的作用机制。
1 材料与方法
1.1 实验动物及试剂
SPF级雄性C57BL/6小鼠40只,8周龄,体质量20~25 g,购于空军军医大学动物实验中心,动物合格证号:SCXK(军)2007-007号。TUNEL细胞凋亡检测试剂盒及PI3K抑制剂LY294002购自美国Sigma-Aldrich公司。逆转录TaqMan miRNA试剂盒购自美国Thermo公司。miR-21-5p agomir购自上海吉玛公司。胶原蛋白3(Collagen-3)、肌球蛋白样BCL2结合蛋白1(Beclin1)、自噬受体蛋白(P62)、微管相关蛋白轻链3(LC3)、磷脂酰肌醇-3-羟激酶(PI3K)、蛋白激酶B(PKB/Akt)、雷帕霉素靶蛋白(mTOR)和重组人β-肌动蛋白(β-actin)抗体购自美国Abcam公司。
1.2 动物模型的建立及分组处理
肥厚性心肌病动物模型采用经典的主动脉弓缩窄术建立[9],具体操作如下:小鼠吸入2%异氟醚麻醉后,置于有加热装置的操作平台上,将术中核心体温维持在37 ℃左右。使用小型动物呼吸机给予正压通气。经胸骨上部切开并打开胸壁后,仔细分离辨认出主动脉。在主动脉弓上放置25号穿刺针,并在左右颈总动脉之间用7-0丝线结扎,随后小心取出穿刺针。手术结束后,逐层缝合胸壁。假手术组小鼠除不结扎主动脉外,其余操作均与模型组相同。
将40只C57BL/6小鼠随机分为4组:假手术组(sham组)、模型组(TAC组)、miR-21-5p激动剂处理组(agomiR-21-5p组)和miR-21-5p激动剂+PI3K抑制剂处理组(agomiR-21-5p+LY294002组),每组10只。agomiR-21-5p组和agomiR-21-5p+LY294002组小鼠在TAC术后每间隔3 d经尾静脉注射10 nmol/L的miR-21-5p agomir,共计10次。agomiR-21-5p+LY294002组小鼠在给予miR-21-5p agomir注射的同时行腹腔注射LY294002(50 mg/kg)处理。所有小鼠均继续饲养至60 d进行小动物超声后处死并取材。
1.3 心功能测定
经胸超声心动图采用M型标准二维超声心动图检查。在左胸骨旁长轴方位、左心室二尖瓣和乳头肌水平测量左心室内部尺寸,即左室舒张末期内径(left ventricular end-diastolic dimension,LVEDD)、左室收缩末期内径(left ventricular end-systolic dimension,LVESD),至少监测3个连续的心脏周期。使用软件计算出左室射血分数(left ventricular ejection,LVEF)和左室短轴缩短率(left ventricular fractional shortening,LVFS)。
1.4 心肌组织学指标测定
处死前称小鼠体质量,分离新鲜心脏及右下肢胫骨,用PBS冲洗血液,切除血管、肌肉等多余组织,获取心脏质量及胫骨长度,计算心体比(heart weight/body weight, HW/BW)和心胫比(heart weight/tibial length, HW/TL)。
1.5 心肌组织切片染色
小鼠心脏组织取材后经4%多聚甲醛固定,石蜡包埋并切片,分别进行如下染色操作:①HE和Masson染色:按常规染色步骤进行染色并拍照,用Image J软件分析各组心脏的心肌细胞横截面积及纤维化程度。②TUNEL染色:组织切片经脱蜡、水合后,滴加蛋白酶K进行打孔处理。按TUNEL染色试剂盒说明书避光依次滴加TUNEL染液(着色凋亡细胞核)及DAPI染液(着色全部细胞核)。在每组切片中随机选择3个部位进行拍照并分析。凋亡计算公式为:TUNEL阳性细胞核(绿色)/细胞核总数(蓝色)。③免疫组化和免疫荧光染色:先用3% H2O2处理复水石蜡切片30 min,然后在室温下用Immuno-Block试剂孵育30 min。切片分别与Collagen-3(1 ∶500)和LC3B(1 ∶500)特异性的一抗孵育,使用无关抗体对对照组切片孵育。在每组切片中随机选择3个部位进行拍照并分析。用Image J软件分析,以Collagen-3染色强度表示心肌组织胶原沉着程度,以LC3B荧光强度表示心肌组织自噬程度。
1.6 qRT-PCR法检测心肌miR-21-5p及肥厚基因(ANP、α-MHC、β-MHC)表达
用Trizol试剂提取心脏组织总RNA,使用高容量cDNA逆转录试剂盒对总RNA进行反转录。qRT-PCR使用TaqMan miRNA检测试剂盒进行。实时PCR系统运行反应条件设定为:94 ℃热反应循环30 s,94 ℃ 5 s和60 ℃ 30 s,重复40次。miR-21-5p、U6、心房利钠肽(atrial natriuretic peptide, ANP)、肌球蛋白重链α(myosin heavy chain-α, α-MHC)、肌球蛋白重链β(myosin heavy chain-β, β-MHC)和磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase, GAPDH)引物由上海吉凯基因公司合成(见表1),miR-21-5p的表达量以U6为参照,ANP、α-MHC和β-MHC的表达量以GAPDH为参照。

表1 相关基因序列Table 1 Related gene sequence
1.7 Western blot法检测心肌组织蛋白(Beclin1、p62、LC3、PI3K、Akt、mTOR)表达
将等量(50 μg)的蛋白质提取物用丙烯酰胺梯度进行SDS-PAGE分离。电泳后,分离的蛋白质被转移到聚偏二氟乙烯膜上。非特异性位点经5%脱脂牛奶孵育过夜阻断。膜与Beclin1、P62、LC3、p-PI3K、p-Akt、p-mTOR、PI3K、Akt、mTOR和β-actin的一抗(1 ∶1 000)在4 ℃过夜孵育。用辣根过氧化物酶偶联免疫球蛋白IgG抗体作为二抗(1 ∶5 000),室温孵育1 h。以β-actin作为内参照,采用Bio-Rad软件对各蛋白条带进行量化分析。以p-PI3K/PI3K、p-Akt/Akt和p-mTOR/mTOR比值表示心肌组织PI3K/Akt通路激活程度,以Beclin1、P62表达和LC3Ⅱ/LC3Ⅰ比值表示心肌组织自噬强度。
1.8 统计学分析
2 结果
2.1 心肌miR-21-5p及PI3K/Akt信号通路表达比较
与sham组相比,TAC组小鼠心肌miR-21-5p相对表达水平显著降低(P<0.01),p-PI3K/PI3K、p-Akt/Akt和p-mTOR/mTOR比值均明显下调(P<0.01);与TAC组相比,agomiR-21-5p组小鼠心肌miR-21-5p表达显著增加(P<0.01),p-PI3K/PI3K、p-Akt/Akt和p-mTOR/mTOR比值均明显上调(P<0.01);与agomiR-21-5p组相比,agomiR-21-5p+LY294002组小鼠心肌miR-21-5p表达差异无统计学意义(P>0.05),而p-PI3K/PI3K、p-Akt/Akt和p-mTOR/mTOR比值均明显下调(P<0.01,见图1)。
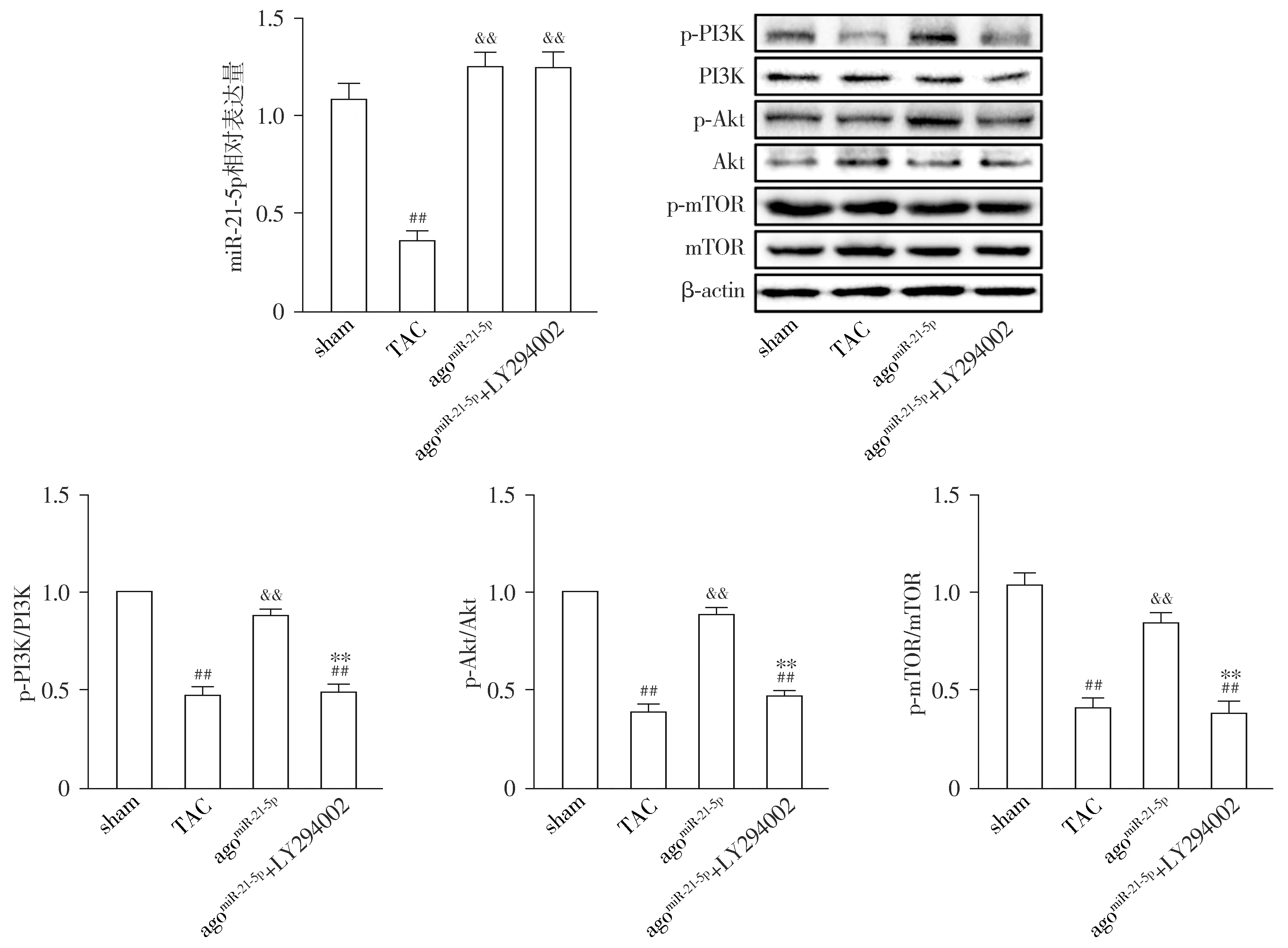
与sham组相比,##P<0.01;与TAC组相比,&&P<0.01;与agomiR-21-5p组相比,**P<0.01图1 各组小鼠心肌miR-21-5p及PI3K、Akt、mTOR蛋白表达比较Figure 1 Comparison of the expression of miR-21-5p and PI3K, Akt and mTOR between groups
2.2 小鼠心脏功能比较
与sham组相比,TAC组小鼠的心脏超声指标LVEF和LVFS值明显降低(P<0.01),LVESD和LVEDD值显著升高(P<0.01),提示心脏收缩功能明显下降;与TAC组相比,agomiR-21-5p组小鼠心脏超声指标LVEF和LVFS值明显升高(P<0.01),LVESD和LVEDD值显著降低(P<0.01),提示心脏收缩功能得到明显改善;与agomiR-21-5p组相比,agomiR-21-5p+LY294002组小鼠心脏LVEF和LVFS值明显下降(P<0.01),LVESD和LVEDD值显著增加(P<0.01,见图2),提示心脏收缩功能又明显受损。
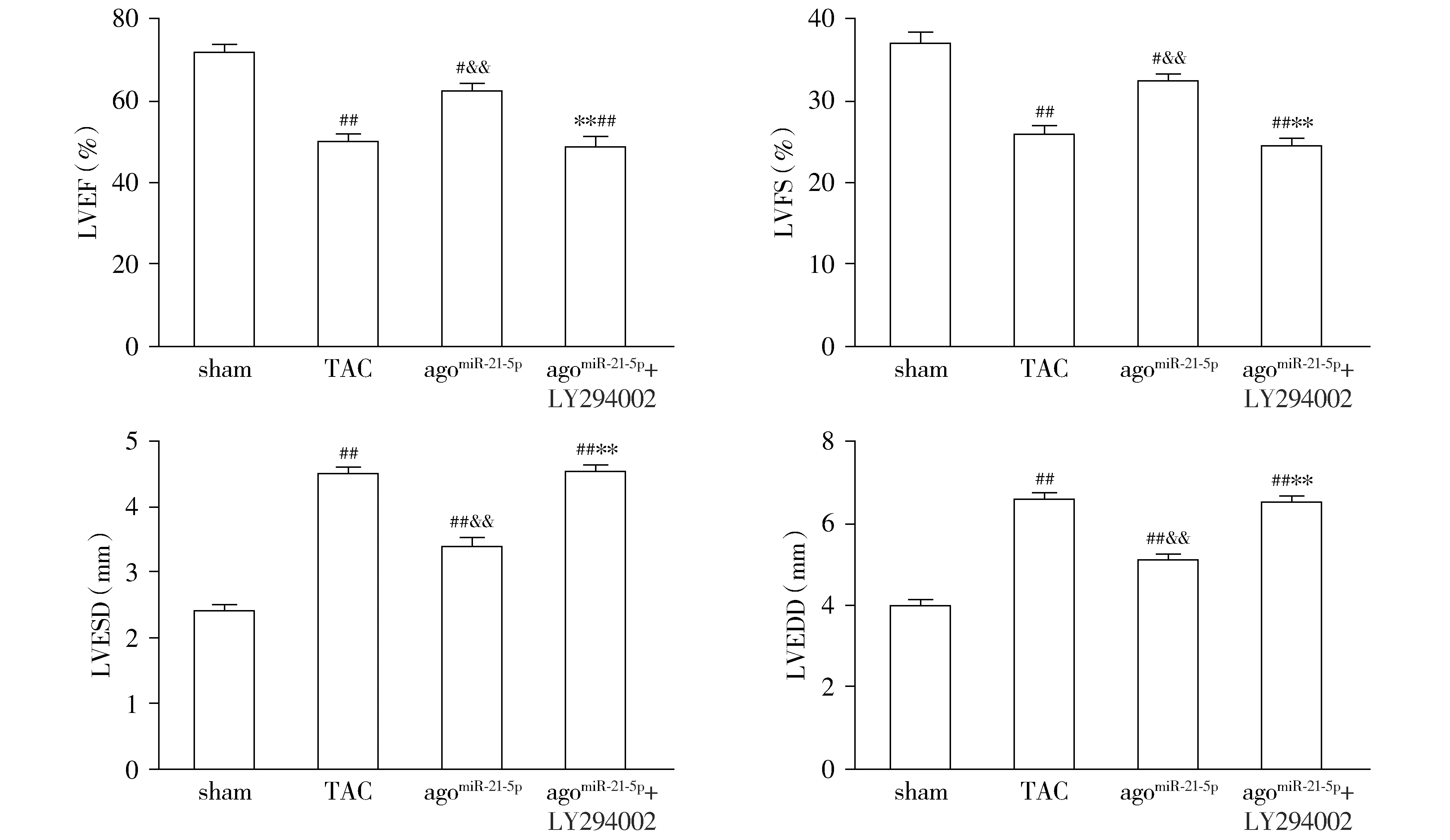
与sham组相比,#P<0.05,##P<0.01;与TAC组相比,&&P<0.01;与agomiR-21-5p组相比,**P<0.01图2 各组小鼠心脏超声检测结果Figure 2 Comparison of myocardial ultrasonic parameters of mice between groups
2.3 心肌肥厚指标比较
与sham组相比,TAC组小鼠的HW/BW和HW/TL值显著增加,心肌细胞横截面积明显增大(P<0.01);与TAC组相比,agomiR-21-5p组小鼠HW/BW和HW/TL值显著降低,心肌细胞横截面积明显减小(P<0.01);与agomiR-21-5p组相比,agomiR-21-5p+LY294002组小鼠HW/BW和HW/TL值显著升高,心肌细胞横截面积明显增加(P<0.01,见图3)。
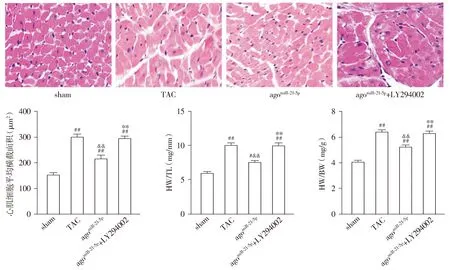
与sham组相比,#P<0.05,##P<0.01;与TAC组相比,&&P<0.01;与agomiR-21-5p组相比,**P<0.01图3 各组小鼠心肌肥厚指标比较 (HE,×400)Figure 3 Comparison of histological indexes of cardiac hypertrophy between groups (HE,×400)
2.4 心肌肥厚相关基因表达比较
与sham组相比,TAC组小鼠心肌α-MHC mRNA表达明显降低,β-MHC及ANP mRNA表达显著增加(P<0.01);与TAC组相比,agomiR-21-5p组小鼠心肌α-MHC mRNA表达明显增加,β-MHC及ANP mRNA表达显著降低(P<0.01);与agomiR-21-5p组相比,agomiR-21-5p+LY294002组小鼠心肌α-MHC mRNA表达明显下降,β-MHC及ANP mRNA表达显著升高(P<0.01,见图4)。

与sham组相比,##P<0.01;与TAC组相比,&&P<0.01;与agomiR-21-5p组相比,**P<0.01图4 各组小鼠心肌肥厚相关基因表达比较Figure 4 Comparison of gene expression of cardiac hypertrophy-related markers between groups
2.5 心肌纤维化程度比较
与sham组相比,TAC组小鼠的心肌组织纤维化程度及Collagen-3胶原沉着显著增加(P<0.01);与TAC组相比,agomiR-21-5p组小鼠心肌组织纤维化程度及Collagen-3胶原沉着显著降低(P<0.01);与agomiR-21-5p组相比,agomiR-21-5p+LY294002组小鼠心肌组织纤维化程度及Collagen-3胶原沉着显著增多(P<0.01,见图5)。
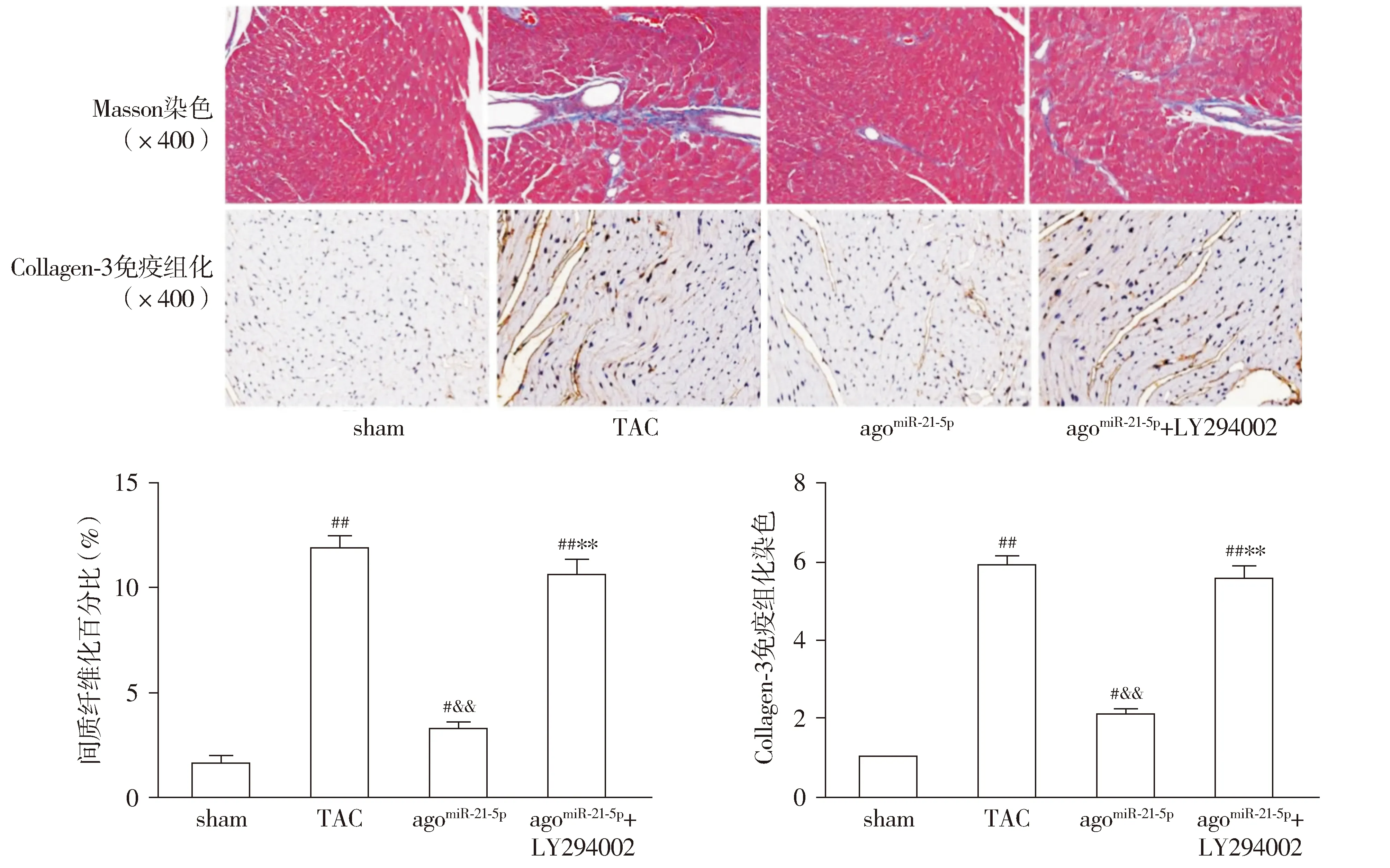
与sham组相比,#P<0.05,##P<0.01;与TAC组相比,&&P<0.01;与agomiR-21-5p组相比,**P<0.01图5 各组小鼠心肌纤维化程度比较Figure 5 Comparison of the degree of myocardial fibrosis between groups
2.6 心肌细胞凋亡水平比较
与sham组相比,TAC组小鼠的心肌细胞凋亡率显著增加(P<0.01);与TAC组相比,agomiR-21-5p组小鼠心肌细胞凋亡率显著降低(P<0.01);与agomiR-21-5p组相比,agomiR-21-5p+LY294002组小鼠心肌细胞凋亡率显著升高(P<0.01,见图6)。
2.7 心肌组织自噬蛋白LC3B免疫荧光表达比较
与sham组相比,TAC组小鼠心肌组织中自噬蛋白LC3B的荧光表达显著增加(P<0.01);与TAC组相比,agomiR-21-5p组小鼠心肌组织自噬蛋白LC3B的荧光表达显著降低(P<0.01);与agomiR-21-5p组相比,agomiR-21-5p+LY294002组小鼠心肌组织自噬蛋白LC3B的荧光表达显著增强(P<0.01,见图7)。
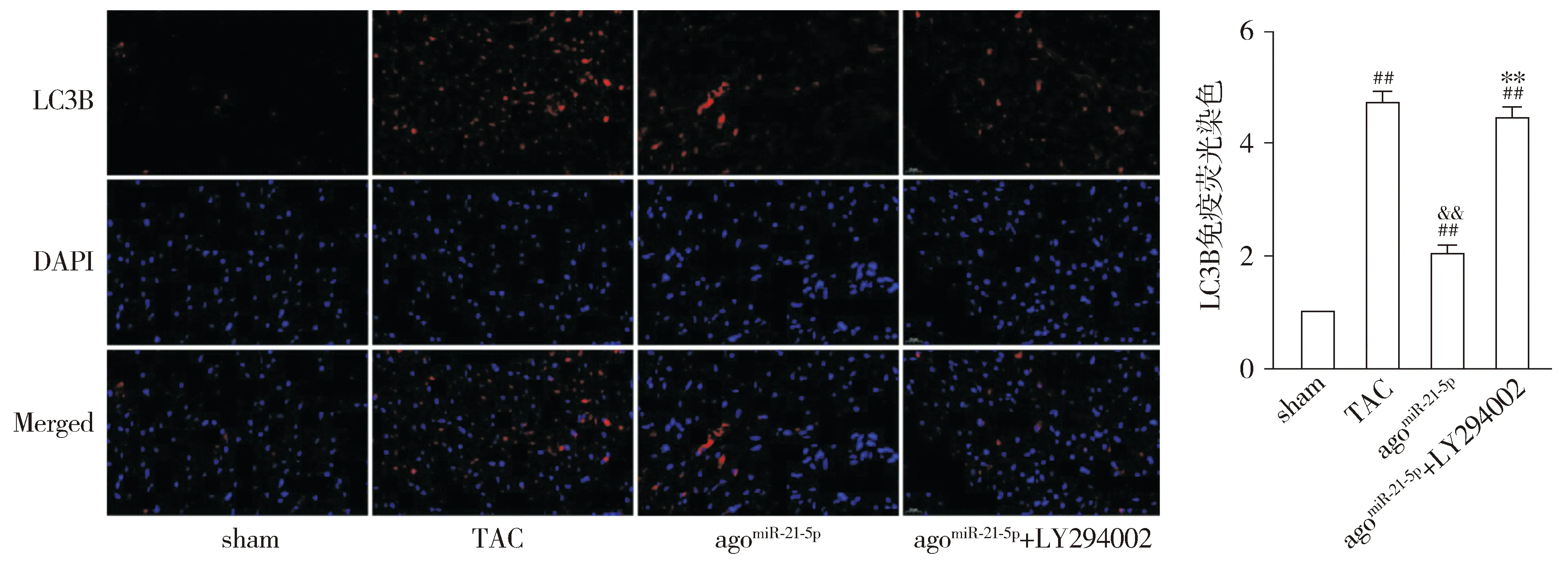
红色荧光显示LC3B染色,蓝色荧光显示细胞核染色;与sham组相比,##P<0.01;与TAC组相比,&&P<0.01;与agomiR-21-5p组相比,**P<0.01图7 各组小鼠心肌自噬蛋白LC3B免疫荧光表达比较 (×400)Figure 7 Comparison of immunofluorescence expression of LC3B between groups (×400)
2.8 心肌组织自噬相关蛋白表达比较
与sham组相比,TAC组小鼠的心肌组织Beclin1蛋白表达和LC3Ⅱ/LC3Ⅰ比例显著增加,P62蛋白表达明显降低(P<0.01);与TAC组相比,agomiR-21-5p组小鼠心肌组织Beclin1蛋白表达和LC3Ⅱ/LC3Ⅰ比例显著减低,P62蛋白表达明显增加(P<0.01);与agomiR-21-5p组相比,agomiR-21-5p+LY294002组小鼠心肌组织Beclin1蛋白表达和LC3Ⅱ/LC3Ⅰ比例显著上调,P62蛋白表达明显下调(P<0.01,见图8)。

与sham组相比,##P<0.01;与TAC组相比,&&P<0.01;与agomiR-21-5p组相比,**P<0.01图8 各组小鼠心肌自噬相关蛋白表达比较Figure 8 Comparison of the expression of autophagy-related proteins between groups
3 讨论
肥厚性心肌病的病理学特征已被公认为是心脏重塑,即心肌细胞和间质的改变,继而影响心脏大小、形态和功能[2]。心脏重塑是不同心脏疾病的共同途径,被认为是导致心脏功能障碍的重要方面,也是心衰临床病程进展的确定因素[10]。据报道,左心室重构在多种心脏疾病中均广泛存在,如肥厚性心肌病、扩张性心肌病、心肌梗死和慢性缺血性心脏病[11]。心脏重构不仅是预测心脏功能恶化的重要参数,也是心衰患者长期预后不良的重要临床指标。肥厚心脏的心肌通常经历许多结构改变,最显著的是心肌细胞的肥大和细胞外基质的增加,通常被视为原发性纤维化[12]。研究进一步发现,间质纤维化和过度积累的细胞外基质在调节左心室重塑中起着至关重要的作用[13]。此外,肥厚性心肌病的心肌纤维化不仅被发现与心脏功能受损和心力衰竭有关,而且被认为是室性心律失常和猝死的关键因素[14]。
本研究中同样观察到,与sham组相比,经胸超声心动图测量的参数显示了TAC组小鼠左室收缩功能显著降低。且TAC组小鼠的HW/BW及HW/TL显著增加,心肌组织ANP和β-MHC mRNA表达明显上升。此外,与sham组相比,TAC组小鼠心肌细胞横截面积明显增大,并且TAC组小鼠心肌组织纤维化面积、Collagen-3胶原沉积比例和凋亡细胞均显著增加。因此,我们的结果证实主动脉弓缩窄术可以成功地建立小鼠肥厚性心肌病模型。
近年来miRNAs在调节人类疾病(包括心肌肥厚和心力衰竭)中的作用受到了广泛关注[15]。例如,抑制miRNA-146a可减轻压力超负荷诱导的心肌肥厚和功能障碍[16]。抑制miR-206的表达加重了心肌缺血/再灌注损伤,而减轻了压力超负荷诱导的心肌肥厚[17]。此外,Osmak等[18]最近发现hsa-miR-21-5p是调控人类心肌肥厚的重要miRNAs之一,并且Pizzino等[19]的研究表明,miR-21-5p抑制剂可以促进静息心肌细胞的轻微增大,并进一步增强了血管Ⅱ介导的HL1心肌细胞肥厚反应。然而,miR-21-5p在主动脉弓缩窄术诱导的小鼠心肌肥厚中的确切作用仍有待进一步探索。我们的实验结果发现,与sham组相比,TAC组小鼠心肌miR-21-5p的表达显著下调。给予miR-21-5p agomir处理后,与TAC组相比,agomiR+21-5p组小鼠心肌miR-21-5p的表达显著上调,且心肌组织超微结构病理改变及心肌细胞凋亡被显著逆转,进而肥厚性心肌病小鼠的心脏功能及心室重构均得到明显改善。上述研究结果显示,miR-21-5p过表达在延缓肥厚性心肌病心肌病理结构改变上具有显著效果,进一步表明了miR-21-5p在减轻肥厚性心肌病心肌损伤方面的有效性。
自噬是一种进化上保守的分解代谢过程,用于降解和回收长寿命的蛋白质和受损的细胞器[20]。在生理条件下,低水平的自噬发挥细胞保护和细胞器更新的作用,该过程对维持心脏稳态具有至关重要的作用。相反,过度的自噬激活会加重病理性心脏重塑[21]。虽然自噬诱导的机制还不完全清楚,许多研究已经确定了自噬在肥厚性心肌病发展中的作用。在从肥厚性心肌病向心力衰竭过渡的患者的心内膜心肌活检中,观察到大量自噬空泡,这表明自噬在肥厚性心肌病心脏的晚期阶段被显著激活,进而加重了心肌损伤[22,23]。此外,miRNAs、自噬和心肌肥厚之间的交联最近已被证实。miR-365通过靶向Skp2负向调节肥厚心肌细胞的自噬[24]。miR-34a通过抑制ATG9A表达和自噬活性,调控血管紧张素Ⅱ诱导的心肌肥厚[25]。然而,miR-21-5p对肥厚性心肌病心肌自噬的影响尚未明确。本实验发现,与sham组相比,TAC组小鼠心肌自噬核心蛋白LC3B荧光表达明显增强,且LC3Ⅱ/LC3Ⅰ比例及自噬早期膜成核蛋白Beclin1的表达显著增加,同时选择性自噬多功能蛋白P62表达明显上调,这些结果均与上述研究结果相一致。同样的,给予miR-21-5p agomir处理后,肥厚性心肌病小鼠心肌组织自噬水平明显减低,这表明miR-21-5p过表达对肥厚性心肌病心肌损伤的保护作用可能是通过抑制心肌过度自噬来实现的。
磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(Akt)/哺乳动物雷帕霉素靶蛋白(mTOR)信号通路已被证实是调节细胞自噬的关键通路[26]。mTORC直接参与调节细胞自噬蛋白的活动,其上游调控因子主要为PI3K/Akt轴。PI3K催化亚基通过激活Akt蛋白进而激活mTORC以整合来自细胞环境的信号通路,最终抑制细胞自噬反应[27]。已有研究发现PI3K/Akt信号在心肌肥厚中对自噬的调控作用[28,29],然而其是否介导了miR-21-5p对肥厚性心肌病心肌组织过度自噬的抑制仍需进一步探究。本研究首先观察到,与sham组相比,TAC组小鼠心肌组织PI3K/Akt信号表达明显被抑制,给予miR-21-5p agomir处理后,肥厚性心肌病小鼠心肌组织PI3K/Akt信号表达显著上调,表明PI3K/Akt信号可能是miR-21-5p减轻肥厚性心肌病心肌损伤的关键通路。通过引入PI3K信号特异性抑制剂LY294002,我们进一步发现,PI3K/Akt信号被miR-21-5p激活时,肥厚性心肌病小鼠心肌组织自噬水平显著降低,心肌损伤明显减轻。而阻断PI3K/Akt信号后,肥厚性心肌病小鼠心肌组织自噬水平又明显增强,心肌损伤又进一步加重。
综上所述,本研究首次观察到miR-21-5p过表达可显著缓解肥厚性心肌病小鼠的心肌损伤,能够有效改善小鼠心脏功能恶化并延缓心肌细胞肥大和心肌组织纤维化进展,其作用可能与其激活PI3K/Akt信号通路,进而抑制心肌过度自噬有关。
