lncRNA HOTAIRM1通过miR-17-5p调控慢性粒细胞白血病细胞的生长和转移
2023-01-15苗玉迪侯丽敏胡星星赵乔佳杰魏旭仓陕西省人民医院血液内科西安7006陕西省人民医院血液病研究室通讯作者mailmiaoyudi6com
苗玉迪,高 瑛,侯丽敏,胡星星,张 虹,赵乔佳杰,魏旭仓(陕西省人民医院血液内科,西安 7006;陕西省人民医院血液病研究室;通讯作者,E-mail:miaoyudi6@6.com)
慢性粒细胞白血病(chronic myelocytic leukemia, CML)是一种起源于多能造血干细胞的造血干细胞肿瘤增生性疾病[1,2],主要患病人群为中老年人[3]。虽然酪氨酸激酶抑制剂(tyrosine kinase inhibitors, TKI)如伊马替尼对CML患者具有良好的治疗效果,但仍有部分患者的治疗效果不理想,复发率较高[4]。因此,仍需要开发新型CML治疗靶点。长链非编码RNA(long non-coding RNA,lncRNA)是一类长度在200个核苷酸(nt)以上但缺乏蛋白编码功能的RNA。其虽不能编码蛋白质,但能够通过吸附microRNAs(miRNAs)间接调控靶基因表达,以及对蛋白质进行修饰[5,6]。HOX反义基因间RNA髓系1(HOX transcript antisense intergenic RNA, HOTAIRM1)是一种lncRNA,参与多种肿瘤的生长和转移,包括结直肠癌、乳腺癌、急性髓细胞白血病[7,8]。然而,目前HOTAIRM1在CML中的作用仍有待阐明。miRNAs是一类长约20~25个核苷酸的内源性非编码RNA,参与人类近1/3的基因表达,并且与肿瘤的生长及转移密切相关。miRNAs主要通过多条信号通路来影响癌细胞的功能,其中包括WNT/β-catenin信号通路[9]。现有研究证实,miR-17-5p是HOTAIRM1的靶标miRNA,并且调节癌细胞的生物学功能[10]。基于上述研究背景,本研究旨在揭示CML患者血清中lncRNA HOTAIRM1的表达水平,及其在CML发生发展中的作用及可能机制,从而探讨HOTAIRM1作为CML的早期诊断标志物及治疗靶点的潜力。
1 材料与方法
1.1 细胞株及主要试剂
CML细胞系(K562细胞)购自美国ATCC公司。Lipofectamine 2000、cDNA逆转录试剂盒购自美国Invitrogen公司。IMDM培养基购自美国GIBCO公司。MTT溶液、RIPA裂解液、BCA蛋白浓度分析试剂盒、SDS-PAGE凝胶配制试剂盒、BeyoECL Plus(超敏ECL化学发光试剂盒)、Trizol试剂均购自碧云天生物技术研究所。聚偏氟乙烯(PVDF)膜购自美国Millipore公司。DMSO购自美国Sigma-Aldrich公司。Transwell购自美国Corning公司。SYBR Green Master Mix购自美国ABI公司。WNT5A一抗、β-catenin一抗、GAPDH一抗、HRP标记的二抗均购自英国Abcam公司。Dual-LuciferaseTMReporter Assay System E1910购自美国Promega公司。
1.2 临床CML样本收集
采集陕西省人民医院血液内科2020年1月至2021年12月确诊CML患者60例和健康体检者60例受试者的血液样本。所有患者术前均未行化疗等治疗,并排除合并有其他恶性肿瘤、全身严重感染等严重全身性疾病。整理病人临床病理资料:包括年龄、性别等,并对病人进行随访,记录病人治疗及预后情况。本研究已通过陕西省人民医院伦理委员会的批准,本研究的所有患者均签署试验知情同意书。
1.3 CML细胞的培养
采用含10%胎牛血清(FBS)的IMDM培养基培养CML细胞系(K562细胞),培养条件为37 ℃、5%CO2。
1.4 CML细胞的分组和转染处理
按照研究方案将K562细胞分为3类:①为了考察HOTAIRM1对K562细胞增殖、凋亡、迁移和侵袭的影响,将K562细胞分为对照组、siRNA-NC组、siRNA-HOTAIRM1组、pcDNA-NC组和pcDNA-HOTAIRM1组;②为了考察miR-17-5p对K562细胞增殖、凋亡、迁移和侵袭的影响,将K562细胞分为对照组、NC-mimic组、miR-17-5p-mimic组、NC-inhibitor组和miR-17-5p-inhibitor组;③为了考察HOTAIRM1是否通过miR-17-5p调控K562细胞增殖、凋亡、迁移和侵袭,将K562细胞分为siRNA-HOTAIRM1+NC-inhibitor组和siRNA-HOTAIRM1+miR-17-5p-inhibitor组。委托吉玛基因设计并合成siRNA-NC、siRNA-HOTAIRM1、pcDNA-NC、pcDNA-HOTAIRM1过表达质粒、NC-mimic、miR-17-5p-mimic、NC-inhibitor和miR-17-5p-inhibitor。将K562细胞接种于6孔板,当细胞达到80%融合时,利用Lipofectamine 2000按照分组要求分别对细胞进行转染。未转染的细胞作为对照组。通过qRT-PCR方法检测转染效率。不同分组的细胞转染后均进行MTT实验、Annexin Ⅴ/PI双染色实验、Transwell实验、qRT-PCR和Western blot检测。
1.5 MTT法检测细胞增殖
将K562细胞以每孔3 000个细胞的密度接种于96孔板,转染后48 h,每孔分别加入MTT溶液和DMSO,置于细胞培养箱内在37 ℃、CO2下孵育4 h,用酶标仪检测490 nm的光密度值(OD)。
1.6 Transwell检测细胞迁移和侵袭
细胞转染后,用无血清培养基重悬细胞,按2×105/ml浓度接种于Transwell小室上部,下部加入含10%血清的培养基,培养24 h,用棉签擦去上室底部未迁移的细胞,迁移到下室的细胞用结晶紫染色,显微镜下取6个随机视野计数。此外,上室底部预先涂覆基质胶,其他实验步骤同迁移,用于分析细胞侵袭能力。
1.7 双荧光素酶报告基因实验
重组质粒均由吉玛基因合成。根据结合靶点设计miR-17-5p的3′-UTR结合序列及突变序列克隆到载体pGL3-promoter上,构建pGL3-miR-17-5p-3′UTR野生(miR-17-5p-WT)和pGL3-miR-17-5p-3′UTR突变(miR-17-5p-MUT)重组质粒。利用Lipofectamine 2000将miR-17-5p-WT或miR-17-5p-MUT及pcDNA-NC或pcDNA-HOTAIRM1共同转染到K562细胞中。此外,构建pGL3-WNT5A-3′UTR野生(WNT5A-WT)和pGL3-WNT5A-3′UTR突变(WNT5A-MUT)重组质粒。利用Lipofectamine 2000将WNT5A-WT或WNT5A-MUT及NC-mimic或miR-17-5p-mimic共同转染到K562细胞中。转染后48 h通过Dual-Luciferase®Reporter Assay System E1910检测荧光强度,以Renilla荧光素酶为内参。
1.8 qRT-PCR检测受试者血清及细胞中HOTAIRM1、miR-17-5p、WNT5A和β-catenin的mRNA水平
收集60例CML患者和60例健康体检者的清晨空腹静脉血5 ml,3 000 r/min离心10 min分离血清。采用qRT-PCR方法分别检测受试者血清及K562细胞中HOTAIRM1、miR-17-5p、WNT5A mRNA和β-catenin的mRNA水平。根据试剂盒说明书,使用Trizol试剂从受试者血清及K562细胞中提取总RNA。使用NanoDrop分光光度计对RNA进行定量。使用cDNA逆转录试剂盒将总RNA逆转录成cDNA。基因特异性引物由生工生物工程(上海)股份有限公司提供(见表1)。使用SYBR Green Master Mix在ABI 7900HT荧光定量PCR仪上进行qRT-PCR扩增。扩增条件如下:95 ℃预变性3 min,95 ℃变性15 s,65 ℃退火延伸30 s,共40个循环。GAPDH和U6为内参基因。通过2-ΔΔCt法计算相对表达量。

表1 引物序列Table 1 Primer sequences
1.9 Western blot检测细胞WNT5A和β-catenin的蛋白水平
用RIPA裂解液裂解K562细胞。用BCA蛋白浓度分析试剂盒测量蛋白浓度。用SDS-PAGE将40 μg的蛋白裂解产物转移到PVDF膜上。用5%的脱脂牛奶封闭PVDF膜2 h,然后在4 ℃下与1 ∶1 000稀释的抗WNT5A和β-catenin、GAPDH的一抗孵育过夜,然后用1 ∶1 000稀释的HRP标记的二抗在室温下孵育1 h。最后,使用ECL进行显影。GAPDH作为内参蛋白。
1.10 统计分析
使用SPSS21.0软件和GraphPad Prism 8.0软件对数据进行统计分析,计量数据经正态分布检验后,通过t检验比较两组间差异,通过单因素方差分析及LSD事后检验比较多组间差异。ROC曲线分析受试者血清HOTAIRM1和miR-17-5p诊断CML的价值。显著性水平为P<0.05。
2 结果
2.1 CML患者和健康体检者的血清HOTAIRM1和miR-17-5p表达水平
与健康体检者相比,CML患者的血清中HOTAIRM1水平显著升高(t=12.253,P<0.001),血清中miR-17-5p水平显著降低(t=15.601,P<0.001,见图1)。ROC曲线分析结果显示,血清中HOTAIRM1、miR-17-5p及两者联合诊断的曲线下面积(AUC)依次为0.945,0.958和0.998,诊断价值较高(见表2和图 2)。不同性别和年龄的CML患者的血清HOTAIRM1和miR-17-5p水平均无显著差异(P>0.05,见表3)。

与健康体检者相比,***P<0.001图1 CML患者和健康体检者的血清中HOTAIRM1和miR-17-5p表达水平Figure 1 Serum HOTAIRM1 and miR-17-5p expression levels in CML patients and healthy subjects

A.血清HOTAIRM1诊断价值 B.血清miR-17-5p诊断价值 C.血清HOTAIRM1和miR-17-5p联合诊断价值图2 血清中HOTAIRM1和miR-17-5p诊断CML的ROC曲线Figure 2 ROC curves of serum HOTAIRM1 and miR-17-5p in the diagnosis of CML
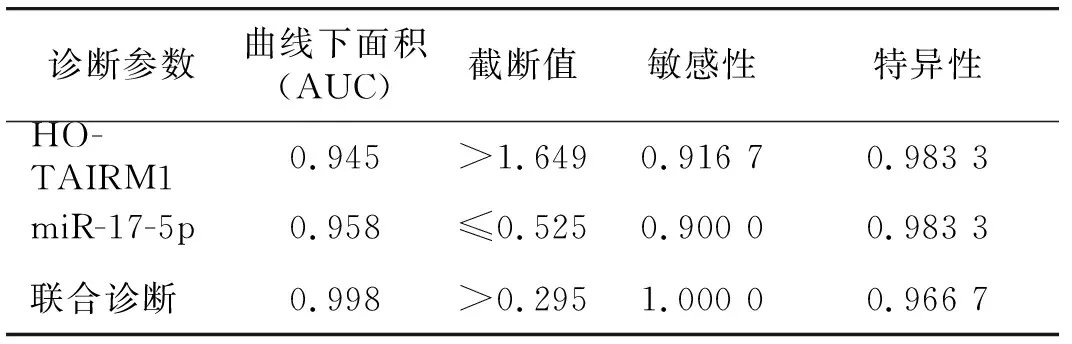
表2 血清中HOTAIRM1和miR-17-5p诊断CML的价值分析Table 2 Clinical values of serum HOTAIRM1 and miR-17-5p in the diagnosis of CML

表3 不同性别和年龄的CML患者血清中HOTAIRM1和miR-17-5p水平Table 3 Serum HOTAIRM1 and miR-17-5p levels in CML patients of different genders and ages
2.2 HOTAIRM1对K562细胞增殖的影响
转染后,与对照组或siRNA-NC组相比,siRNA-HOTAIRM1组HOTAIRM1相对表达量显著降低(P<0.05);与对照组或pcDNA-NC组相比,pcDNA-HOTAIRM1组HOTAIRM1相对表达量显著升高(P<0.05,见图3)。MTT检测结果显示,与对照组或siRNA-NC组相比,siRNA-HOTAIRM1组细胞活力显著降低(P<0.05);与对照组或pcDNA-NC组相比,pcDNA-HOTAIRM1组细胞活力显著升高(P<0.05,见图3)。
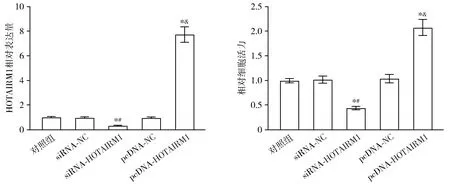
与对照组比较,*P<0.05;与siRNA-NC组比较,#P<0.05;与pcDNA-NC组比较,&P<0.05图3 HOTAIRM1对K562细胞增殖的影响Figure 3 Effect of HOTAIRM1 on the proliferation of K562 cells
2.3 HOTAIRM1对K562细胞迁移和侵袭的影响
Transwell检测显示,与对照组或siRNA-NC组相比,siRNA-HOTAIRM1组细胞迁移和侵袭数量显著降低(P<0.05);与对照组或pcDNA-NC组相比,pcDNA-HOTAIRM1组细胞迁移和侵袭数量显著升高(P<0.05,见图4)。

与对照组比较,*P<0.05;与siRNA-NC组比较,#P<0.05;与pcDNA-NC组比较,&P<0.05图4 HOTAIRM1对K562细胞迁移和侵袭的影响 (×400)Figure 4 The effect of HOTAIRM1 on the migration and invasion of K562 cells (×400)
2.4 HOTAIRM1对K562细胞WNT5A/β-catenin信号通路的影响
qRT-PCR检测结果显示,与对照组或siRNA-NC组相比,siRNA-HOTAIRM1组WNT5A和β-catenin的mRNA相对表达量均显著降低(P<0.05);与对照组或pcDNA-NC组相比,pcDNA-HOTAIRM1组WNT5A和β-catenin的mRNA相对表达量均显著升高(P<0.05,见图5)。Western blot检测结果显示,与对照组或siRNA-NC组相比,siRNA-HOTAIRM1组的WNT5A和β-catenin蛋白相对表达量均显著降低(P<0.05);与对照组或pcDNA-NC组相比,pcDNA-HOTAIRM1组的WNT5A和β-catenin蛋白相对表达量均显著升高(P<0.05,见图5)。
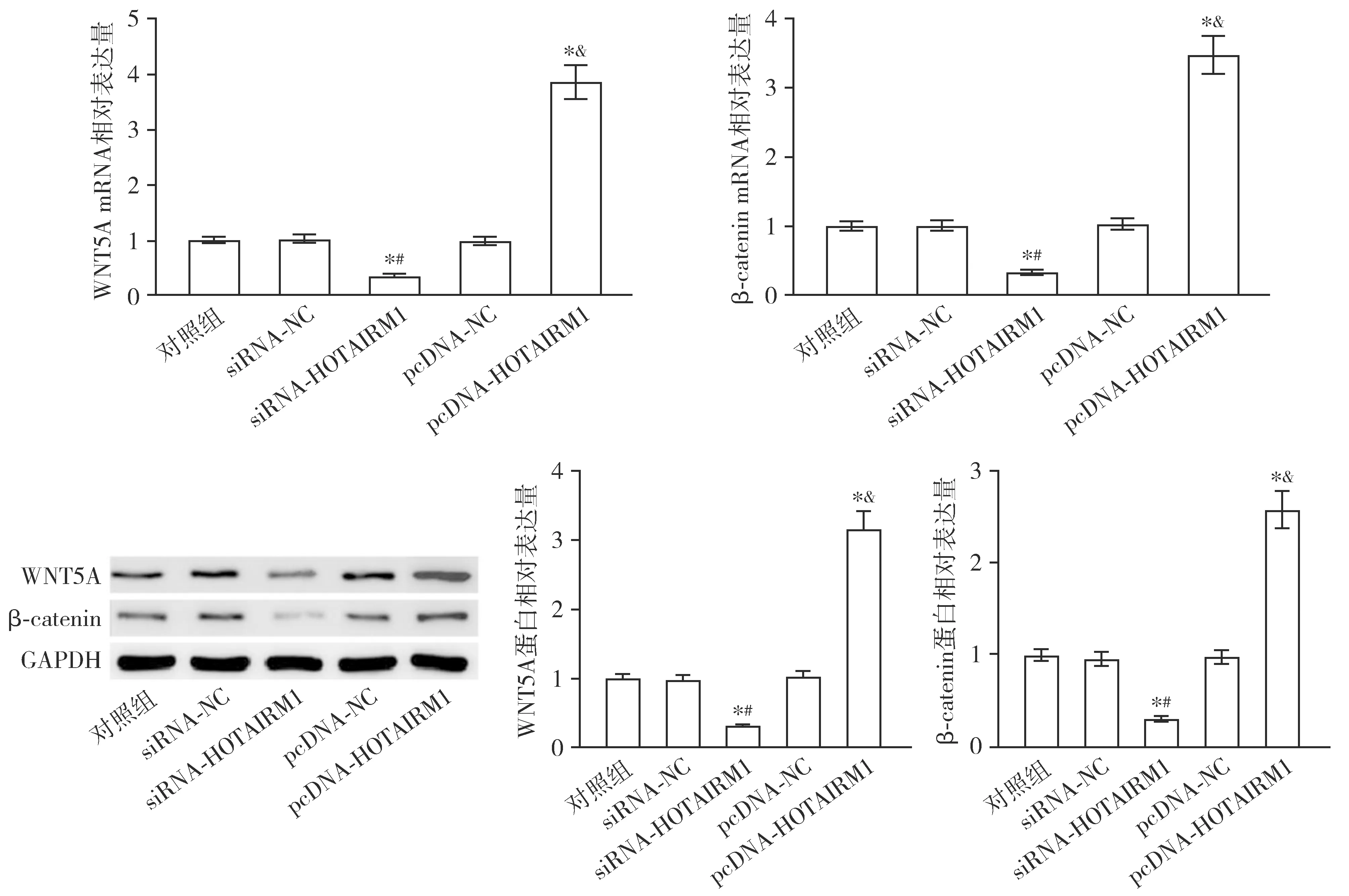
与对照组比较,*P<0.05;与siRNA-NC组比较,#P<0.05;与pcDNA-NC组比较,&P<0.05图5 HOTAIRM1对K562细胞中WNT5A和β-catenin表达的影响Figure 5 Effects of HOTAIRM1 on the expression of WNT5A and β-catenin in K562 cells
2.5 HOTAIRM1与miR-17-5p的靶向调控关系
Starbase数据库预测HOTAIRM1和miR-17-5p之间存在潜在结合位点(见图6),双荧光素酶报告基因实验检测结果显示,与miR-17-5p-WT+pcDNA-NC组相比,miR-17-5p-WT+pcDNA-HOTAIRM1组的相对荧光素酶活性显著降低(P<0.05,见图6)。qRT-PCR检测结果显示,与对照组或siRNA-NC组相比,siRNA-HOTAIRM1组的miR-17-5p相对表达量显著升高(P<0.05);与对照组或pcDNA-NC组相比,pcDNA-HOTAIRM1组显著降低(P<0.05,见图6)。

与miR-17-5p-WT+pcDNA-NC组比较,△P<0.05;与对照组比较,*P<0.05;与siRNA-NC组比较,#P<0.05;与pcDNA-NC组比较,&P<0.05图6 HOTAIRM1与miR-17-5p的靶向调控关系Figure 6 Targeted regulation relationship between HOTAIRM1 and miR-17-5p
2.6 miR-17-5p与WNT5A的靶向调控关系
Starbase数据库预测miR-17-5p和WNT5A之间均存在潜在结合位点,与WNT5A-WT+NC-mimic组相比,WNT5A-WT+miR-17-5p-mimic组的相对荧光素酶活性显著降低(P<0.05,见图7)。
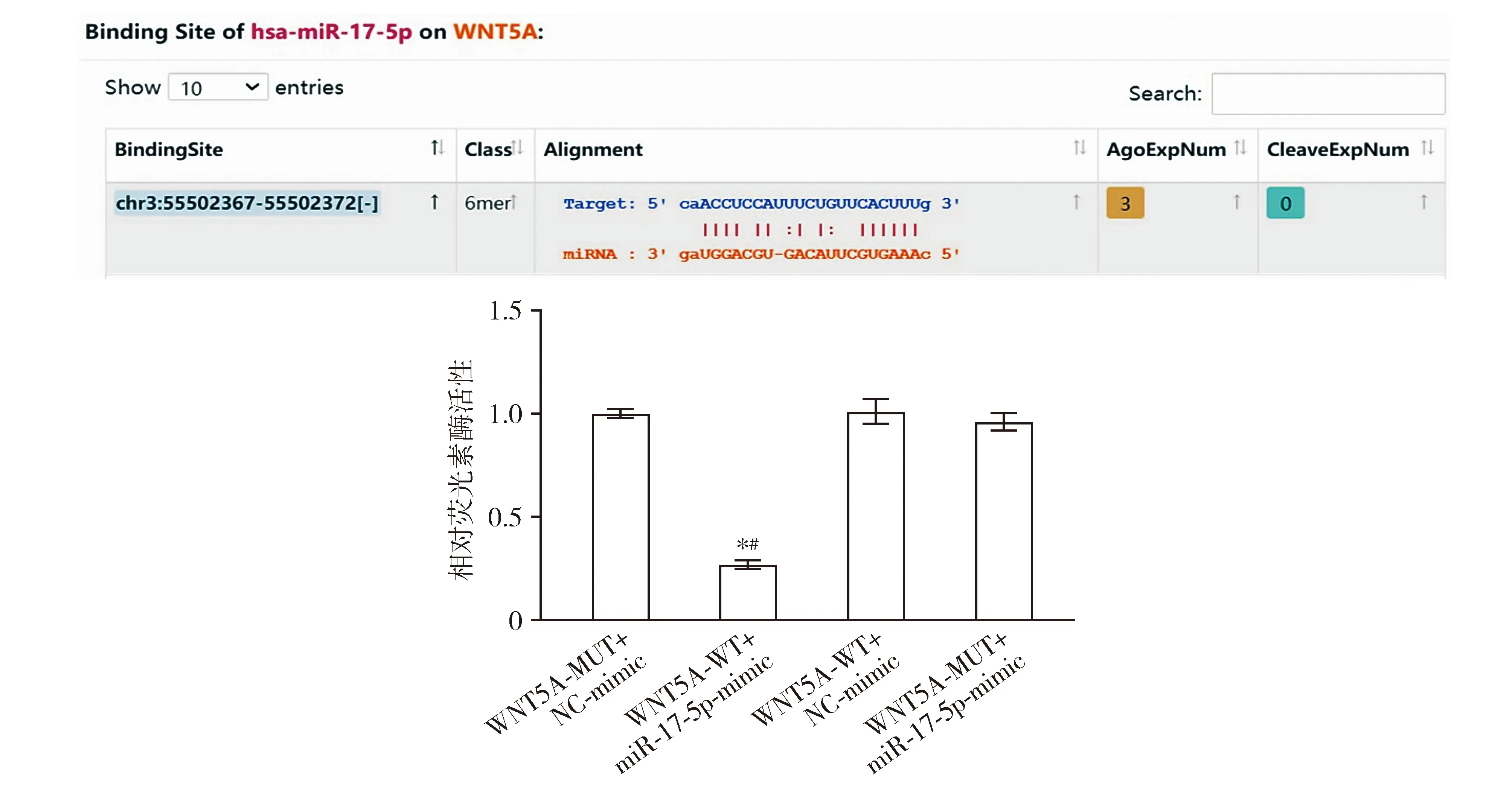
与WNT5A-WT+NC-mimic组比较,*P<0.05图7 Starbase数据库预测HOTAIRM1与WNT5A的靶向调控关系及验证Figure 7 The targeting regulation relationship between HOTAIRM1 and WNT5A by Starbase database
2.7 miR-17-5p对K562细胞中WNT5A/β-catenin信号通路的调控作用
qRT-PCR检测结果显示,与对照组或NC-mimic组相比,miR-17-5p-mimic组miR-17-5p相对表达量显著升高,WNT5A和β-catenin的mRNA相对表达量均显著降低(P<0.05);与对照组或NC-inhibitor组相比,miR-17-5p-inhibitor组miR-17-5p相对表达量显著降低,WNT5A和β-catenin的mRNA相对表达量均显著升高(P<0.05,见图8)。Western blot检测显示,与对照组或NC-mimic组相比,miR-17-5p-mimic组WNT5A和β-catenin蛋白相对表达量均显著降低(P<0.05);与对照组或NC-inhibitor组相比,miR-17-5p-inhibitor组的WNT5A和β-catenin蛋白相对表达量均显著升高(P<0.05,见图8)。

与对照组比较,*P<0.05;与NC-mimic组比较,#P<0.05;与NC-inhibitor组比较,&P<0.05图8 miR-17-5p对K562细胞中WNT5A和β-catenin表达的影响Figure 8 Effects of miR-17-5p on the expression of WNT5A and β-catenin in K562 cells
2.8 miR-17-5p对K562细胞增殖、迁移和侵袭的调控作用
与对照组或NC-mimic组相比,miR-17-5p-mimic组相对细胞活力显著降低(P<0.05);与对照组或NC-inhibitor组相比,miR-17-5p-inhibitor组相对细胞活力显著升高(P<0.05,见图9)。与对照组或NC-mimic组相比,miR-17-5p-mimic组迁移和侵袭细胞数量均显著降低(P<0.05);与对照组或NC-inhibitor组相比,miR-17-5p-inhibitor组迁移和侵袭细胞数量均显著升高(P<0.05,见图10)。

与对照组比较,*P<0.05;与NC-mimic组比较,#P<0.05;与NC-inhibitor组比较,&P<0.05图9 miR-17-5p对K562细胞增殖的影响Figure 9 The effect of miR-17-5p on the proliferation of K562 cells
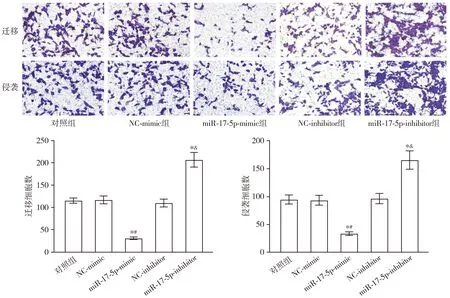
与对照组比较,*P<0.05;与NC-mimic组比较,#P<0.05;与NC-inhibitor组比较,&P<0.05图10 miR-17-5p对K562细胞迁移和侵袭的影响 (×400)Figure 10 Effects of miR-17-5p on migration and invasion of K562 cells (×400)
2.9 HOTAIRM1通过miR-17-5p调控K562细胞增殖、迁移和侵袭及WNT5A/β-catenin信号通路
与si-HOTAIRM1+NC-inhibitor组相比,si-HOTAIRM1+miR-17-5p-inhibitor组相对细胞活力显著升高(t=15.463,P<0.001),迁移和侵袭细胞数量均显著升高(t=13.401,P<0.001;t=12.115,P<0.001,见图11)。与si-HOTAIRM1+NC-inhibitor组相比,si-HOTAIRM1+miR-17-5p-inhibitor组WNT5A和β-catenin的mRNA(t=18.906,P<0.001;t=16.726,P<0.001)和蛋白(t=13.122,P<0.001;t=12.680,P<0.001)相对表达量均显著升高(见图12)。
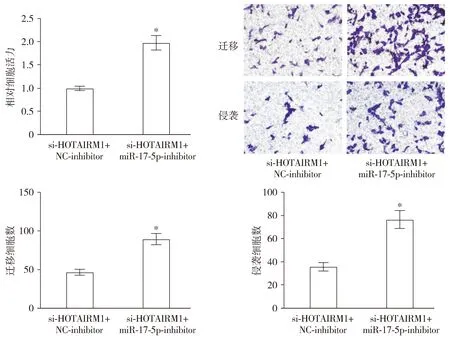
与si-HOTAIRM1+NC-inhibitor组比较,*P<0.05图11 HOTAIRM1通过miR-17-5p调控K562细胞增殖、迁移和侵袭 (×400)Figure 11 HOTAIRM1 regulates K562 cell proliferation, migration and invasion through miR-17-5p (×400)

与si-HOTAIRM1+NC-inhibtor组比较,*P<0.05图12 HOTAIRM1通过miR-17-5p调控K562细胞WNT5A/β-catenin信号通路Figure 12 HOTAIRM1 regulates the WNT5A/β-catenin signaling pathway in K562 cells through miR-17-5p
3 讨论
HOTAIRM1是一种位于HOXA1和HOXA2之间的lncRNA,参与各种肿瘤的发生发展,包括胰腺导管腺癌、乳腺癌和急性髓性白血病(acute myelogenous leukemia,AML)等。据报道,与癌旁组织相比,HOTAIRM1在胰腺导管腺癌组织中高表达[11]。HOTAIRM1在他莫昔芬耐药乳腺癌MCF7细胞中上调,其通过介导雌激素受体+乳腺癌细胞中HOXA1的表达来促进他莫昔芬耐药[12]。HOTAIRM1的表达水平与AML患者的预后有关,HOTAIRM1的高表达与AML患者较短的总生存期、较短的无病生存期和较高的累积复发率显著相关[13]。CML患者的血清HOTAIRM1表达上调,且对于CML的诊断具有较高价值。进一步的细胞实验研究结果表明,HOTAIRM1的异常高表达诱导了K562细胞的增殖,增强了细胞的迁移和侵袭能力,沉默HOTAIRM1可抑制细胞增殖,降低细胞的迁移和侵袭能力。这些结果说明HOTAIRM1在CML中是一种致癌lncRNA,沉默HOTAIRM1可抑制CML的发生发展。
miR-17-5p是miR-17-92基因簇成员之一,在不同癌症中发挥致癌或抗癌作用。据报道,循环外泌体miR-17-5p可能是原发性和转移性结直肠癌的潜在预后生物标志物[13]。miR-17-5p的高表达与淋巴管浸润、远处转移、较高的临床分期、化学耐药有关[14]。miR-17-5p的过表达促进了人结肠癌细胞的侵袭性[15]。有研究表明,miR-17-5p在人乳腺肿瘤中低水平表达,可能作为抑癌基因起作用,miR-17-5p能通过抑制AIB1的翻译降低雌激素受体调节基因表达,抑制乳腺癌细胞增殖[16]。miR-17-5p可阻止乳腺癌细胞进入S期,从而抑制癌细胞的生长[17]。本研究显示,miR-17-5p在CML发病过程中异常降低,并且在诊断CML中具有较高价值。此外,miR-17-5p的低表达导致K562细胞增殖、迁移和侵袭能力增强,上述结果提示miR-17-5p可能在CML中充当抗癌miRNA。lncRNA主要通过与靶miRNA结合来发挥生物学作用,本课题组通过生物信息学软件预测miR-17-5p与HOTAIRM1存在结合位点,其他文献报道,miR-17-5p与HOTAIRM1内源性竞争结合并调节胃癌细胞的进程,包括细胞增殖、迁移、侵袭和凋亡[10]。本研究考察了HOTAIRM1与miR-17-5p之间的关系。结果表明,HOTAIRM1靶向抑制miR-17-5p,HOTAIRM1可充当抑制miR-106a-5p表达的分子海绵。此外,同时沉默K562细胞中HOTAIRM1和miR-17-5p可逆转沉默HOTAIRM1对K562细胞增殖、迁移和侵袭的影响,说明HOTAIRM1通过miR-17-5p调控K562细胞增殖、迁移和侵袭。
WNT/β-catenin信号通路的异常激活在肿瘤细胞的增殖、生长、细胞凋亡、耐药性等方面起着重要作用。据报道,靶向WNT/β-catenin信号通路的治疗方式可有效抑制癌细胞增殖及侵袭能力[18]。WNT5A/β-catenin信号通路在CML发生发展中具有重要作用。随着CML患者疾病的进展,β-catenin的表达明显升高,并且与伊马替尼疗效有关[19]。抑制WNT5A/β-catenin信号通路可抑制CML细胞增殖并促进细胞凋亡[20]。因此,以WNT/β-catenin信号传导通路为靶点,抑制CML中该通路的活化及其靶基因的表达有可能成为对CML治疗的新方向。本研究表明,miR-17-5p靶向调控WNT5A,而HOTAIRM1靶向抑制miR-17-5p,并且HOTAIRM1的异常高表达激活了K562细胞中的WNT5A/β-catenin信号通路。Zhou等[21]也报道了miR-17-5p对WNT/β-catenin信号通路的调控作用。本研究结果说明HOTAIRM1通过miR-17-5p调控K562细胞中WNT5A/β-catenin信号通路,沉默HOTAIRM1可能通过抑制WNT5A/β-catenin信号通路的激活从而发挥抗肿瘤作用。
综上所述,本研究结果表明CML患者血清HOTAIRM1水平异常升高,沉默HOTAIRM1可有效降低CML细胞系的增殖、迁移和侵袭能力。HOTAIRM1可能通过miR-17-5p/WNT5A/β-catenin信号通路来调节CML的生长和转移。HOTAIRM1有望成为CML的新型早期诊断标志物和新型治疗靶点,具有重要的临床价值和意义。
