废铁屑还原软锰矿制备工业级硫酸锰的优化研究
2023-01-14廖霆波梁万德赵金和
*廖霆波 梁万德 赵金和
(1.康龙化成杭州湾园区 浙江 315399 2.南方锰业集团有限责任公司大新锰矿分公司 广西 532315 3.百色学院 广西 533000)
引言
锰,第ⅦB族元素。在地壳中的含量达到了0.085%之多,低于铁的含量排在第二位。在地壳中,锰离子主要以矿物质的方式存在,目前已经开采出的锰矿物主要有:褐锰矿石,软锰矿石,锰氧化矿石,锰矿石和硬锰矿石等。在国内,探测到的锰矿产区约213处,其储备估计有5.66亿吨[1]。锰矿主要以软锰矿为主,且含锰量较低,主要为贫锰矿[2]且其中含有的杂质较多。硫酸锰在当今具有广大的用途,主要分为饲料级和工业级[2]。无论是在工业还是农业上都是不可或缺的存在。在无机工业生产中硫酸锰用于电解锰的产出和制取各种锰盐[3-4]。在涂料工业中主要生产催化剂和亚麻仁油酸锰等。在农业上是重要微量元素肥料[5]。添加适当硫酸锰能够促进植被的成长,提高产量,是不可或缺的微量元素肥料。在畜牧业和饲料业中,硫酸锰作为一种饲料的添加剂,能够促使畜类禽类的成长、增肥的作用。在电池、催化剂、分析试剂、添加剂、医药等方面,也有极广的使用空间[6]。
目前硫酸锰常见的制备方法有3种,各有利弊。其一是焙烧法[7],该方法是一个历史悠久的硫酸锰制备工艺,技术相对成熟,存在的缺陷也比较明显。传统的焙烧法使用煤作为还原剂进行焙烧,虽然这方法简单、易掌握、经济效益好但是带来的危害也很大,燃烧中产生大量的二氧化碳与二氧化硫等,污染环境,伤害身心健康,不符合新时代环保与绿色生产的理念。其二是运用软锰矿石粉末和铁矿石粉末在硫酸介质内反应制取工业硫酸锰[8-10]。该方法的优点在于不需要高温环境也不需要煅烧,降低了粉尘及有毒有害气体的污染。但是用铁矿来做还原剂还原软锰矿,由于硫铁矿矿石中含有的杂质也比较多,后期除杂有些繁琐。其三是用二氧化硫与二氧化锰直接氧化还原反应制备生产硫酸锰的工艺[11],该方法具有工艺流程简洁、耗能低、节省空间、对设备要求低、生产成本低等优点。但由于副反应会生成二硫酸锰,降低了硫酸锰的品质,难以生产高品位的硫酸锰。
1.试验部分
(1)试验试剂
氯化铵(成都金诚化学试剂有限公司,含量99.5%,分析纯);氟化铵(广东光华化学试剂有限公司,含量96.0%,分析纯);氨水(广东光华化学试剂有限公司提供,含量25.0%~28.0%,分析纯);六氰合铁(III)酸钾(广东光华化学试剂有限公司,有效成分含量99.5%,分析纯);亚铁氰化钾(广东光化学试剂份有限公司,含量99.0%,分析纯);硫酸钡(洒联化工有限公司,含量98.0%,分析纯)氢氧化钙(西域化工有限公司,含量99.0%,分析纯);氧化锌(天津市致远化学试剂有限公司,含量99.0%,分析纯);氯化氰氨(国药化学试剂有限公司,含量98.5%,分析纯);盐酸(成都科隆化学试剂有限公司,含量36.0%~38.0%,分析纯);硫酸(广州爱廉化学有限公司,含量95.0%~98.0%,分析纯);乙二胺四乙酸二钠(上海永成精细化工有限公司,含量99.0%,分析纯);铬黑T指示剂(广州光复精细化工有限公司,分析纯);硫化铵(上海大茂化学试剂有限公司,含量98.0%,分析纯);丁二酮肟(国药集团化学试剂有限公司,含量98.0%,分析纯);软锰矿(中信大锰矿业有限公司,低品位,约含36% MnO2)。
(2)试验仪器
PHs-3C型酸度计,上海化科实验器材公司PHS-25型数显PH计(上海仪电科学仪器有限公司);JA5003B型电子天平(上海越平科学仪器(苏州)制造有限公司);TWCL-T型磁力搅拌器(郑州哑荣仪器有限公司);TM-0620型陶瓷纤维马弗炉(盈安美诚科学仪器股份有限公司);THZ-80型恒温振荡器(上海国华电器股份有限公司)。
(3)主要试剂配制、标定
①配制0.1mol/L的EDTA标准滴定液:称量40.0g乙二胺四乙酸二钠放置在烧杯内,滴加适量蒸馏水,升温搅动直到固体完全溶解,等待其冷却到常温后转移到1000mL容量瓶中进行定容,摇匀以备后用。采用ZnO为标准试剂,氨水-氯化铵为缓冲体系,以铬黑T标准指示剂,间接滴定标定EDTA的浓度,做空白实验[12-14]。标定结果如表1所示。
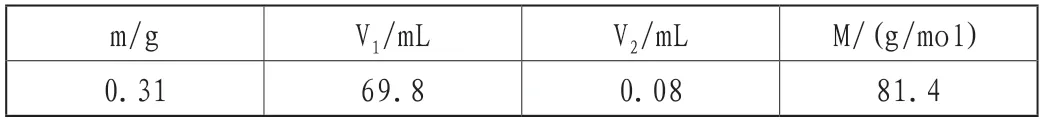
表1 EDTA的标定实验数据记录表
计算乙二胺四乙酸二钠标准滴定溶液的精确浓度为0.052mol/L。
②配制pH=10的氨-氯化铵缓冲液:精准称量54g的氟化铵,滴加适量蒸馏水溶解,移取350mL浓氨水加入其中,搅动均匀后转移到1000mL容量瓶中进行定容,摇匀以备后用,用pH计测量溶液的pH值。
(4)实验操作过程及检测方法
整个实验操作可以分为两个主要阶段。
①制备阶段:取用一定量的软锰矿,向其加入稀硫酸溶液,加热反应。该阶段主要反应可用离子反应方程式表示如下:
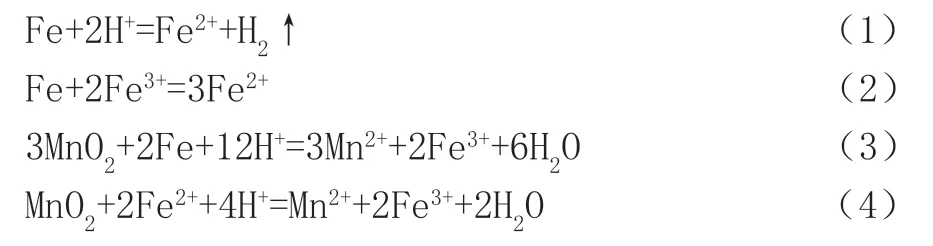
②除杂纯化阶段
实验主要运用了分步沉淀法,单一变量法,溶度积规则等一系列所学的基础化学理论知识来除杂制备优化工业硫酸锰。
向制备阶段得到的溶液依次加入氢氧化钙、硫化铵、试剂,以除去软锰矿中的其他金属离子,制备工业级硫酸锰。
③浸出液硫酸锰的百分含量的检测[15]
精准称量0.2g含硫酸锰的固体样品到250mL锥形瓶内,加入200mL左右的蒸馏水稀释,分别加入0.50g的盐酸羟胺和3.0g的氟化铵掩蔽剂,沸水浴加热至60℃左右搅拌溶解。再添加20mL的氨-氯化铵和5滴铬黑T指示剂,搅拌均匀,此时溶液呈紫红色,用标定好的EDTA标准溶液进行滴定,到达滴定终点时溶液由紫红色变成浅蓝色(确保滴定温度在60℃±3℃之间),记录EDTA标准溶液的用量,重复做三次取平均值,最后将硫酸锰溶液至于90℃的干燥箱中进行干燥,最后称量剩余固体的质量。
计算硫酸锰的百分比含量公式为:

式中:
C为EDTA标准溶液计算出的精确浓度,mol/L;
V为滴定过程中消耗的EDTA的体积,mL;
m为干燥后固体的质量,mg。
2.结果与讨论
(1)铁与二氧化锰的物质的量之比对Mn2+的浸出率的影响
由方程式(3)可知,在理想条件下不考虑其他副反应,3mol的二氧化锰可和2mol的铁完全反应,其理论值为3:2,约为1:0.667。所以探究其为1:0.5,1:0.6,1:0.7,1:0.8,1:0.9,1:1时的浸出液硫酸锰百分含量在何比值时达到最大。
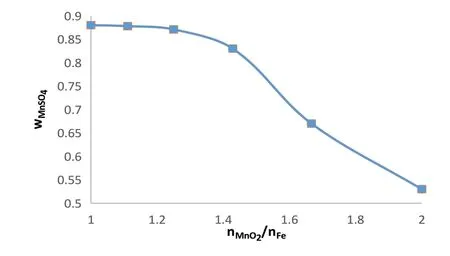
图1 :nFe的物质的量之比的影响
由图能够得出,浸出液硫酸锰百分含量与铁的加入量成正比,当二氧化锰与铁的比例在1:0.7~1:0.8之间时,浸出液硫酸锰百分含量到达较大值,当铁的含量再增加时,浸出液硫酸锰百分含量变化不明显。为了探究精准的比例,在铁的比例为0.7到0.8之间细分为四组,分别为nMnO2:nFe=1:0.72;1:0.74;1:0.76;1:0.78进行浸出实验,软锰矿依旧为5.70g,铁粉的量为0.936g、0.962g、0.988g、1.014g(误差在±0.005g),实验结果如图2所示。
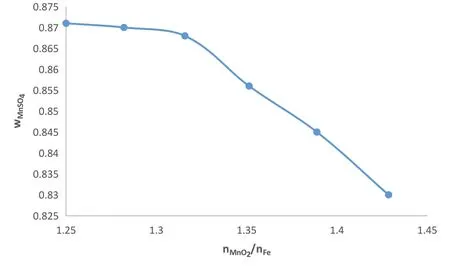
图2 nMnO2:nFe的物质的量之比的影响
如图所示,当nMnO2:nFe为1:0.76左右时,浸出液硫酸锰百分含量增长最大,超过这一数值时增长率增长得较缓慢,初步确定当了nMnO2:nFe为1:0.76。与理论值相接近,但由于发生了(1)反应,所以加入铁的量会略微比理论值大。
(2)硫酸用量对浸出液硫酸锰百分含量的影响
实验条件:nMnO2:nFe为1:0.76,温度,搅拌时间同上。
由反应式(4)可得nMnO2:nH2SO4的理论值为1:2,分别检测nMnO2:nH2SO4为1:1.8;1:1.9;1:2.0;1:2.1;1:2.2时的浸出液硫酸锰百分含量;称取0.05mol的二氧化锰约需要5.70g的软锰矿。精确移取4.96mL、5.17mL、5.44mL、5.71mL、5.98mL的浓硫酸配制成1000mL的溶液。分别移取150mL配制好的硫酸溶液加入等比例混合的软锰矿和铁粉中,加热搅拌一定时间。实验结果如图3所示。
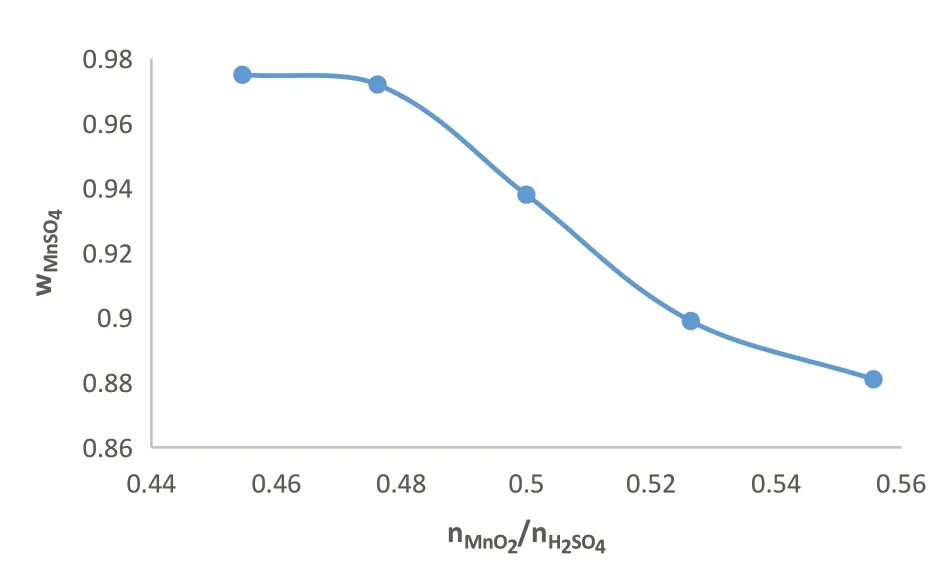
图3 nMnO2:nH2SO4的物质的量之比的影响
如图所示,干燥后固体中硫酸锰百分含量随nH2SO4的增大而增大,当nMnO2:nH2SO4的比为1:2.1时,该含量达到了97%此后不再增加,说明此时软锰矿中的锰已完全转移到溶液中。工业生产中,反应时间和反应温度对浸出液硫酸锰百分含量也有一定影响。
(3)反应温度对浸出液硫酸锰百分含量的影响
在以上得到的最优条件下,即在在nMnO2:nFe:nH2SO4=1:0.76:2.1的条件下,在水浴摇床中分别设置40℃、50℃、60℃、70℃、80℃下让混合物反应一定时间,然后取出放置2h冷却,实验结果见图4。
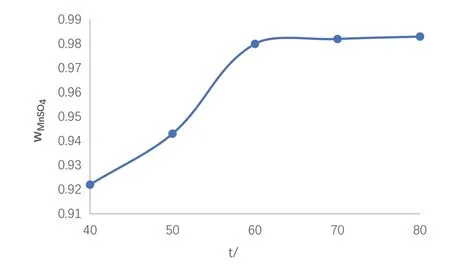
图4 反应温度的影响
由数据可以得出,当温度在40℃~70℃之间时,浸出液硫酸锰百分含量增长率达最大,超过这一温度时浸出率变化不明显。40℃~70℃之间,该反应属于吸热反应,高温对体系的转变,对硫酸锰的生成是有利的。
(4)反应时长对浸出液硫酸锰百分含量的影响
在以上得到的最优条件下,在nMnO2:nFe:nH2SO4=1:0.76:2.1反应温度在55℃的条件下配制好,在水浴摇床中分别反应45min、60min、75min、90min,然后取出放置冷却2h,实验结果见图5。
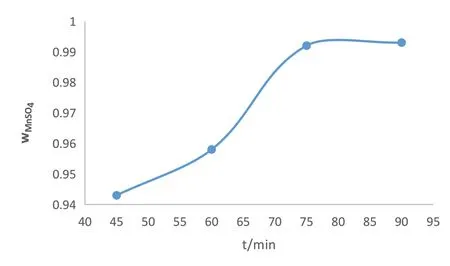
图5 反应时长的影响
由以上数据可说明,浸出液硫酸锰百分含量主要受到铁的量和硫酸的量影响且为正比关系,但到达一定比例时增长得很缓慢或者不增长了,改变反应温度和反应时间也会稍微提升浸出液硫酸锰百分含量,这说明反应的温度,反应的时长也会影响浸出液硫酸锰百分含量,属于次要影响。
最终实验结果表明,当nMnO2:nFe:nH2SO4=1:0.76:2.1,反应温度65℃,反应温度75min时浸出液硫酸锰百分含量达到了98.0%以上。与理论值相接近,由于发生了公式(1)和(2)反应且其中含有杂质的影响,所以实际值会比理论值略大一些。
(5)除杂
在nMnO2:nFe:nH2SO4=1:0.76:2.1,在温度为65℃,时间为75min的条件下,制备硫酸锰溶液,等待其冷却到常温后,将溶液里的不溶性杂质过滤掉后备用。
①铁、镁离子的去除nMnO2:nFe:nH2SO4
移取20mL的硫酸锰溶液,首先检测亚铁离子是否完全被氧化成为三价铁,滴加0.05ml/L的铁氰化钾溶液,硫酸锰溶液稍微变蓝,证明溶液中含有二价铁离子。向硫酸锰溶液内滴加小量的双氧水,使溶液中没反应完的二价铁离子氧化为三价铁离子,用0.1mol/L的氢氧化钙溶液调节pH值。当溶液pH达到铁铝离子的最小沉淀pH值时,溶液会产生深绿色的絮状沉淀生成,继续加入氢氧化钙溶液,用pH测量计检测pH值,直到pH=5.0~6.0之间时,轻微搅拌,等待一段时间使铁离子铝离子完全水解,过滤掉其中的沉淀。
移取20mL硫酸锰溶液,检测铁离子。向硫酸锰溶液内滴加0.05ml/L的亚铁氰化钾溶液,硫酸锰溶液无颜色变化,证明三价铁离子已经除尽。
②铜、镍、钴、铅离子的去除
硫酸锰溶液中降除重金属的方法一般采用硫化剂,利用其中的硫离子与重金属离子结合生成硫化物沉淀过滤去除。此次实验选用的硫化剂为硫化铵,通过计算,确定硫化铵的浓度取值范围:1.4×10-19~2.5×10-8之间。为了能将杂质除干净且减少锰的损失,所以取临界值2.5×10-8作为硫化铵沉淀剂的配制浓度。
用丁二酮肟试剂[16]验硫酸锰溶液里的重金属离子是否除尽,当硫酸锰溶液无赤红色呈现时即加进去的硫化铵已足量,反应到达终点。
③钙、镁等离子的去除
通常的钙、镁降除办法是加入氟化剂使钙镁离子生成沉淀除去[17],实验采用氟化铵,多余的铵离子,加入微量的氢氧化锰除去。
除杂后,将硫酸锰溶液置于90℃的烘烤箱里进行烘干[18]称重得到1.992g的一水硫酸锰固体,理论上5.7g的软锰矿应得到3.98g的一水硫酸锰固体,其产率约为49.98%。
3.结论
使用废铁/铁屑还原软锰矿制备工业级硫酸锰在实验室是可行的,整个实验过程操作较为常见、简单、所用药品较为绿色环保。该法的最优实验条件是nMnO2:nFe:nH2SO4为1:0.76:2.1,反应温度约为65℃,反应时间为75min,在此最优条件下,锰的浸出率为49.98%,产品中硫酸锰百分含量达99%以上,符合工业应用标准。该法制备工业级硫酸锰,对于那些有富余废铁/铁屑或废硫酸的地区和单位,有一定参考价值,锰回收率的提高有待进一步研究。
