不同光质对球等鞭金藻岩藻黄素及脂肪酸含量的影响
2023-01-13林港华韩玉莹李龙玉代容春林荣华陈建楠陈由强余雪兵
林港华,李 欢,韩玉莹,薛 婷,李龙玉,代容春,林荣华,陈建楠,陈由强,余雪兵
(1.福建师范大学生命科学学院, 福建 福州 350117;2.福建师范大学南方海洋研究院, 福建 福州 350117)
海洋微藻能够生物合成多种高价值代谢产物,如生理活性物质岩藻黄素、多不饱和脂肪酸等,在生物能源、药品、化妆品或营养领域中备受欢迎。球等鞭金藻Isochrysisgalbana是一种单细胞微藻[1],它在生长过程中能够生产岩藻黄素及二十二碳六烯酸(DHA)等多不饱和脂肪酸,因此被应用于营养保健领域、燃料及水产养殖领域,成为生物能源。岩藻黄素是最丰富但几乎未开发的类胡萝卜素资源,能够参与植物细胞叶绿体光合作用并具有广泛的生物活性和健康益处(如抗炎、抗氧化、抗肿瘤、抗肥胖和抗糖尿病等多种生理活性)[2]。DHA是一种长链多不饱和脂肪酸,对于新生婴儿大脑和视网膜发育中有着不可或缺的作用,另外DHA还具有抗血栓形成、降血压、抗动脉粥样硬化和抗纤维化作用[3]。
近年来较多学者使用基因工程和分子生物学的方法提高微藻产量以富集其高价值产物的含量[5],同时还研究了控制其培养条件(例如光的可用性)来提高其生理活性物质[6]。光质作为影响微藻生长代谢的最重要光环境因素之一,藻种的差异对不同光质的响应有较大的差异[7]。BOROWAIK等[8]通过调节红光、蓝光及白光的比例控制雨生红球藻的生长及实现虾青素的高效生产;DUARTE等[9]发现蓝光可以促进小球藻的细胞生长及类胡萝卜素的积累;KIM等[10]也证明了蓝光是促进微藻细胞生长的有效刺激因子,油脂积累也可通过蓝光刺激来提高;DHA含量的提高可通过蓝光与白光同时照射实现[11-13]。然而,LATSOS等[14]研究发现与蓝光相比,隐藻在绿光培养下更有利于生长;MOHSENPOUR等[15]表明红光不利于蓝藻生长,绿光促进其生长。大多数学者的研究集中于红光及蓝光,绿光及单色光质对球等鞭金藻生长及代谢调控却鲜有报道。
因此,本研究以球等鞭金藻为研究对象,探究不同光质对球等鞭金藻生长、岩藻黄素及脂肪酸含量的影响,以期为球等鞭金藻的最适生长条件、岩藻黄素及DHA积累提供最佳试验条件依据,同时研究结果为光质影响球等鞭金藻的岩藻黄素及脂肪酸代谢途径提供一定的参考价值。
1 材料与方法
1.1 试验材料
藻种来源:球等鞭金藻来源于本实验室保种。本研究中所使用的岩藻黄素、C8-C22及DHA脂肪酸标准品购买于SIGMA-ALDRICH公司,甲醇、正己烷等均为色谱纯(购自麦克林公司),甲苯、氯仿等均为分析纯(购自国药集团化学试剂有限公司)。
1.2 藻种培养
球等鞭金藻于白光下培养至对数期,以1∶10的接种比例接种至新配制的液体f/2培养基。试验组为红光、绿光、蓝光培养组,培养期间分别置于红光、绿光、蓝光光质培养箱内,光暗比12 h∶12 h,光照强度63 μmol·m-2·s-1,温度(20±1)℃。每天摇瓶2次。白光培养组作为对照组,放置于白光培养箱内。其他培养条件同上,每3 d进行1次取样。
1.3 细胞数测定
取1 mL对照组和试验组的藻液,利用细胞计数仪进行藻细胞数的测定。
1.4 干细胞重量测定
微藻生物量的提取方法根据BESSON等[35]提出的方法改进。称取10 mL离心管备用。取180 mL藻液离心,用蒸馏水洗涤2次将藻泥转移至备用的10 mL离心管中,放入-80℃冰箱中冷冻,放入真空冷冻干燥机中48 h,使藻泥充分干燥,测定其干细胞重量。
1.5 岩藻黄素含量测定
本试验以甲醇作为提取岩藻黄素的溶剂。将1 mL甲醇、1颗钢珠(直径为3 mm)加入已冷冻干燥的藻细胞中,放入研磨仪,设定研磨频率55 Hz,研磨时间180 s。研磨完成后,于黑暗条件下静置,15~20 min上下颠倒1次,共颠倒3次,保证岩藻黄素充分浸出。静置结束后8 000 r·min-1,离心10 min,取上清液过膜后注入液相进样瓶,用于高效液相色谱仪(HPLC)检测[16]。
1.6 脂肪酸含量测定
配置氯仿∶甲醇(V∶V=2∶1)溶液,向已冷冻干燥的藻细胞加入2 mL氯仿:甲醇溶液,置于研磨仪中,55 Hz研磨180 s。研磨完成后,8 000 r·min-1离心5 min,转移上清至新的离心管中,立即用氮吹仪吹干。将样品进行甲酯化处理:加入1 mL甲苯进行溶解,随即加入200 μL的1 mg·mL-1BHT防止油脂氧化,加入2 mL乙酰氯:甲醇溶液(V∶V=1∶10),50℃水浴过夜,加入1 mL正己烷溶液(含有1 mg·mL-1十九酸甲酯),震动混匀后静置分层,取上层溶液过膜,注入进样瓶,进行气相色谱仪(GC)检测[17]。
1.7 数据分析
采用IBM SPSS 26进行单因素方差分析,Excel绘图。所有试验均重复进行3次。
2 结果与分析
2.1 不同光质对球等鞭金藻细胞数的影响
由图1可知,第3 d时蓝光培养组球等鞭金藻的细胞数与白光培养组(CK)相差不显著,第6 d后蓝光培养组的细胞数均显著性高于白光培养组(CK),最大值为4.07×106个·mL-1,而红光培养组的细胞数与白光培养组(CK)相差不显著。绿光培养组的球等鞭金藻细胞数于第15 d 达到最大值2.54×106个·mL-1,显著低于白光培养组(CK)。
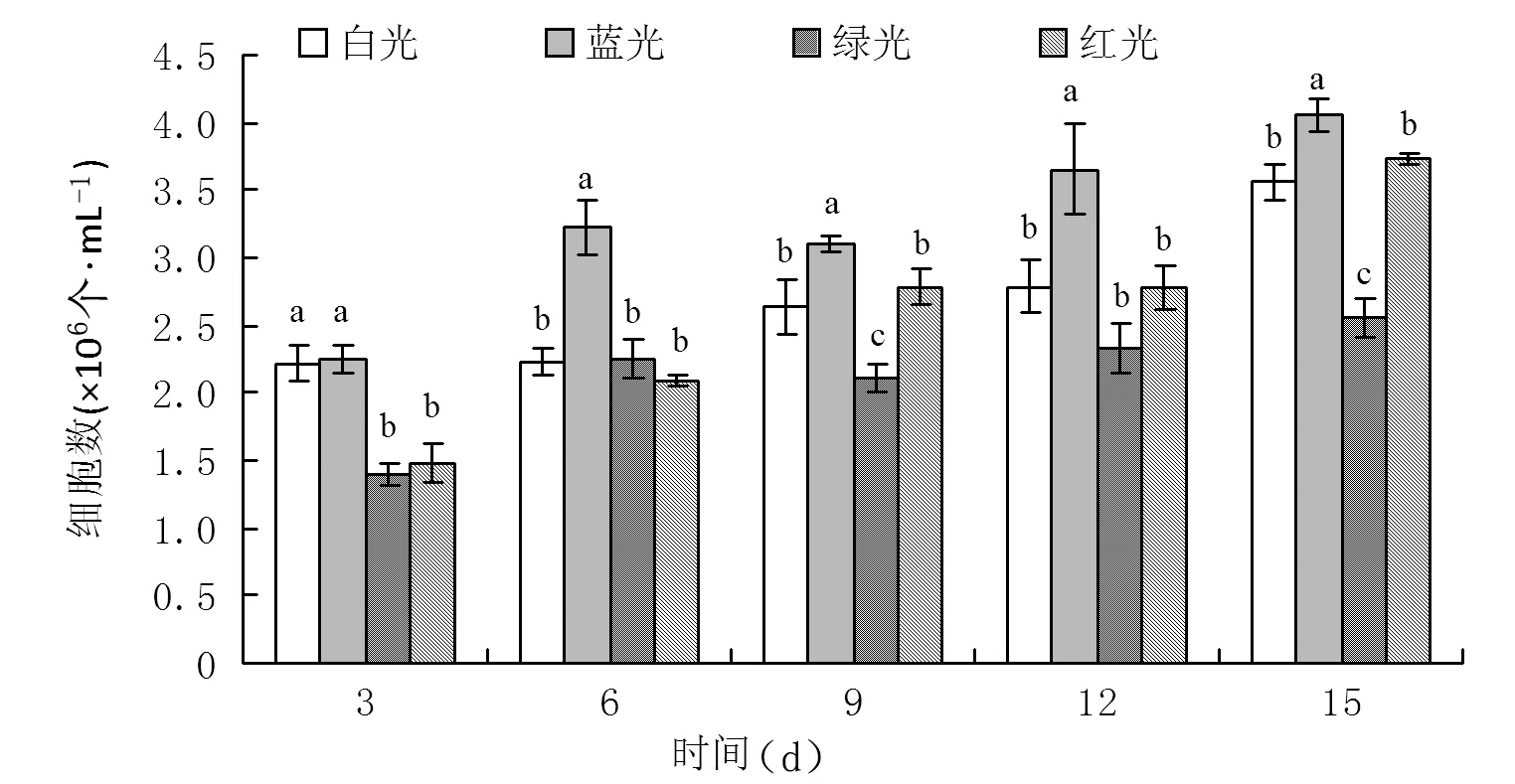
注:不同字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05);下图同图1 球等鞭金藻在不同光质培养下的细胞数Fig.1 Cell number of Isochrysis galbana cultivated in different light qualities
2.2 不同光质对球等鞭金藻干细胞重量的影响
由图2可知,白光、蓝光、绿光和红光培养组的球等鞭金藻最大干细胞重量分别为0.15、0.13、0.10和0.14 g·L-1。其中,在绿光、红光培养组第9 d的干细胞重量显著低于白光培养组(CK)。

图2 球等鞭金藻在不同光质培养下的干细胞重量Fig.2 Stem cell weight of Isochrysis galbana cultivated in different light qualities
2.3 不同光质对球等鞭金藻岩藻黄素含量的影响
由图3可知,球等鞭金藻中岩藻黄素的含量随着培养时间的延长而增加。在4种光质培养下,最高岩藻黄素的含量表现为:蓝光>白光>绿光>红光。蓝光培养组中最高岩藻黄素的含量为白光培养组(CK)的1.23倍(4.51 mg·L-1),绿光、红光培养组低于白光培养组(CK),最高岩藻黄素含量分别为:3.17、2.68 mg·L-1。

图3 球等鞭金藻在不同光质培养下的岩藻黄素含量Fig.3 Fucoxanthin content of Isochrysis galbana cultivated in different light qualities
2.4 不同光质对球等鞭金藻脂肪酸含量的影响
由图4可知,白光培养组的球等鞭金藻脂肪酸含量随着时间而增加,蓝光培养组的脂肪酸含量在第12 d达到最高,绿光、红光培养组的脂肪酸含量在第3、6、9和12 d显著高于白光培养组(CK),并于第12 d达到顶峰,最大值分别为16.31、17.05 mg·L-1。

图4 球等鞭金藻在不同光质培养下的脂肪酸含量Fig.4 Fatty acid content of Isochrysis galbana cultivated in different light qualities
2.5 不同光质对球等鞭金藻脂肪酸组分及含量的影响
由图5可知,球等鞭金藻在白光培养组(CK)下检测到8种脂肪酸组分,分别为肉豆蔻酸(C14∶0)、棕榈酸(C16∶0)、棕榈油酸(C16∶1)、硬脂酸(C18∶0)、油酸(C18∶1)、亚油酸(C18∶2)、亚麻酸(C18∶3)和DHA,其中C18∶0含量随着时间延长而降低。而C16∶1、C18∶1、C18∶2、C18∶3和DHA的含量随着时间的延长而增加。在绿光、红光培养组中,同样也鉴定出了8种脂肪酸,其脂肪酸的成分含量变化规律与白光培养组(CK)相似。

图5 球等鞭金藻在不同光质培养下的各脂肪酸百分含量Fig.5 Percentage content of each fatty acid in Isochrysis galbana cultivated in different light qualities
与其他3种光质处理不同的是:蓝光培养组中的球等鞭金藻鉴定出了9种脂肪酸成分,分别为C14∶0、C16∶0、C16∶1、C18∶0、C18∶1、C18∶2、C18∶3、C22:1和DHA,其中C18∶2、C18∶3、C22∶1和DHA含量随着培养时间的延长而增加,C16∶0与C18∶0含量随着时间延长而降低。蓝光培养组中获得最高含量的DHA和C18∶3,这表明在蓝光培养下,球等鞭金藻中的油脂向不饱和脂肪酸及长链脂肪酸方向合成。
2.6 不同光质对球等鞭金藻DHA含量的影响
由图6可知,白光、蓝光和红光培养组的DHA含量变化都呈现出一种趋势,即随着培养时间的延长而升高,均在第15 d含量达到最大。白光、蓝光、绿光和红光培养组的最高DHA含量分别为0.53、0.58、0.42和0.50 mg·L-1。绿光培养组中第3、6 d的DHA含量显著高于白光培养组(CK);红光培养组第3、6和9d的DHA含量显著高于白光培养组(CK);蓝光培养组的DHA含量始终高于白光培养组(CK)。

图6 球等鞭金藻在不同光质培养下的DHA含量Fig.6 DHA content of Isochrysis galbana cultivated in different light qualities
3 结论与讨论
微藻中拥有不同的光感受器,它们对特定的光质产生反应,导致不同的光合作用和光诱导行为[18]。本试验探究了4种不同的光质(白光、蓝光、绿光和红光)对球等鞭金藻岩藻黄素和脂肪酸含量的影响。球等鞭金藻在蓝光培养组的细胞数始终高于白光培养组(CK),红光培养组次之。球等鞭金藻最大干细胞重量表现为白光>红光>蓝光>绿光。SIRISUK等[19]表明蓝光培养下微藻细胞数上升;MIKI等[20]同样证明了蓝光对Sargassumpatens等大型藻类有显著促进生长的作用;KUWANO等[22]以单色光培养Ulvacompressa,发现仅在红光或绿光照射下的藻细胞生长速率显著下降。王祎哲等[23]报道蓝光培养下的纤细裸藻的细胞数最高,绿光最低。孙建瑞等[24]观察到Chlamydomonassp.在蓝光下的生物量积累达到最大,而红光下最低;尹继龙等[21]发现小球藻在蓝光培养下利于其生物量的积累。这可能是由于蓝光具有更高的光合电子传输率,从而提高藻细胞的光合性能,进而提高藻细胞内非结构性碳水化合物的含量,为球等鞭金藻的生长提供更多的碳源。
不同光质对高价值化合物的生产率有着重大影响。在本试验中,4种光质培养下球等鞭金藻的岩藻黄素最大含量均在第15 d达到最大值,其中蓝光>白光>绿光>红光。蓝光培养组的岩藻黄素最高含量可达白光培养组(CK)的1.23倍。红光培养组的脂肪酸含量最高,绿光培养组次之。DHA含量随着培养时间的延长逐渐增加,其中蓝光培养组的DHA含量最高。研究人员[25-27]表明,在海洋环境中,短波光是底栖生物可获得的主要光质,并且目前已经发现微藻具有能够接受蓝光的光感受器。蓝光感受器不仅可以增强微藻细胞对蓝光的吸收能力,而且还能够参与生物生命节律调节及捕光色素合成等重要生物过程,对微藻生长及相关代谢活动产生重要影响[28-30]。LOREDO等[31]研究表明蓝光利于三角褐指藻中岩藻黄素的积累,并且在其他微藻中也观察到了这样的现象[32];PARKES等[33]发现Stauroneissp在蓝光培养组中的岩藻黄素含量最高,红光培养组最低,与本实验结果相符;SUN等[34]探究光质对Crypthecodiniumsp脂肪酸和DHA含量的影响,结果表明白光和绿光可提高其脂肪酸含量,红光能够诱导脂肪酸积累,而蓝光对脂肪酸的积累无明显影响;SAAVEDRA等[36]发现蓝光培养组中Tisochrysislutea的DHA含量上升。本试验中蓝光培养组的DHA含量始终高于白光培养组(CK)。目前,球等鞭金藻如何接受特定光质的信号,并且通过何种途径影响藻细胞内岩藻黄素及脂肪酸的合成有待进一步揭示。
综上所述,蓝光培养组的细胞数、岩藻黄素和DHA含量始终高于其他3种光质,红光促进藻细胞脂肪酸的积累,白光培养组获得藻细胞的干细胞重量最大。这些结果可为我们深入探究光质对球等鞭金藻光合作用,岩藻黄素和脂肪酸积累等差异性的机理提供科学参考。
