消肿止痛合剂对大鼠皮瓣缺血再灌注损伤及p38MAPK-PPARγ/NF-κB信号通路的影响
2023-01-11王海刚何志军梁旭东何元旭沈稼轩张团庄
宋 渊 ,王海刚 ,何志军 ,刘 涛 ,梁旭东 ,何元旭 ,沈稼轩,张团庄
(1.甘肃省中医院手外二科,甘肃兰州 730050;2.甘肃中医药大学中医临床学院,甘肃兰州 730030;3.甘肃省中医院足踝外科,甘肃兰州 730050)
皮瓣移植技术作为显微外科及骨科领域的重要技术,已被广泛应用于整形外科等其他特殊领域。但皮瓣移植术后经常发生皮瓣坏死,有临床报道坏死率高达10%~15%[1]。皮瓣的缺血再灌注损伤(ischemia/reperfusion,I/R)是指缺血组织重新开放血流时,组织的缺血状态不但没有改善,损伤反而加重的现象[2]。目前发现的与皮瓣缺血再灌注损伤相关的信号通路主要有p38MAPK、JNK、ERK、PI3K、PPARγ、NF-κB信号通路,p38MAPK、JNK、ERK都属于MAPKs的亚类[3],其中p38MAPK信号通路被细胞内各种环境刺激及炎性刺激所激活,在皮瓣缺血再灌注损伤过程中发挥着重要作用[4-5]。
现代医学主要通过促进组织微血管再生、减轻组织炎症反应以及抑制细胞凋亡等手段来提高皮瓣存活率[6-7]。但是中医药因其多中心、多靶点的作用,对治疗皮瓣缺血再灌注损伤具有独特的优势。课题组前期研究发现,消肿止痛合剂可明显降低软组织白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)等炎症因子的表达水平,在一定程度上阻止外伤后炎症介质的释放[8]。本研究应用消肿止痛合剂,借助分子生物学技术,探讨皮瓣缺血再灌注损伤过程中p38MAPKPPARγ/NF-κB信号通路的作用机制,以期为活血化瘀类中药治疗皮瓣缺血再灌注损伤提供新的思路和方法。
1 材料与方法
1.1 材料
1.1.1 实验动物 选用SPF 级SD 大鼠180只,雌雄各半,体质量为200~220 g,由甘肃中医药大学实验动物中心提供,分笼饲养,饲养温度控制在24~26℃,湿度控制在45%~60%,定期进行实验室消毒,光照为12 h光照、12 h黑暗昼夜交替循环,进行为期1周的适应性饲养。动物合格证编号:No.62001000 000533;实验动物使用许可证号:SYXK(甘)2020-0009;实验动物生产许可证号:SCXK(甘)2020-0001。甘肃中医药大学实验动物伦理审查委员会批准文号:2020-287。
1.1.2 主要试剂 消肿止痛合剂由甘肃省中医院制剂中心提供(批准文号:甘药制字Z04 000844;生产批号:20200804);SB203580(批 号:HY-10256)、GW9662(批号:HY-16578)、PDTC(批号:HY-18738)均购自MCE(中国上海)皓元生物科技有限公司;苏木素染液(批号:CR2011040)、伊红染液(批号:CR2012206)均购自上海碧云天生物技术有限公司;PCR扩增试剂(批号:A2A1652)、反转录试剂盒(批号:A2A1186)均购自上海依可赛公司。
1.2 方法
1.2.1 实验分组 采用随机数字表进行随机分组,将180只大鼠按体质量编号后随机分为6 组,A 组(模型对照组)、B组(假手术组)、C组(消肿止痛合剂组)、D 组(p38MAPK 抑制剂组)、E 组(PPARγ抑制剂组)、F组(NF-κB抑制剂组),每组各30只。
1.2.2 动物造模 术前灌胃及注射信号通路阻断剂,消肿止痛合剂组、p38MAPK 抑制剂组、PPARγ抑制剂组、NF-κB 抑制剂组给予消肿止痛合剂灌胃(100 g/m L),模型对照组、假手术组以同体积0.9%氯化钠注射液灌胃;各组右下腹腔注射,p38MAPK 抑制剂组以SB203580(1.5 mg/100 g)注射,PPARγ抑制剂组GW9662(0.2 mg/100 g)注射,NF-κB抑制剂组以PDTC(10 mg/100 g)注射。设计皮瓣大小为8 cm×2 cm 矩形随意皮瓣,皮瓣蒂位于尾端双侧髂嵴连线上,皮瓣纵轴与大鼠长轴平行,左右对称,沿设计画线行皮瓣手术,除假手术组外其余各组均行皮瓣缺血处理(皮瓣手术+夹闭血管蒂)。
1.2.3 动物取材 在术后1 h、24 h、7 d,随机将大鼠麻醉后,切取皮瓣取出置于-80℃冰箱中保存待用。
1.2.4 术后形态学观察及皮瓣存活面积 分别在术后1 d、3 d、7 d三个时相观察各组大鼠背部皮瓣的大体形态并采集图像,将采集到的照片输入到图像分析系统(Image-Pro Plus.V6.0)进行分析并计算皮瓣存活率,皮瓣坏死标准为:皮瓣表面痂皮形成、颜色变黑、质地变硬、无弹性。皮瓣存活率的计算公式如下:
皮瓣存活率(%)=皮瓣存活面积/皮瓣总面积×100%。
1.2.5 HE染色 将制作好的石蜡切片依次进行脱蜡、冲洗、切片水化,苏木素、伊红染色后的切片依次进入75%、80%、95%、100%的乙醇中各5 min进行切片脱水,再依次放入二甲苯一号、二甲苯二号各5 min进行切片透明,显微镜下观察并采集图像信息。
1.2.6 TUNEL 染色 同上述步骤制作石蜡切片,脱蜡、脱水,晾干后使用胰蛋白酶K 试剂处理切片,将反应液滴加至切片上,盖玻片后固定后放置于湿盒内,保持湿盒内一定湿度,置于37℃恒温箱中孵育1 h,PBS洗涤,DAB 染色切片,苏木素复染,将染色后的切片依次进入75%、80%、95%、100%的乙醇中各5 min进行切片脱水,再依次放入二甲苯一号、二甲苯二号各5 min进行切片透明,中性树胶封片,显微镜下观察细胞并采集图像信息。
1.2.7 qRT-PCR 检测 将-80℃保存待用的皮瓣组织加入裂解液裂解,然后将裂解液转移到1.5 mL去酶的EP管内,在EP管内依次加入氯仿及异丙醇,4℃环境下置于离心机离心15 min(12 000 r/min)后,弃去上清液,保留沉淀,待沉淀干燥后向管内加入不含RNA 酶的水进行溶解,保存于-80℃低温冰箱。逆转录合成m RNA,加入反转录试剂充分混匀。PCR反应按照Takara Prime Ex TaqTMⅡPCR 试剂盒说明书进行操作,PCR 条件:95℃预变性30 s;95℃变性5 s,60℃退火,40个循环,每个循环31 s,最后进行溶解。PCR 引物由湖南艾科瑞生物工程有限公司提供,引物序列见表1。

表1 PCR 引物序列Tab.1 PCR sequence primers
1.3 统计学分析
采用SPSS 25.0软件进行统计分析,数据中所有的计量资料以()表示,采用单因素方差分析进行组间比较。若方差齐符合正态分布,采用Levene’s进行组间多重比较;若方差不齐,不符合正态分布,采用Dunnett-T3进行组间多重比较。符合正态分布的计量资料两组间的比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠形态学观察(图1)

图1 各组大鼠术后1 d、3 d、7 d皮瓣形态观察Fig.1 Observation of flap morphology on day 1,day 3,and day 7 after operation in each group
术后1 d:各组大鼠均存活,无死亡,麻醉剂效果逐渐消失,大鼠渐渐苏醒,各组大鼠均未见进食进水,皮瓣皮温较周围皮肤温度较低,皮瓣边缘见淤血肿胀,伤口未愈合,无出血及渗出,未观察到皮瓣明显坏死,各组间大鼠形态无明显异常。
术后3 d:各组大鼠全部苏醒且恢复饮食,B组大鼠较A 组、C组、D 组、E组、F组大鼠活跃,且进食进水量较多,皮瓣边缘未观察到明显的出血及渗出,各组大鼠肿胀较前均有消退,A 组和E 组大鼠皮瓣远端有少量坏死,其余各组大鼠触压皮瓣弹性良好,表面无黑色痂皮形成,判断无皮瓣坏死现象。
术后7 d:各组大鼠活动迅速,进食、进水量恢复正常,皮瓣存活部分与坏死部分界限清楚,皮瓣成活区域毛发的生长状况良好,皮瓣色泽红润,皮温正常,而坏死区域则见黑色痂皮形成,皮瓣皮肤失去弹性,皮温低于周围组织。A组皮瓣坏死面积最大,B组存活皮瓣面积最大,A组和E组大鼠皮瓣坏死面积明显大于其他组,D组和F组大鼠皮瓣存活面积无明显区别。
2.2 各组大鼠皮瓣存活率的比较
在术后1 d、3 d、7 d分别统计各组大鼠的皮瓣存活面积并计算皮瓣存活率(表2)。术后1 d,各组大鼠皮瓣存活面积无统计学差异(P>0.05)。术后3 d,与A 组比较,B组及F组大鼠皮瓣存活率明显较高,而E组大鼠皮瓣存活率明显较低(P<0.05);与B组相比,A组和E组大鼠皮瓣存活率明显较低(P<0.05)。术后7d,与A组相比,B组、C组、D组、F组大鼠皮瓣存活率均明显较高(P<0.05),但与E组差异无统计学意义(P>0.05);与B组相比,A 组、E 组大鼠皮瓣存活率均明显较低(P<0.05)。
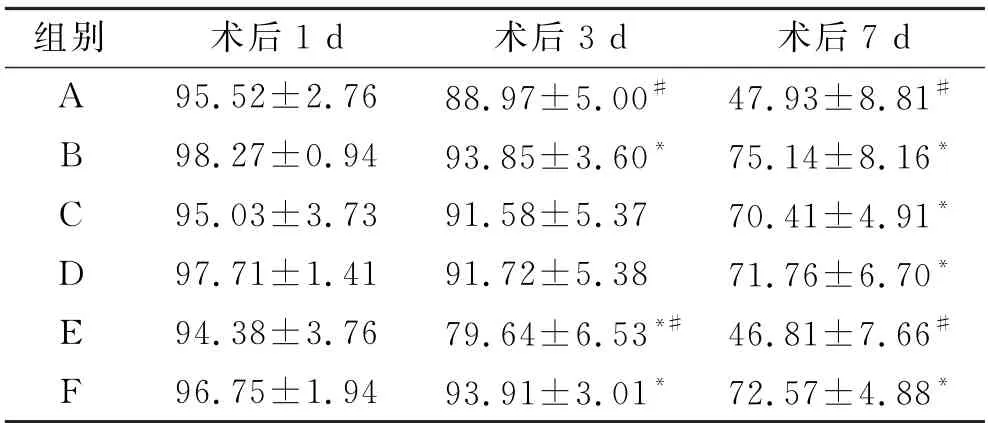
表2 术后1 d、3 d、7 d 6组大鼠皮瓣平均存活率Tab.2 The average survival rate(%)of flaps in six groups 1,3 and 7 days after operation (%,n=30)
2.3 大鼠皮瓣HE染色的观察结果(图2)
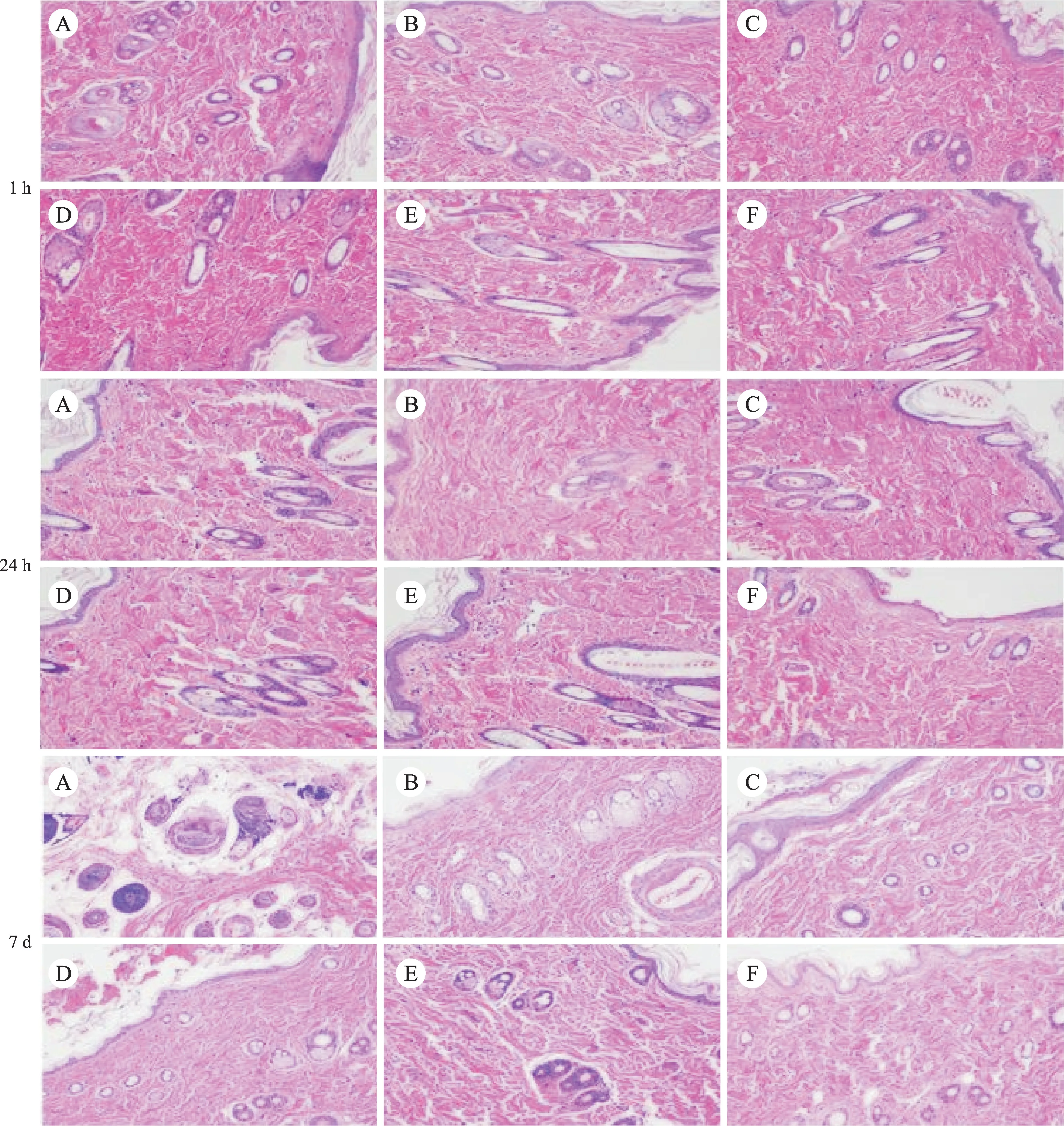
图2 各组大鼠术后1 h/24 h/7 d皮瓣组织HE染色切片示例图(×200倍)Fig.2 Sample diagram of HE stained section of skin flap in each group 1 h/24 h/7 d after operation(×200 times)
术后1 h:各组大鼠皮瓣组织结构排列整齐,细胞间有极少量炎性细胞存在,各组无明显差异。
术后24 h:A组大鼠皮瓣组织排列紊乱,细胞核稀疏,可见明显水肿,组织间可见较多炎性细胞浸润;E组大鼠皮瓣组织轻度水肿,见极少量炎性细胞浸润,其他皮瓣组织有轻微肿胀,但炎性细胞较A组明显减少。
术后7 d:A组大鼠皮瓣组织细胞排列紊乱,细胞核稀疏,大量白细胞浸润;B组大鼠皮瓣组织细胞呈单层排列,结构整齐;C组、D组、F组大鼠皮瓣水肿程度较轻,细胞结构较整齐,组织间隙可见少量炎症细胞浸润;E组大鼠可见细胞结构排列无顺序,细胞核与周围胞质界限不清,细胞核可见部分破坏,细胞轻度水肿。
2.4 大鼠皮瓣TUNEL染色结果
TUNEL法染色结果如图3和表3所示,B 组大鼠皮瓣组织结构正常,核小体清晰、完整,仅有少量凋亡的细胞出现,分布在正常的结构周围;C 组和D组、F组大鼠皮瓣组织整体结构较完整、轻度水肿,细胞核清晰,少量凋亡细胞出现;A 组与E 组皮瓣组织失去正常的组织结构,皮肤组织层次不清,大量凋亡的细胞出现,染色质浓缩、边缘化,核膜裂解、染色质分割、成块状和凋亡小体等典型的凋亡状态出现。
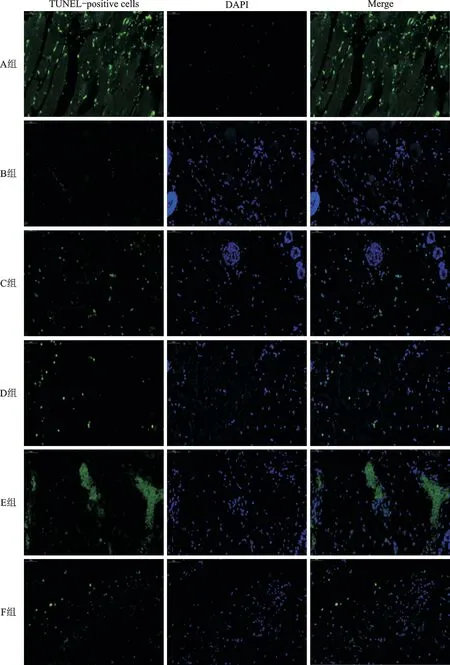
图3 各组大鼠皮瓣组织TUNEL法染色结果Fig.3 TUNEL staining results of rat skin flap tissues in each group

表3 大鼠皮瓣组织内细胞凋亡百分率Tab.3 Percentage of apoptosis in flap tissue of rats in each group (%)
2.5 qRT-PCR实验结果
术后1 h:与A 组相比,其他组大鼠皮瓣组织中p38MAPK(B、C、D、E、F组)、NF-κB(B、C、D、F组)的mRNA表达量降低明显(P<0.01,P<0.05),PPARγ的m RNA 表达量B 组最高,相对于A组来说,C、D组提高明显(P<0.01,P<0.05),E 组PPARγ的mRNA表达量低于A 组,但并无统计学意义。与B组相比,其他组大鼠皮瓣组织中p38MAPK、NF-κB的mRNA 表达量均有所升高,其中p38MAPK的m RNA 表达量C、E 组提高比较明显(P<0.01,P<0.05),而PPARγ 的mRNA 表达量明显下降(P<0.01,P<0.05,图4)。
术后24 h:与A 组相比,其他组大鼠皮瓣组织中p38MAPK、NF-κB 的mRNA表达量均低于A组,PPARγ的mRNA表达量B组最高,C组次之(P<0.01,P<0.05),E 组PPARγ的mRNA 表达量虽低于A组,但并无统计学意义。与B组相比,其他组大鼠皮瓣组织中p38MAPK、NF-κB的mRNA表达量均有升高,其中p38MAPK 的表达A 组最高,E 组和C 组次之(P<0.01,P<0.05),D组、F组表达虽有所提高,但并无统计学意义,PPARγ的mRNA 表达量D、E、F组明显下降(P<0.01,图4)。
术后7 d:A 组大鼠皮瓣组织中p38MAPK、NF-κB的mRNA表达量最高,B组PPARγ的mRNA 表达量最高。与A组相比,C组大鼠皮瓣组织中p38MAPK、NF-κB的mRNA表达被抑制(P<0.01);当加入特异性抑制剂SB203580、PDTC后,可观察到D 组、F组大鼠皮瓣组织中p38MAPK、NF-κB的mRNA 表达进一步被抑制。相较于A 组,C 组大鼠皮瓣组织中PPARγ的m RNA 表达有所升高,但差异无统计学意义;当加入GW9662信号通路抑制剂后,E 组大鼠皮瓣组织中PPARγm RNA 的升高趋势受到抑制。与B组相比,其他组大鼠皮瓣组织中p38MAPK、NF-κB的m RNA 表达量有所升高,其中p38MAPK 的表达A 组最高,E 组和C 组次之(P<0.01,P<0.05),D组、F组表达虽有所提高,但并无统计学意义;NF-κB的m RNA 表达E 组提高显著,C 组次之(P<0.01,P<0.05),D 组虽有提高,但并不明显;PPARγ 的m RNA 表达量其他组均明显下降(P<0.01,图4)。

图4 术后1 h/24 h/7 d各组大鼠皮瓣组织中P38MAPK、PPARγ、NF-κB的mRNA表达水平Fig.4 mRNA expression levels of P38MAPK,PPARγand NF-κB in rat flaps 1 h/24 h/7 d after operation
3 讨 论
皮瓣缺血再灌注损伤(ischemia/reperfusion,I/R)广泛存在于皮瓣移植术后,常被认为是组织缺氧缺血-恢复血供一系列动态变化过程,由于其损伤机制的复杂性及交互性,此类研究尚未取得突破性进展,如何治愈或彻底预防皮瓣缺血再灌注损伤至今仍是困扰临床医生的一大难题。近年来,中医药在治疗皮瓣缺血再灌注损伤方面取得了重大突破,某些具有活血化瘀功效的中药制剂被证明亦能提高大鼠随意皮瓣生存面积,促进VEGF的表达[9],中医活血化瘀法能够促进COPD、股骨头坏死、脑缺血再灌注等疾病的血管新生和血管重塑[10-13]。课题组前期亦使用具有活血化瘀的血塞通注射大鼠随意皮瓣模型,促进VEGF的表达水平升高,可以减轻皮瓣移植术后水肿,改善静脉淤血,促进皮瓣成活[14]。消肿止痛合剂由甘肃省中医院李盛华主任医师根据多年临床经验总结而来,药物组成为当归、川芎、桃仁、红花、生地、赤芍、三七、青皮、木香、泽兰、甘草。纵观全方,补血不留瘀,活血不伤正,共奏行气散瘀,活血止痛,消肿散结之功[15-16]。虽然中医药对于皮瓣缺血再灌注损伤的治疗作用已经得到临床认可,但其具体作用机制尚不明确,因此,研究和分析中医药治疗皮瓣缺血再灌注损伤的相关机制就具有非常重要的意义。
本研究选择SB203580 特异性抑制剂靶向阻断p38MAPK 信号通路的激活,SB203580 的主要作用机制是竞争性结合p38MAPK 在细胞中的ATP 结合位点,进而抑制p38MAPK 通路的激活,SB203580通过靶向抑制p38MAPK 的磷酸化,并使其失去激酶活性。为了证实靶向阻断NF-κB信号通路可减轻组织的炎症反应,本研究造模前在大鼠腹腔注射NFκB信号通路抑制剂PDTC,术后观察到大鼠皮瓣的存活率较模型对照组明显提高,HE 染色结果显示大鼠皮瓣组织内细胞结构无破坏,相较于模型组大鼠,细胞水肿情况明显较轻,细胞炎症浸润也明显减少,这提示p38MAPK 信号通路及NF-κB信号通路在皮瓣缺血再灌注损伤中对炎症因子的释放均呈现正向调控作用,这两条信号通路的抑制将有助于皮瓣坏死的治疗及预防,这为将来寻找信号通路特异性阻断药物提供了可能性。本研究通过使用PPARγ 信号通路特异性阻断剂GW9662来抑制PPARγ的活性,探讨PPARγ信号通路在皮瓣缺血再灌注损伤中的作用机制,实验结果发现,术后7 d,相较于假手术组,模型组大鼠细胞中PPARγmRNA 的表达比较显著,消肿止痛合剂处理后PPARγm RNA 的表达量进一步增加,然而,当加入特异性阻断剂GW9662 后,消肿止痛合剂引起的PPARγmRNA 的表达则被抑制。这说明PPARγ信号通路在被激活时可以有效抑制组织的炎性反应,在该信号通路被特异性阻断后,本次实验结果显示PPARγ抑制剂组大鼠皮瓣存活率较p38MAPK 抑制剂组和NF-κB 抑制剂组明显降低,这些证据均证实了PPARγ信号通路在皮瓣缺血再灌注损伤中对炎症因子的释放是呈现负向调控作用的。
本研究是对p38MAPK-PPARγ/NF-κB 信号通路进行单独靶向阻断而进行研究,并在中药干预的基础上观察其m RNA 表达量的变化,是本研究的创新点。本研究虽已证实消肿止痛合剂可以减轻大鼠缺血模型的炎症反应,减少凋亡细胞的生成,并且可以抑制p38MAPK-PPARγ/NF-κB 信号通路的激活,进而促进皮瓣的存活率,但具体作用靶点及相关机制仍未阐明,且国内外关于中医药治疗此类疾病的相关研究较少,研究质量较低、研究层面表浅,缺乏一定的客观性和标准,没有统一的临床治疗指南,缺乏大规模、质量高的临床研究。因此,中医药治疗I/R 的具体作用机制仍有待进一步研究,目前课题组基于中医“祛瘀生新”理论研究消肿止痛合剂治疗皮瓣缺血再灌注损伤中p38MAPK-PPARγ/NF-κB 信号通路作用机制及全基因表达谱分析研究已取得重大突破,相信随着该研究的不断深入,将有助于为I/R 及软组织损伤等相关疾病的防治提供新的思路和方案。
