人参皂苷抗肿瘤活性与机制研究进展
2023-01-03王永宏艾芷伊张俊顺刘思彤刘永哲王玉华
王永宏,艾芷伊,张俊顺,胡 月,刘思彤,刘永哲,王玉华, ,南 博,
(1.吉林农业大学食品科学与工程学院,吉林长春 130000;2.吉林省食品生物制造科技创新中心,吉林农业大学,吉林长春 130000)
人参(Panax ginsengC A Meyer)是我国传统的天然滋补健康食材,含有多种生物活性成分,包括人参皂苷、多糖、生物碱、有机酸、黄酮和挥发油等[1]。其中,人参皂苷是人参中最重要的活性成分,具有广泛的生物学功效,如提高免疫力[2]、护肝[3]、神经保护[4]、抗炎[5]、抗肿瘤[6]等。肿瘤是世界范围内常见的危害人民生命健康的疾病,发病率和死亡率高,是全球第二大死亡原因[7]。根据世卫组织统计的数据,仅2018年就约有960万人死于恶性肿瘤,其中,中国恶性肿瘤患病人数达428万,死亡人数更是占世界总死亡人数的三分之一,恶性肿瘤给社会和家庭造成了巨大负担[8]。目前恶性肿瘤的主要治疗手段是手术和放化疗[9],但手术治疗效果不佳且部分晚期患者发病时已不具备手术条件,放化疗容易引起严重的毒副作用[10]。目前,大量研究结果表明人参总皂苷及单体对抑制肿瘤细胞增殖、促进肿瘤细胞凋亡、抑制肿瘤细胞转移和侵袭、阻断肿瘤血管生成、增强机体免疫能力、抗氧化应激及与化疗药物协同增效等方面具有重要作用,本文就人参皂苷的抗肿瘤活性与机制研究进展进行了系统阐述。
1 人参皂苷分类及其抗肿瘤活性
人参皂苷由皂苷元和糖基连接形成,根据皂苷元的不同,人参皂苷分为四环三萜类达玛烷型、五环三萜类齐墩果酸型人参皂苷,其中,玛烷型人参皂苷根据皂苷元上C-6键位上是否有羟基分为原人参二醇型和原人参三醇型[11]。
1.1 原人参二醇型人参皂苷
原人参二醇型人参皂苷的皂苷元是原人参二醇(protopanaxadiol, PPD),按照C-20位构型的不同,可将其分为20(S)-和20(R)-原人参二醇,化学结构见图1a。目前已被证实具有抗肿瘤活性的原人参二醇型人参皂苷有Rb1[12]、Rb2[13]、Rc[14]、Rd[15]、Rg3[16]、Rg5[17]、Rh2[18]、Rk1[19]、CK[20]和F2[21]等。其中,人参皂苷Rg3和Rh2的研究最为广泛,已被证实对多种恶性肿瘤如胰腺癌和黑色素瘤等具有较好的治疗效果[22-25]。以人参皂苷Rg3为主要功能成分的参一胶囊已经用于临床上非小细胞肺癌和消化系统肿瘤的治疗[26-27]。
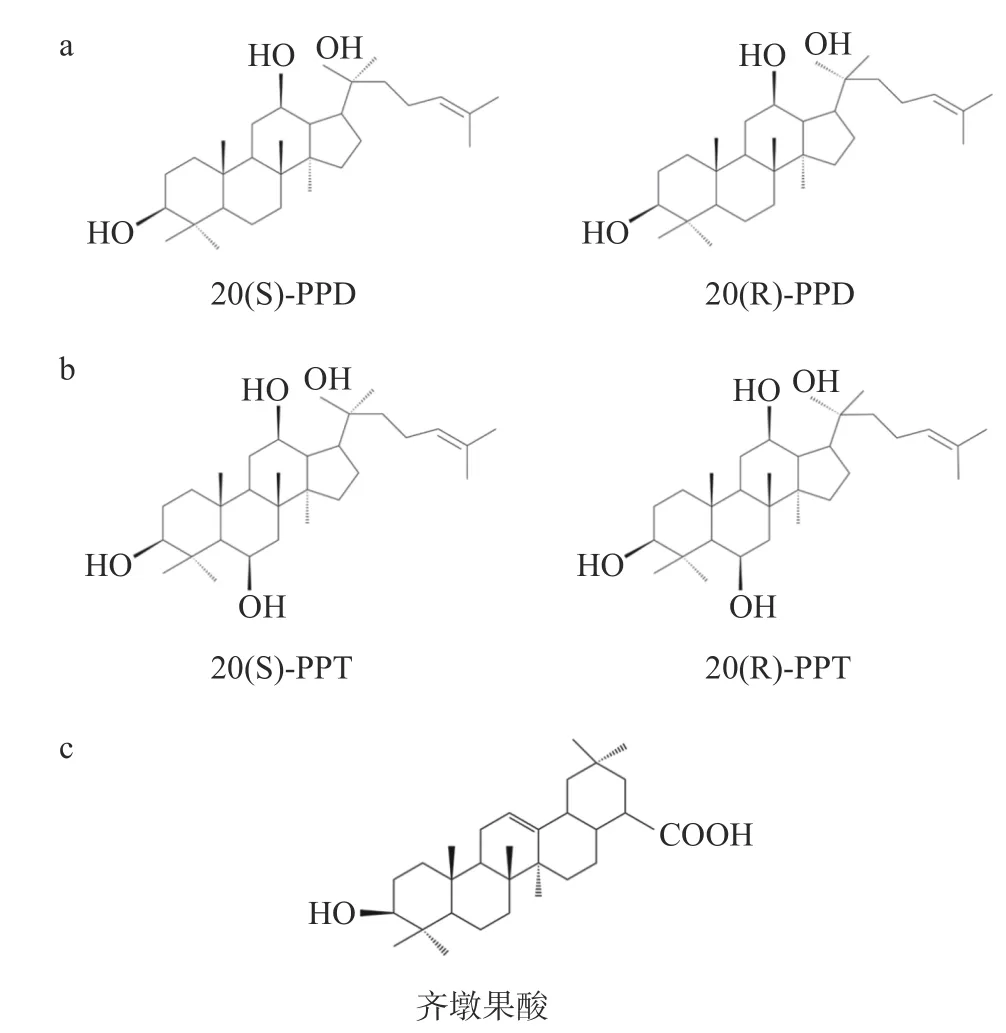
图 1 人参皂苷的化学结构式Fig.1 Chemical structure of ginsenosides
1.2 原人参三醇型人参皂苷
原人参三醇型人参皂苷的皂苷元是原人参三醇(protopanaxatriol, PPT),按C-20位构型的不同,可将其分为20(S)-和20(R)-原人参三醇,化学结构见图1b。目前已被证实具有抗肿瘤活性的原人参二醇型人参皂苷有Re[28]、Rf[29]、Rg1[30]、Rh1[31]和Rh4[32]等。
1.3 齐墩果酸型人参皂苷
齐墩果酸型人参皂苷的皂苷元为齐墩果酸,化学结构见图1c,在齐墩果酸的 C-3 和 C-28 位上与不同的糖基相连形成不同的齐墩果酸型人参皂苷。齐墩果酸已被证明可抑制多种肿瘤,包括肝癌、肺癌等[33-34]。目前,从人参中提取出的齐墩果酸型人参皂苷较少,其中,研究最多的是人参皂苷Ro。有研究表明人参皂苷Ro在小鼠体内能够抑制肿瘤生长,是基于人参皂苷Ro代谢物的生物活性[35],研究人员从人参皂苷Ro干预的荷瘤裸鼠血清中检测到许多人参皂苷Ro的代谢产物,如竹节参皂苷Iva,齐墩果酸葡萄糖基酯等,目前竹节参皂苷Iva的抗肿瘤活性在多种肿瘤如结直肠癌、肝癌和卵巢癌中被证实[36-38],齐墩果酸葡萄糖基酯的抗肿瘤活性还未见报道。
2 人参皂苷抗肿瘤机制
2.1 人参皂苷抑制肿瘤细胞增殖
细胞增殖是肿瘤生长和发展的基础,调控细胞周期是控制细胞增殖的重要机制。细胞周期是指细胞从一次分裂完成到下一次分裂结束所经历的全过程,分为G0、G1、S、G2和M期[39-40]。多种人参皂苷被证实可以通过调控周期蛋白的表达破坏细胞周期转换进而抑制肿瘤细胞的增殖。Wu等[41]使用人参皂苷Rh4处理人直肠癌HCT-116细胞,蛋白免疫印迹实验结果发现Rh4的处理增加了细胞周期蛋白依赖性激酶抑制剂(Cyclin-dependent kinase inhibitor,CKI)蛋白中p53、p21和p27的表达水平,并且呈剂量依赖性降低细胞周期蛋白依赖性激酶(Cyclindependent kinase, CDK)1和CDK4的表达,将细胞周期阻滞在G0/G1期,抑制细胞增殖。Shangguan等[29]的研究表明人参皂苷Rf干预人骨肉瘤MG-63细胞后,可通过降低CDK1和细胞周期蛋白(Cyclin)B1的蛋白质和mRNA水平将细胞阻滞在G2/M期。综上所述,人参皂苷可通过调节肿瘤细胞中Cyclin、CDK和CKI蛋白的表达,诱导细胞周期阻滞以抑制肿瘤细胞的增殖(表1)。
2.2 人参皂苷诱导肿瘤细胞凋亡
细胞凋亡是指细胞在特定基因的控制下,受到多个基因严格控制而发生的自动死亡过程[42]。诱导细胞凋亡是消除肿瘤细胞的有效治疗方法。研究表明人参皂苷可以激活内源性线粒体凋亡途径和外源性死亡受体途径诱导细胞凋亡。Wu等[41]研究发现人参皂苷Rh4可以激活HCT-116细胞中的ROS/JNK/p53信号通路,上调内源性线粒体凋亡途径中的促凋亡蛋白Bax的表达,增加线粒体中的细胞色素c向细胞浆中的释放,增加胞浆中Cleaved Caspase-3/-9的水平,降低抗凋亡蛋白Bcl-2的表达,由此证实内源性线粒体凋亡途径被激活;同时发现Rh4的干预降低了外源性死亡受体途径中Fas的表达水平并增加了Cleaved Caspase-8的表达水平,说明外源性死亡受体途径也参与了细胞凋亡的调节。综上所述,人参皂苷能够通过激活内源性线粒体凋亡途径和外源性死亡受体途径,调节细胞凋亡相关蛋白的表达,诱导肿瘤细胞凋亡(表1)。
2.3 人参皂苷抑制肿瘤细胞侵袭和迁移
肿瘤细胞的侵袭和迁移是导致肿瘤恶化的重要原因,是深入研究人参皂苷抗肿瘤作用的主要方向[43]。Phi等[44]研究使用人参皂苷Rd干预肠癌HT29细胞以观察Rd对细胞迁移的作用,结果发现Rd通过抑制EGFR/Sox2信号轴和下调上皮间质转化(Epithelial-mesenchymal transition, EMT)标志物的表达以控制HT29细胞在体内和体外的迁移潜能。Kim等[45]证实Rg3通过调控人肺癌A549细胞中TGFβ1信号通路抑制EMT过程进而阻止肺癌细胞侵袭和迁移。基质蛋白金属酶(Matrix protein metalloenzymes, MMPs)是调控肿瘤细胞侵袭和迁移的调控因子[46],Jung等[47]研究了人参皂苷Rh1对人星形胶质瘤U87MG和U373MG细胞中MMPs家族蛋白表达的影响,结果分析表明,Rh1的干预通过调控MAPK和PI3K/Akt信号通路和其下游转录因子如NF-κB和AP-1以抑制MMP-1、-3和-9的蛋白表达以及酶活性,通过伤口愈合实验和Matrigel侵袭实验证实Rh1能有效抑制U87MG和U373MG细胞的侵袭和迁移。综上所述,人参皂苷通过多种信号通路抑制EMT过程,降低MMPs家族蛋白的表达水平和活性,从而抑制细胞侵袭和迁移(表1)。
2.4 人参皂苷阻断肿瘤血管生成
血管生成是指从现有血管形成新血管的过程,是肿瘤生长和转移的重要组成部分,广泛分布的血管网络向肿瘤输送氧气和营养物质以及清除肿瘤的代谢废物[48-49],因此阻断血管生成是肿瘤治疗和预防的重要途径。研究证明多种人参皂苷能通过不同途径调控不同分子进而阻断血管生成。Zhang等[50]研究了人参皂苷Rd对血管生成的影响,结果发现Rd以剂量依赖性的方式抑制人脐血管内皮细胞中血管内皮生长因子(Vascular endothelial growth factor, VEGF)诱导的血管生成,抑制体内基质胶栓塞测定中的血管生成,进一步研究发现Rd通过抑制乳腺癌MDAMB-231细胞中Akt/mTOR/p70S6K信号通路以降低缺氧诱导因子1α(Hypoxia-inducible factor-1α,HIF-1α)和VEGF的表达,进而抑制裸鼠的肿瘤血管生成。Zeng等[51]探讨了人参皂苷Rg3在白血病患者体内的抗血管生成作用,使用Rg3处理白血病患者的骨髓基质细胞,结果发现Rg3抑制了细胞中HIF-1α和 VEGF 的 mRNA 和蛋白表达,此外 Rg3的治疗导致患者血清中的HIF-1α和VEGF水平降低。色素上皮衍生因子(Pigment epithelium-derived factor, PEDF)是一种抗血管生成蛋白,Leung等[52]研究发现人参皂苷Rb1显著促进了人脐静脉内皮细胞(Human umbilical vein endothelial cells, HUVECs)中PEDF的转录、蛋白表达和分泌,而对PEDF进行靶向抑制则阻断了Rb1的作用,这表明Rb1的抗血管生成作用是特异性靶向PEDF。综上所述,人参皂苷可通过促进抗血管生成蛋白的表达,抑制生长因子来阻断血管生成(表1)。
2.5 人参皂苷增强机体免疫能力
免疫系统在维持机体健康方面发挥着及其主要的作用,现代肿瘤免疫学认为,免疫系统在监视和清除肿瘤中起到重要作用[53]。T细胞是免疫系统最重要的组成成分[54],Park等[55]研究发现人参皂苷Rg3通过刺激ConA诱导T细胞增殖,提高小鼠免疫器官和血清中细胞因子(IL-2、IFN-γ)的水平,增强免疫活性,抑制荷瘤小鼠的肿瘤生长。NK细胞可通过释放细胞因子等方式杀伤肿瘤细胞,维持T细胞的功能和增强免疫检查点治疗的功效[56],Kwon等[57]探究了人参皂苷F1在NK细胞的肿瘤监测中的作用,研究结果表明F1的干预有效增强了NK细胞对多种激活受体和肿瘤细胞的细胞毒性,还改善了依赖NK细胞活性的淋巴瘤清除和转移性黑色素瘤小鼠模型的肿瘤监测。阻断免疫检查点已在临床实践中用于治疗肿瘤,PD-L1/PD-1通路是最关键的免疫检查点[58]。Hu等[59]使用人参皂苷Rk1处理肺癌A549和PC9细胞,结果显示Rk1通过抑制NF-κB信号转导降低了细胞中PD-L1的高表达。综上所述,人参皂苷通过诱导免疫细胞增殖,增强免疫反应和调控免疫检查点发挥抗肿瘤作用(表1)。
2.6 人参皂苷抗氧化应激
研究发现,氧化应激可介导细胞中原癌基因和抑癌基因的激活和失活,导致细胞异常生长发展成为肿瘤[60]。人参皂苷在抗氧化应激和治疗由氧化应激介导的疾病中发挥着重要的作用。Zhou等[61]研究了人参皂苷Rb1对氧化应激造成的炎症损伤的影响及分子机制,结果表明对HUVECs使用Rb1处理可减轻由TNF-α诱导引起的氧化应激和炎症损伤,进一步研究表明Rb1通过激活P38和JNK信号通路来抑制 NF-κB 通路,抑制 TNF-α诱导 ROS 和 MDA的产生,增加SOD、CAT和GSH-Px的活性,从而保护细胞免受氧化应激和细胞炎症因子诱导的炎症损伤。Li 等[62]研究了人参皂苷 Rg1 在心肌细胞 H9c2细胞氧化应激损伤中的作用,实验结果发现Rg1通过提高激活细胞中细胞内Nrf2/HO-1轴,抑制JNK信号通路,提高SOD、GSH-Px和GSH的水平来降低ROS诱导的氧化应激。Liu等[63]使用人参皂苷Rd干预从Sprague-Dawley大鼠幼崽分离的海马神经元细胞,结果发现Rd通过降低细胞中ROS和MDA水平,提高SOD和GSH-Px水平,显著改善了由淀粉样蛋白β25-35诱导的氧化应激损伤。综上所述,人参皂苷作为一种保护剂,通过减少氧化应激和氧化应激对细胞的损伤来平衡细胞内的微环境,从而在源头上降低患癌的可能性(表1)。

表 1 人参皂苷的抗肿瘤机制Table 1 Antitumor mechanism of ginsenosides
2.7 人参皂苷与化疗药物协同增效
肿瘤患者在放化疗后会产生一定的副作用,长期大剂量用药会导致许多肿瘤细胞产生多药耐药性[64],因此开发新的治疗策略以减少副作用和逆转多药耐药性显得尤为紧迫。有研究报道证实人参皂苷与现有放化疗药物联合使用具有许多优势,如提高抗肿瘤效果、减少副作用和降低用药剂量以及逆转多药耐药性[65-67]。生晒参是一种人参热加工的产物,Lin等[68]发现将生晒参与表柔比星和紫杉醇联合使用后增加了两种药物在人宫颈癌HeLa细胞、人结直肠癌SW111C细胞和SW480细胞中的引起细胞凋亡的能力。Zhu等[69]报道表明从人参中提取的总人参皂苷与环磷酰胺联合使用后促进了环磷酰胺的治疗作用,具体表现为延长存活率、增强肿瘤生长抑制率和细胞凋亡,进一步的研究证实,总人参皂苷促进了肠道益生菌的繁殖,减轻了环磷酰胺诱导的肠道黏膜炎,这些作用与总人参皂苷激活Nrf2并抑制NF-κB通路有关。此外,Jiang等[70]研究了人参皂苷Rg3对减弱顺铂耐药诱导的PD-L1表达的作用,结果发现Rg3通过下调NF-κB p65和Akt信号通路以抑制顺铂耐药诱导的PD-L1的表达,并提高了T细胞对肺癌A549细胞和A549/DDP耐药细胞的抑制作用。综上所述,人参皂苷与化疗药物联用具有良好的协同作用,可提高化疗药物疗效,降低副作用,逆转肿瘤细胞的多药耐药性(表1)。
3 总结与展望
人参皂苷的抗肿瘤活性是通过不同机制实现的,包括抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡、抑制肿瘤细胞侵袭和转移、阻断肿瘤血管生成、增强机体免疫系统、抵抗氧化应激以及与化疗药物的协同作用等。目前仅有少数人参皂苷已经应用于临床治疗,大部分人参皂苷的研究仅局限于细胞及动物试验层面,极少进行临床试验,未被完全开发利用,并且关于人参皂苷与放化疗药物联合使用对于肿瘤治疗效果的临床研究仍较少。随着肿瘤患病率的不断提高,抗肿瘤药物的研发成为临床和科研工作者研究的重中之重。人参皂苷在肿瘤的发生、发展和转移等多个过程中可以进行调控,显示出较强的抗肿瘤潜力。作为一种天然的抗肿瘤药物,人参皂苷和由人参开发的功能性食品会对肿瘤的治疗和预防发挥越来越重要的作用。本文通过对人参皂苷的抗肿瘤活性和机制进行总结,以期对人参皂苷抗肿瘤的深入研究提供参考,同时为人参抗肿瘤功能性食品开发提供了理论基础。
