一株产中性蛋白酶菌株的筛选及其发酵产酶条件优化
2023-01-03附俊杰温雪瓶
李 娜,附俊杰,刘 军,温雪瓶,李 丽,2,
(1.四川轻化工大学生物工程学院,四川宜宾 644000;2.固态发酵资源利用四川省重点实验室,四川宜宾 644000)
蛋白质是体内重要的营养物质。摄入的蛋白质在胃肠道中被蛋白酶和肽酶降解,被吸收为小肽或游离氨基酸[1]。小肽比氨基酸更易被吸收,且具有增强免疫、抗氧化、抗菌、降血脂等多种生物学功能,被广泛应用于食品和饲料生产中[2-4]。含蛋白质的农业副产物对生物活性肽的生产越来越具有吸引力,这有助于废物的利用和价值的提高,如豆粕,菜粕,棉粕,花生粕等[5]。这些肽序列在含有完整的母蛋白序列时不显示任何生物活性,因此首先必须水解,一般是通过与一种或多种蛋白酶酶解、发酵或两者结合而催化水解。在发酵过程中,发酵底物中蛋白质的分子结构、空间结构效应以及理化性质会发生变化,产生独特的功能肽,如鲜味肽、抗菌肽[6-8]。但发酵效果易受微生物种类和所用发酵工艺的影响,乳酸菌、酵母菌在豆粕、菜粕脱毒和提升风味中效果显著,但由于其蛋白酶活低,使得豆粕、菜粕中的蛋白不能有效转化[9],菌酶协同是一种好的方式[10]。外源添加蛋白酶提高小肽的含量的同时,还可有效降低蛋白原料中的过敏原[11]。
中性蛋白酶具有催化速度快、催化过程温和、无污染等优点,常被用于食品、药品、饲料行业[12]。中性蛋白酶产生的游离氨基酸类型丰富,制备呈味肽的效果优于风味蛋白酶,其产生的不益物质以及水解度要比风味蛋白酶低,因此中性蛋白酶用于发酵工艺可以降低酶的用量并提高原料的回收率[13-14]。蛋白质是微生物产蛋白酶主要的底物来源,植物源蛋白可作为蛋白酶及多肽生产的潜在底物,如中性蛋白酶酶解红花籽粕制备抗氧化肽,酶解大豆粕蛋白制备小分子肽[15-16]。
植物源蛋白的应用逐渐成为当今研究的热点,我国非传统蛋白资源非常丰富,包括农产品加工副产物、糟粕类、植物及其加工副产物等,这些植物源蛋白的利用有助于减少酶或多肽的生产成本,同时也会获得多种活性功能的多肽。因此,适应菜粕等农业副产物的高性能、高产量的蛋白酶新型菌株和连续发酵工艺亟需推进。本研究从桑叶中筛选出一株高产中性蛋白酶的菌株,以菜粕作为氮源,通过优化培养基成分和发酵条件,使得酶活显著提高。该研究为植物源蛋白资源高值利用和植物蛋白向生物活性肽的转化提供了理论基础。
1 材料与方法
1.1 材料与仪器
桑叶 -20 ℃下保藏,备用(品种为白桑叶,2021年5月采摘自某桑叶园);干酪素、三氯乙酸、硫酸铜、无水碳酸钠、葡萄糖、乳糖、曲拉通-100、吐温60、吐温80、尿素、氯化铵、硫酸镁、可溶性淀粉、氯化钠、氯化钾、硫酸锰、硫酸锌、硫酸铁、硫酸铜、麦芽糖 分析纯,均购于成都科隆化学品有限公司;福林酚试剂、蛋白胨、牛肉膏、酵母浸粉 生化级,均购于成都奥博星生物技术有限公司;蔗糖 化学纯,购于天津市科密欧化学试剂有限公司;司班60
化学纯,购于成都科隆试剂有限公司;菜粕、豆粕、玉米粉 食品级,市售;DNA试剂盒 购自天根生化科技有限公司。
酪素培养基(g/L):参考文献[17]并稍加修改,干酪素4 g,并滴入少量20 g/L NaOH溶液和蒸馏水,在沸水浴下溶解后调pH至7.5,再加入1.07 g Na2HPO4.7 H2O作为A液。0.36 g K2HPO4加入少量蒸馏水溶解作为B液。A液和B液混合加入20 g琼脂粉、0.5%酪素水解培养物2 mL,溶于1 L蒸馏水中,121 ℃灭菌15 min。
营养肉汤培养基(g/L):蛋白胨10 g/L、牛肉浸出粉3 g/L、氯化钠5 g/L、pH7.2±0.2,溶于1 L蒸馏水中,121 ℃灭菌15 min。
基础发酵培养基(g/L):葡萄糖2 g/L、蛋白胨10 g/L、氯化钠5 g/L、吐温80 0.4%,溶于1 L蒸馏水中,121 ℃灭菌15 min。
T-114分析天平 奥豪斯仪器有限公司;QYC-2102C恒温培养摇床 上海福马实验设备有限公司;DZKW-4电子恒温水浴锅、T6新世纪紫外可见分光光度计 北京普析通用仪器有限公司;HWS-260B恒温恒湿箱、LS-75HD高压蒸汽灭菌锅 江阴滨江医疗设备有限公司;BM1000显微镜 南京江南永新光学有限公司;AT-710 pH计 日本京都电子制造有限公司;SPX-100B-Z单人单面净化超净工作台 上海沪净医疗器械有限公司;Mini Amp PCR仪 上海艾研生物科技有限公司。
1.2 实验方法
1.2.1 产蛋白酶菌株的筛选 产蛋白酶菌株的筛选基于文献稍加修改[18-19]。
初筛:取20 g桑叶切碎加入150 mL生理盐水中,37 ℃、195 r/min摇床培养20 min,用梯度稀释法分别稀释10-1~10-5浓度,分别从10-1~10-5稀释液中取出100 μL涂布在酪素培养基平板上,于37 ℃培养24 h,将产生透明圈菌株点注在酪素培养基上,观察菌落与透明圈直径大小,直径较大的可以初步认为是产蛋白酶能强的菌株,并用接种环挑取产透明圈菌株进行纯种划线。
复筛:挑取产生透明圈的菌株接种于营养肉汤培养基中,37 ℃、195 r/min摇床培养35 h,测定中性蛋白酶活,结合初筛结果,挑选产中性蛋白酶活较高的菌株。
1.2.2 蛋白酶活力测定 根据GB/T 23527-2009《蛋白酶制剂》进行蛋白酶活测定,碱性蛋白酶pH10.5、中性蛋白酶pH7.5、酸性蛋白酶pH3.0条件下测定。以L-酪氨酸为标准曲线并建立回归方程,吸光度值为纵坐标,L-酪氨酸浓度为横坐标,回归方程为y=0.0106x+0.0021,R2=0.9998。
1.2.3 菌株鉴定
1.2.3.1 菌株形态学鉴定 所筛菌株在营养肉汤固体培养基上划线,37 ℃好氧培养24 h,观察菌落,通过革兰氏染色在显微镜下观察菌体形态。
1.2.3.2 生理生化特征分析 根据《伯杰氏细菌鉴定手册(第八版)》对该菌种进行糖发酵试验、VP试验、MR试验、吲哚试验、柠檬酸盐利用试验、苯丙氨酸脱羧酶测定、H2S试验、产气试验。
1.2.3.3 分子生物学鉴定 采用DNA试剂盒对筛选到的菌株进行全基因组提取,以27F(5’-AGAGTTTGATCCTGGCTCAG -3’)、1492R(5’-GGTTACCTTGTTACGACTT-3’)为引物对16S rDNA进行PCR扩增,经纯化后将样品送擎科生物公司测序,测序结果在NCBI数据库中进行BLAST分析,之后利用MEGA6进行基因排序匹配及系统发育树的构建,得到基因序列同源性较高的菌株。
1.2.4 菌株产酶曲线 对数生长期的菌液以3%(v/v)接种至营养肉汤培养基,37 ℃、195 r/min摇床发酵,每隔8 h取样,测定蛋白酶活,根据蛋白酶活的变化,确定最佳产酶时间。
1.2.5 不同培养基成分对菌株产酶的影响
1.2.5.1 不同碳源对菌株产酶的影响 对数生长期的菌液以3%(v/v)接种至基础发酵培养基,其中葡萄糖替换为2 g/L(蔗糖、乳糖、麦芽糖、果糖、可溶性淀粉、玉米粉),其余成分及含量不变,初始pH5.6、37 ℃、195 r/min摇床发酵40 h,测定蛋白酶活。最佳碳源以0.5、3.5、6.5、9.5、12.5 g/L添加进不同基础发酵培养基中发酵40 h后测定蛋白酶活,选取最优区间进行后续试验设计。
1.2.5.2 不同氮源对菌株产酶的影响 对数生长期的菌液以3%(v/v)接种至基础发酵培养基,其中蛋白胨替换为10 g/L(牛肉膏、菜粕、豆粕、尿素、硝酸钾、硫酸铵),其余成分及含量不变,初始pH5.6、37 ℃、195 r/min摇床发酵40 h,测定蛋白酶活。最佳氮源按1.5、11.5、19.5、27.5、35.5、43.5 g/L添加进不同基础发酵培养基中发酵40 h后测定蛋白酶活,选取最优区间进行后续试验设计。
1.2.5.3 不同金属离子对菌株产酶的影响 对数生长期的菌液以3%(v/v)接种至基础发酵培养基,其中NaCl替换为5 g/L(MgSO4、ZnSO4、CuSO4、FeSO4、K2SO4、MnSO4),其余成分及含量不变,初始pH5.6、37 ℃、195 r/min摇床发酵40 h,测定蛋白酶活。最佳金属离子按0.5、3、5.5、8、10.5 g/L添加进不同基础发酵培养基中发酵40 h后测定蛋白酶活,选取最优区间进行后续试验设计。
1.2.5.4 不同表面活性剂对菌株产酶的影响 对数生长期的菌液以3%(v/v)接种至基础发酵培养基,其中吐温80分别替换为0.4%(吐温60、Triton-100、司班60),其余成分及含量不变,初始pH5.6、37 ℃、195 r/min摇床发酵40 h,测定蛋白酶活。最佳表面活性剂按0.2、0.6、1、1.4、1.8 g/L添加进基础发酵培养基中发酵40 h后测定蛋白酶活,选取最优区间进行后续试验设计。
1.2.5.5 酵母浸粉和磷元素对菌株产酶的影响 对数生长期的菌液以3%(v/v)接种至基础发酵培养基,分别添加0、1、2、3、4 g/L的K2HPO4,0、3、6、9、12 g/L酵母浸粉,初始pH5.6、37 ℃、195 r/min摇床发酵40 h后测定蛋白酶活,探讨酵母浸粉和磷元素对蛋白酶活的影响。
1.2.6 发酵培养基优化试验
1.2.6.1 Plackett-Burman(P-B)试验 根据单因素实验得到的结果。采用P-B试验设计对6个培养基成分(乳糖、菜粕、MgSO4、酵母浸粉、吐温80、K2HPO4)进行方差分析,将每个因素分为两个水平,即低水平-1,高水平+1表示,试验设计如表1。

表 1 Plackett-Burman试验设计Table 1 Plackett-Burman experimental design
1.2.6.2 最陡爬坡试验 根据P-B试验设计得到的3个显著因素进行最陡爬坡试验,综合考虑各因素之间的正负影响并确定各因素步长和爬坡方向,其余成分按照低水平加入,试验设计如表2。

表 2 最陡爬坡试验设计Table 2 Design of steepest climbing test

表 3 培养基成分响应面优化设计Table 3 Response surface optimization design of medium components
1.2.6.3 Box-Behnken响应面优化设计 在上述试验基础上,利用Design-Expert 8.0软件进行响应面优化。以培养基成分中各显著因素为自变量,蛋白酶活为响应值(Y),设计3因素3水平试验,其余成分按照低水平加入。根据响应面试验模拟的最佳产酶的培养基成分及相应浓度进行验证。试验设计如表3。
1.2.7 发酵条件对菌株产酶的影响 除了培养基成分影响菌株产酶,发酵条件也是影响菌株产酶活力的重要因素。将菌体接入优化培养基中,过夜培养至对数生长期(OD≈0.5)作为种子液并进行如下实验。
1.2.7.1 温度对菌株ppr3产酶的影响 对数生长期的菌液以3%(v/v)接种至优化的培养基中,置于18、26、34、42、50 ℃,初始pH5.6、195 r/min摇床发酵40 h后测定蛋白酶活。
1.2.7.2 接种量对菌株ppr3产酶的影响 对数生长期的菌液分别以0.5%、3%、5.5%、8%、10.5%(v/v)接种至优化的培养基中,初始pH5.6、37 ℃、195 r/min摇床发酵40 h后测定蛋白酶活。
1.2.7.3 初始pH对菌株ppr3产酶的影响 对数生长期的菌液以3%(v/v)接种至优化的培养基中,初始pH分别调节为1、3、5、7、9,37 ℃、195 r/min摇床发酵40 h后测定蛋白酶活。
1.2.8 发酵条件的响应面优化设计 根据单因素实验结果,采用中心组合设计获得二次模型,中心点估计以蛋白酶活为指标,对3个因素进行响应面优化,根据响应面试验模拟最佳产酶的发酵条件进行验证。试验设计如表4。

表 4 发酵条件响应面优化设计Table 4 Response surface optimization design of fermentation conditions
1.3 数据处理
运用SPSS 22进行单因素ANOVA分析,采用Desige-Expert12软件进行Plackett-Burman试验和Box-Behnken响应面优化试验设计,建立非线性回归数学建模,并对模型进行验证,该模型考虑了各因素之间的主次效应以及因素之间的二级交互作用。
2 结果与分析
2.1 产蛋白酶菌株的筛选
从采集的桑叶中筛选得到7株产生透明圈的菌株,挑取7株菌株点注在酪素培养基,见图1,分别命名为ppr0、ppr2、ppr3、ppr4、ppr5、ppr6、ppr7,根据透明圈与菌株直径比例,初步筛选酶活较高的菌株(表5),比值最大为菌株ppr3。通过发酵实验对中性蛋白酶菌株复筛,结果显示,中性蛋白酶活最高的仍为ppr3菌株,达到215.4±2.26 U/mL。表6展示了该菌株在不同蛋白酶测定方法下的蛋白酶活,中性蛋白酶活最高,为220.4±3.47 U/mL,因此菌株ppr3产中性蛋白酶,后续试验以ppr3为试验菌株进行中性蛋白酶酶活的优化。

图 1 酪素培养基上筛选菌株的透明圈Fig.1 Transparent circle of strains screened on casein medium

图 2 菌落形态图片(左)与革兰氏染色结果(右)Fig.2 Image of colony morphology (left) and observation of bacterial morphology under microscope (right)

表 5 透明圈与菌株直径的比值及相应酶活Table 5 Ratio of transparent circle to strain diameter and corresponding enzyme activities

表 6 不同pH下ppr3蛋白酶活Table 6 ppr3 Protease activity at different pH
2.2 菌株鉴定
2.2.1 菌株形态学观察 由图2(左)可知,菌株近乳白色,边缘光滑规则,呈圆形,表面湿润。革兰氏染色结果阳性,菌体形态杆状(图2(右))。
2.2.2 生理生化特征 生理生化结果显示,菌株ppr3可分解葡萄糖、乳糖、蔗糖,不产气,VP试验、MR试验为阴性,不具有色氨酸酶、苯丙氨酸脱羧酶,不可利用柠檬酸盐作为碳源,不能分解含硫氨基酸,结合《伯杰氏细菌鉴定手册》,初步确定为芽孢杆菌属。
2.2.3ppr3菌株的分子生物学鉴定 对菌株ppr3进行DNA提取,PCR扩增产物经琼脂糖凝胶电泳,如图3所示,ppr3菌株16S rDNA在1000~2000 bp之间,表明已成功扩增目的基因。建立系统发育树,比较菌株之间的同源性,如图4所示,ppr3与贝莱斯芽孢杆菌CBMB205同源性极高。结合菌株形态学观察、生理生化分析,初步认定ppr3菌株为贝莱斯芽孢杆菌,贝莱斯芽孢杆菌是一种新型益生菌,具有抗菌和改善肠道的能力[20],本研究筛选的贝莱斯芽孢杆菌可能在食品与农业生产中具有广泛潜力。

图 3 菌株ppr3 16S rDNA PCR扩增电泳图Fig.3 Electropherogram of strain ppr3 16S rDNA PCR amplification
2.3 菌株的产酶曲线
测定ppr3不同发酵时间段的中性蛋白酶活,绘制产酶曲线。由图5(a)可知,菌株发酵过程中,蛋白酶活先升高后下降,40 h达到277.3±6.21 U/mL,最佳产酶时间为40 h,因此取40 h为发酵截止时间进行后续试验。

图 4 ppr3的系统发育树Fig.4 Construction of strain ppr3 phylogenetic tree
2.4 不同培养基成分对蛋白酶活的影响
添加不同碳源对菌株ppr3产酶的影响如图5(b)所示。结果表明,以乳糖为碳源时,蛋白酶活最高,酶活达297±6.66 U/mL,这与之前研究结果一致[21],乳糖作为缓速碳源,有助于蛋白酶等代谢产物的合成[22]。当乳糖浓度为3.5 g/L时,蛋白酶活最高达310±3.33 U/mL,随着乳糖浓度增加,酶活逐渐下降,这可能是微生物倾向于更多碳源代谢,影响了蛋白酶的产生,其他代谢产物的积累也抑制了菌体的生长。因此选择4.5和0.5 g/L作为P-B试验碳源的高低水平。
探究不同氮源对蛋白酶活的影响发现(图5(c)),以菜粕和豆粕为氮源时,蛋白酶活最高,分别达到了382.83±4.45、385.35±6.19 U/mL,二者差异不显著(P>0.05),相比于无机氮源,部分有机氮源更利于菌株产生蛋白酶。菜粕中含有丰富的蛋白质,可供蛋白酶的产生与利用[23-24],且菜粕价格优惠,故选择菜粕作为最佳氮源进行后续实验。当菜粕浓度为11.5 g/L时,蛋白酶活最高,为403±4.88 U/mL。继续增加菜粕浓度,酶活出现先平稳后下降的趋势。菜粕浓度的增加,发酵液呈粘性状态,当发酵液粘性过大时,可能不利于菌体产酶。因此选择18和2 g/L作为P-B试验氮源的高低水平。
不同金属离子对蛋白酶活的影响如图5(d)所示,添加Mg2+发酵组蛋白酶活最高,为305±8.67 U/mL,Na+、K+次之,添加Mn2+、Zn2+、Fe2+、Cu2+酶活最低,且低于空白组。Mg2+是蛋白酶的活性位点和活化剂,催化蛋白酶的产生,细胞中的某类蛋白系统对Mg2+浓度进行了储存,并运输到适当位置,组合成酶促系统,从而促进了蛋白酶的产生[25-26],因此选择Mg2+为最佳金属离子。Mg2+浓度为3 g/L时,蛋白酶活达到291±5.12 U/mL,与Mg2+浓度为5.5 g/L时的蛋白酶活无显著差异(P>0.05)。之后随着Mg2+浓度增加,酶活出现轻微下降,说明金属离子浓度过高抑制酶的产生,因此选择 3.5 和 0.4 g/L 作为 P-B 试验Mg2+的高低水平。
表面活性剂对蛋白酶活的影响见图5(e),添加曲拉通-100对蛋白酶活有抑制作用,其他3种表面活性剂与对照组相比蛋白酶活无显著差异(P>0.05),非离子型表面活性剂可以增大细胞膜的渗透性,使得酶更容易分泌[27-28],选取吐温80进行后续实验。吐温80浓度为0.6 g/L时,蛋白酶活最高,达到了294±6.33 U/mL,适量的表面活性剂对蛋白酶活有所提高,因此选择1.0和0.3 g/L作为P-B试验吐温80的高低水平。
添加不同浓度的酵母浸粉、K2HPO4发现(图5(f)),随着浓度的增加,蛋白酶活呈现先增加后下降的趋势,当酵母浸粉、K2HPO4浓度分别为3 g/L和1 g/L时蛋白酶活最高,分别为387±5.88 U/mL和301±3.38 U/mL。即适量的酵母浸粉和K2HPO4可提高蛋白酶活。酵母浸粉中含有大量微生物可利用的生长因子[29],K2HPO4中的P元素是微生物代谢的重要组成部分,可为蛋白酶起到pH缓冲作用[30]。因此选择3.75和0.25 g/L作为P-B试验酵母浸粉高低水平,1.5和0.4 g/L作为P-B试验磷元素高低水平。

图 5 菌种的产酶曲线及发酵培养基成分对酶活的影响Fig.5 Enzyme production curve of strain and effect of medium composition on enzyme activity
2.5 响应面优化
2.5.1 Plackett-Burman试验 P-B用来评估实验误差和一段模型的充分性[31],通过P-B试验设计可获得影响显著的变量,从而为后续变量优化提供理论基础。
依据单因素实验结果,确定因素与水平后,通过P-B试验(表1)筛选影响显著的重要因素。如表7所示以蛋白酶活(Y)为响应值,对数据进行回归分析,得到回归方程为Y=24.75A+26.92B-2.92C+16.25D-10.08E+14.58F。模型相关系数为R2=0.8854,P=0.0296<0.05,该模型可用。P-B试验的方差分析如表8所示,从各因素P值可知,乳糖、菜粕对蛋白酶活影响显著(P<0.05)。根据F值将显著因素由大到小排列为菜粕>乳糖>酵母浸粉>K2HPO4>吐温80>Mg2+,根据回归方程各变量系数可知,乳糖、菜粕、酵母浸粉对蛋白酶活均表现为正效应,选择F值前三的影响因素进行后续爬坡实验。

表 7 Plackett-Burman试验设计及结果Table 7 Plackett-Burman experimental design and results

表 8 Plackett-Burman 设计方差分析Table 8 Plackett-Burman design variance analysis
2.5.2 最陡爬坡试验 根据已确定的因素正负效应,并依据前期试验确定爬坡方向及步长。由表9可知,第4组试验蛋白酶活最高,为483.79±6.65 U/mL,因此将第4组作为中心点进行响应面优化。

表 9 最陡爬坡试验Table 9 Steepest ascent experiment
2.5.3 培养基成分的响应面优化设计 以乳糖(A)、菜粕(B)、酵母浸粉(D)为自变量,蛋白酶活为响应值(Y),通过软件Design-Expert 12对表10进行多元回归拟合,得自变量A、B、D与因变量Y间的编码回归方程Y=4.77A+42.14B+18.61D-7.14AB-35.06AD+1.64BD-17.64A2-58.46B2-15.82D2,实际回归方程Y=126.41A+55.02B+129.54D-0.45AB-10.02 AD+0.12BD-4.41A2-0.9B2-5.17D2。表11方差分析可知,模型P值=0.0015<0.05,差异极显著,失拟值P=0.6681>0.05,不存在失拟现象,拟合度好。模型R2=0.9422,说明该模型能反映响应值的变化。

表 10 Box-Behnken试验设计及结果Table 10 Box-Behnken experimental design and results

表 11 蛋白酶活回归分析Table 11 Regression analysis of protease activity
蛋白酶活响应面曲面图结果表明(图6),乳糖和酵母浸粉有交互影响,乳糖和菜粕无交互作用,菜粕和酵母浸粉无显著影响。利用软件预测响应值最大值,模型预测各因素组合为乳糖5.55 g/L、菜粕31.89 g/L、酵母浸粉7.09 g/L时,预测到最大蛋白酶活为501 U/mL,通过验证实验得蛋白酶活为497±4.56 U/mL,达到了预测值的99%。
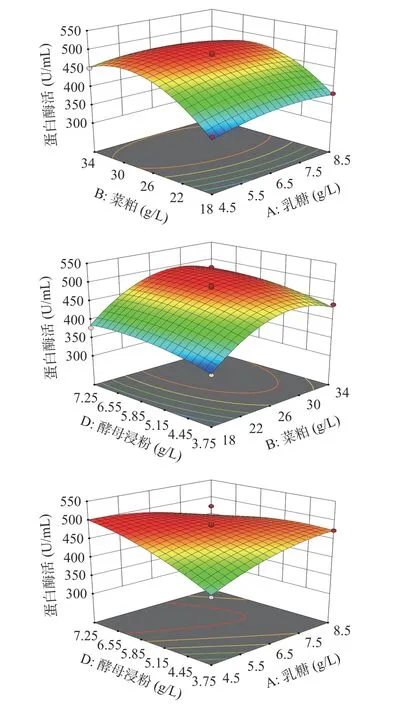
图 6 各因素交互作用对贝莱斯芽孢杆菌产蛋白酶的影响Fig.6 Responses surface plots showing the interactive effects of rapeseed meal, yeast extract and lactose levels on protease production by Bacillus velezensis
2.6 发酵条件对菌株产酶的影响
除了发酵培养基会显著影响菌株发酵过程中的蛋白酶活,温度、初始pH等发酵条件也会对菌株的产酶起到关键作用。
如图7A所示,在发酵温度梯度变化下,蛋白酶活出现先升高后下降的趋势,34 ℃时蛋白酶活达到最高,为482.91±6.65 U/mL,50 ℃时达到最低,则此蛋白酶耐热性低。由于蛋白酶作为活性蛋白,对环境因素敏感,易失活,会使蛋白酶活降低,适宜的发酵温度可使酶变得活跃,从而增加蛋白酶活的产量[32]。
接种量对菌株产酶的影响见图7B,当接种量为3.0%时蛋白酶活达到468.68±1.64 U/mL,随着接种量不断增加,蛋白酶活和接种量3.0%时的蛋白酶活无显著差异(P>0.05)。可能是增加接种量导致产酶时间提前,蛋白质等营养成分也被更快消耗,没有足够的蛋白诱导,使得蛋白酶活无明显变化。
不同初始pH对菌株ppr3产酶的影响显示(图7C),当培养基初始pH5~7时蛋白酶活几乎相同,分别为493.83±10.28、494.42±3.18 U/mL,pH9时蛋白酶活有显著下降趋势(P<0.05),但仍然保持较高酶活,有研究表明贝莱斯芽孢杆菌生长最适pH5[33]。
2.6.1 发酵条件的响应面优化设计 响应面设计获得了自变量发酵温度(a)、pH(b)、接种量(c)与因变量Y间的编码回归方程(表12)Y=-13.69a+83.79b+12c+0.6475ab+2.56ac-6.13bc-60.67a2-113.49b2-7.98c2,实际回归方程Y=62.16a+327.9b+14.23c+0.04ab+0.13ac-1.23bc-0.95a2-28.37b2-1.28c2。通过方差分析(表13),该模型P值<0.01,表明差异极显著,失拟值>0.05,失拟项不显著,说明不存在失拟现象,拟合度好,R2=0.9987,因此可以用此模型进行验证分析。根据响应面曲线及椭圆形曲线探讨温度、pH、接种量之间的交互作用,图8显示了温度与pH之间无交互作用,接种量和pH之间有交互影响,温度和接种量之间无交互作用。

图 8 各因素交互作用对贝莱斯芽孢杆菌产蛋白酶的影响Fig.8 Responses surface plots showing the interactive effects of temperature, pH and inoculation amount on protease production by Bacillus velezensis

表 12 Box-Behnken试验设计及结果Table 12 Box-Behnken experimental design and results

表 13 蛋白酶活回归分析Table 13 Regression analysis of protease activity

图 7 发酵条件对蛋白酶活的影响Fig.7 Effect of fermentation conditions on protease activity
该模型预测发酵条件为发酵温度33 ℃,接种量为8.5%,初始pH5.7,蛋白酶活达到最大值502 U/mL,通过3组平行验证实验,蛋白酶活的平均值为500±5.86 U/mL,达到了预测值的98%,说明实际值与预测值有很好的拟合性。
3 结论
本研究筛选鉴定了一株高产中性蛋白酶的贝莱斯芽孢杆菌,蛋白酶活(215.4±2.26 U/mL)经统计学优化,提高到500 U/mL,卢超等[34]、许曌昕等[35]筛选到的产中性蛋白酶菌株,蛋白酶活分别为401.83、192.7 U/mL,均低于本研究的酶活。同时贝莱斯芽孢杆菌具有潜在的益生作用[21],这使得其在食品和农业的应用具有明显优势。通过方差分析和二阶模型回归方程,表明最优发酵条件为发酵温度33 ℃,接种量为8.5%,初始pH5.7,培养基成分为乳糖5.55 g/L、菜粕31.89 g/L、酵母浸粉7.09 g/L、吐温80 0.03%、MgSO40.04%,K2HPO40.04%。而菜粕作为替代蛋白,其成本相较于宋立立等[36]、郭艳霞等[37]显著降低。使农业副产物得到了有效利用,但其工业生产有待扩大研究,其产酶机理、酶学性质及益生潜力也需要进一步探索。
