壮药赪桐乙酸乙酯部位及流份对LPS 诱导的RAW264.7 细胞的抗炎作用
2022-12-30魏江存秦祖杰蔡文威马秀梅覃丽萍马艳郑玲谭雨坪
魏江存,秦祖杰*,蔡文威,马秀梅,覃丽萍,马艳,郑玲,谭雨坪
1.广西国际壮医医院,南宁 530201;2.广西中医药大学,南宁 530200
赪桐为马鞭草科大青属植物赪桐Clerodendrum japonicum(Thunb.)Sweet.,又名红龙船、抽须红[1]、“个朋被”(壮族语)[2],产自广西、贵州和云南等地。赪桐主要含有黄酮类、酚酸类等成分[3,4],全株均可入药,味甘,性凉,其具有抗炎[5,6]、抗氧化[7]和抗肿瘤[8]等作用,主治偏头痛、跌打瘀肿、痈肿疮毒;临床用于肺热咳嗽、热淋、小便不利的治疗[9]。在前期研究工作中,发现赪桐乙酸乙酯部位成为抗炎活性最强有效部位,然而,其发挥抗炎作用的具体环节和靶点以及主要的有效成分尚不清楚。本课题通过建立脂多糖诱导RAW264.7 细胞的体外炎症模型,通过硅胶柱将赪桐乙酸乙酯部位进行划分的组分从其抗炎因子的表达筛选最强的抗炎有效组分。故本实验采用MTT 法于490 nm 波长下检测壮药赪桐乙酸乙酯部位及其不同二氯甲烷-甲醇梯度洗脱部位对细胞的毒性作用,并采用ELISA 法检测赪桐乙酸乙酯部位及其不同二氯甲烷-甲醇各洗脱部位对LPS 诱导的RAW264.7 细胞分泌NO、TNF-a、IL-12、IL-6、IL-1β炎症因子的影响,来筛选出赪桐乙酸乙酯部位对炎症反应的抑制作用最强的流份,为其发挥抗炎的有效成分及作用机制研究打下基础。
1 材料与方法
1.1 实验仪器
Biotek SYNERGY H1M 型多功能酶标仪;CKX53型显微镜(奥林巴斯);HWS-26 电热恒温水浴锅(上海齐欣科学仪器有限公司);CO2 培养箱(ESCO CCL-240B-8);TS-200B 空气恒温摇床(上海天呈实验仪器制造有限公司);SQP 型电子天平(赛多利斯科学仪器(北京)有限公司)。
1.2 实验材料
1.2.1 实验药材 药材采自广西南宁市武鸣区,经广西中医药大学第一附属医院药学部唐春丽副主任中药师鉴定为马鞭草科大青属植物赪桐Clerodendrum japonicum(Thunb.)Sweet.,药用部位为全株。
1.2.2 主要试剂 胎牛血清(克拉克生物科学公司,美国);RPMI1640 不完全培养液(江苏凯基生物科技股份有限公司;生产批号20200806);PBS(美国Gibco公司);MTT、胰蛋白酶、LPS 均购自北京索莱宝科技有限公司;TNF-a(南京建成生物工程研究所,批号2020/06);一氧化氮(NO)测试盒(南京建成生物工程研究所,批号:20200406);IL-6、IL-12、IL-1β 试剂盒(北京康普同创生物科技发展有限公司,批号分别为:202008、202006、202001)。
1.3 实验方法
1.3.1 赪桐乙酸乙酯部位及其流份的制备 将赪桐药材8.5 kg,用80%乙醇浸泡24 h 后回流提取1.5 h 后过滤,重复提取3 次后药渣再加60%乙醇回流提取2次,每次1.5 h,合并滤液,浓缩至无乙醇味,依次用石油醚、乙酸乙酯萃取,得到赪桐乙酸乙酯浸膏662.85 g。
取赪桐乙酸乙酯部位浸膏150 g 加甲醇溶解拌于预处理好的适量柱色谱硅胶,烘干后上样。分别以二氯甲烷-甲醇(70:1)、二氯甲烷-甲醇(50:1)、二氯甲烷-甲醇(30:1)、二氯甲烷-甲醇(20:1)、二氯甲烷-甲醇(10:1)梯度洗脱,各浓度10 倍柱体积,分别合并各洗脱部位,浓缩并冷冻干燥。得各部位干膏,密封保存,待用。
取赪桐乙酸乙酯部位及其不同洗脱部位粉末0.15 g 精密称定,加入含0.1%DMSO 的RPMI1640 不完全培养基超声溶解,再用RPMI1640 不完全培养液稀释至3.0 mg/ml,过无菌滤膜,再用完全培养基稀释至所需浓度,现用现配。
1.3.2 MTT 法检测LPS 对RAW264.7 细胞活性的影响及炎症模型的建立
1.3.2.1 LPS 对细胞活性的影响 (1) LPS 母液的配置:LPS5mg+5 ml PBS 溶解,配制成浓度为1mg/ml。(2)取对数生长期的RAW264.7 细胞在5% CO2培养箱内培养。(3) 24 h 后,弃去孔内上清液,使用1640 完全培养基稀释LPS 母液,得到一系列LPS 稀释液0、0.5、1.0、5.0、10.0、25.0 µg/ml。弃掉96 孔板中培养基,加入不同浓度的LPS 稀释液,分别处理细胞12、24 h。(4)弃掉培养液,每孔加入110 µl MTT 与完全培养基混合溶液(DMEM:MTT=10:1),放入培养箱孵育4 h。(5) 弃掉孔内混合液,然后每孔加入110 µl Formazan 溶剂,轻摇10 min,在490 nm 波长处测定每孔吸光度值(OD),并按公式计算细胞活力,在显微镜下观察LPS 刺激24 h 后的细胞形态变化,并拍照。(6) 将结果进行统计学分析,从而判断不同浓度LPS对RAW 264.7 细胞活性的影响。
1.3.2.2 RAW264.7 细胞LPS 炎症模型的建立 (1)取对数生长期RAW264.7 细胞,轻轻拍打,经1000 rpm离心5 min,弃去上清液,用完全培养基配成5×104个/ml 的细胞悬浮液,接种于96 孔板中,每孔加入100 µl的细胞悬液,置37℃、含5% CO2培养箱内培养。(2)24 h 后,弃去孔内上清液,用1640 完全培养基稀释LPS 母液,得到一系列LPS 稀释液0、0.5、1.0、5.0、10.0、25.0 µg/ml,分别观察2、4、6、8、12、16、24 h 后的细胞状态并拍照,培养24 h 后取细胞上清液按照NO、IL-6 试剂盒测定,确定最佳炎症模型条件。
1.3.3 赪桐乙酸乙酯部位及其流份对细胞活性的影响(1)取对数生长期RAW264.7 细胞,用胰酶消化后,经1000 rpm 离心5 min,弃去上清液,用完全培养基配成5×104个/ml 细胞悬浮液,接种96 孔板中,每孔加入100 µl 的细胞悬液,置37℃、含5% CO2培养箱内培养。(2) 24 h 后,弃掉孔内上清液,分别加入100 µl浓度为3.0、2.0、1.0、0.5、0.25、0.125、0.06 mg/ml 的赪桐乙酸乙酯部位(YS)、二氯甲烷-甲醇(70:1)洗脱部位(YSEJ70)、二氯甲烷-甲醇(50:1)洗脱部位(YSEJ50)、二氯甲烷-甲醇(30: 1)洗脱部位(YSEJ30)、二氯甲烷-甲醇(20: 1)洗脱部位(YSEJ20)、二氯甲烷-甲醇(10:1)洗脱部位(YSEJ10)的完全培养基,对照组为100 µl 完全培养基,空白组为100 µl 完全培养基(无细胞),每组设置3 个复孔,置37℃、含5% CO2培养箱内培养。(3) 24 h 后,每孔加入110 µl MTT 与完全培养基混合溶液(DMEM:MTT=10:1),放入培养箱孵育4 h,弃掉孔内混合溶液,每孔加入110 µl Formazan 溶剂,轻摇10 min,在490 nm 波长处测定每孔吸光度值(OD),并按公式计算细胞活力。(4) 细胞抑制率的计算公式:存活率=(药物组OD 值一空白组OD 值)/(对照组OD 值一空白组OD 值)×100%。
1.3.4 检测细胞因子NO、TNF-a、IL-12、IL-6 和IL-1β含量 (1) 取对数生长期的RAW264.7 细胞,用胰酶消化后,经1000 rpm 离心5 min,弃去上清液,用完全培养基配成5×104个/ml 的细胞悬浮液,接种96 孔板中,每孔加入100 µl 的细胞悬液,置37℃、含5% CO2培养箱内培养。(2) 24 h 后,弃去孔内上清液,分别加入100 µl 含药完全培养基(其中赪桐乙酸乙酯部位(YS)、二氯甲烷-甲醇(70:1)洗脱部位(YSEJ70)、二氯甲烷-甲醇(50:1)洗脱部位(YSEJ50)、二氯甲烷-甲醇(30:1)洗脱部位(YSEJ30)、二氯甲烷-甲醇(20:1)洗脱部位(YSEJ20)、二氯甲烷-甲醇(10:1)洗脱部位(YSEJ10),每个洗脱部位的给药终浓度分别为0.25、0.125、0.06 mg/ml;LPS 的终浓度为1.0 μg/ml),含LPS 1.0 μg/ml 完全培养基和不含LPS 完全培养基,即给药组、模型组(M)和空白组(K),每组设置4 个复孔,置37℃、含5% CO2培养箱内培养。(3) 24 h 后,按试剂盒测定细胞分泌的NO 以及炎症因子TNF-a、IL-12、IL-6、IL-1β 的含量。(4) ELISA 法实验操作步骤参考说明书。
1.4 统计学方法
2 结果
2.1 LPS 诱导RAW264.7 的细胞炎症模型的建立
2.1.1 LPS 对RAW264.7 的细胞毒性结果 实验表明:1.0~25.0 µg/ml 的LPS 刺 激RAW 264.7 细 胞24 h后,细胞增长较于对照组有显著增加(P<0.05),其中1.0 µg/ml 的LPS 对细胞增长速度较快(P<0.01),但在刺 激48 h 后细胞增长明显受到抑制(P<0.05、P<0.01)。结果表明,25.0 µg/ml 及其以下浓度的LPS 在24 h 对细胞活力无明显的抑制作用,但在48 h 后细胞活力明显被抑制,结果见表1。
表1 不同浓度的LPS 对RAW264.7 细胞活性的影响(,n=3)Tab.1 Effects of different concentrations of LPS on the viability of RAW264.7 cells (Mean±SD, n=3)
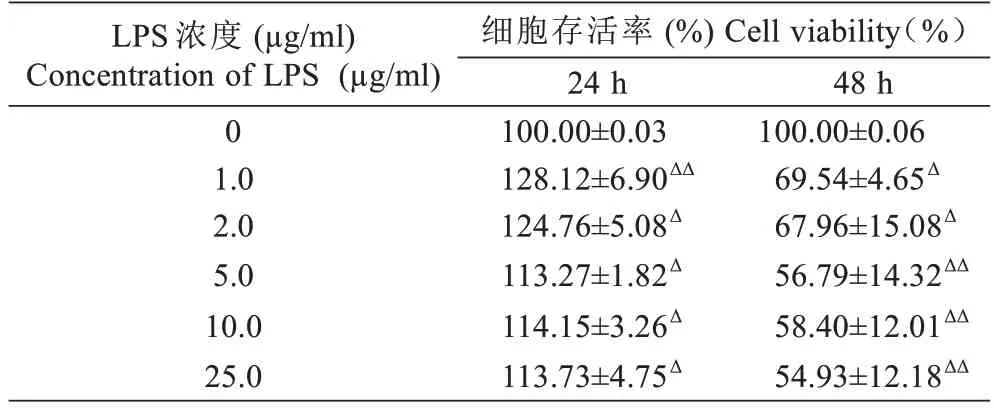
表1 不同浓度的LPS 对RAW264.7 细胞活性的影响(,n=3)Tab.1 Effects of different concentrations of LPS on the viability of RAW264.7 cells (Mean±SD, n=3)
注:Δ P<0.05,ΔΔ P<0.01 与空白对照组比较Note: Δ P<0.05,ΔΔ P<0.01 vs blank control group
表2 不同浓度的LPS 对RAW264.7 细胞分泌NO 的影响(,n=4)Tab.2 Effect of different concentrations of LPS on NO secretion in RAW264.7 cells(Mean±SD, n=4)

表2 不同浓度的LPS 对RAW264.7 细胞分泌NO 的影响(,n=4)Tab.2 Effect of different concentrations of LPS on NO secretion in RAW264.7 cells(Mean±SD, n=4)
注:ΔΔ P<0.01,ΔΔΔ P<0.001 与空白对照组比较Note: ΔΔ P<0.01,ΔΔΔ P<0.001 vs blank control group
2.1.2 LPS 对RAW264.7 的细胞形态变化 不同浓度LPS 刺激RAW264.7 细胞24 h 后,用显微镜下观察,结果表明:RAW 264.7 细胞在正常生长情况下,细胞形态呈圆形或椭圆形,像珍珠一样光亮透明,且边界清晰;当其受到LPS 刺激后,部分细胞由圆形变为梭形或多边形,且边缘向外伸展,出现触角,边界逐渐变得不清晰,随着LPS 浓度增高,细胞形态变化越明显,结果见图1。
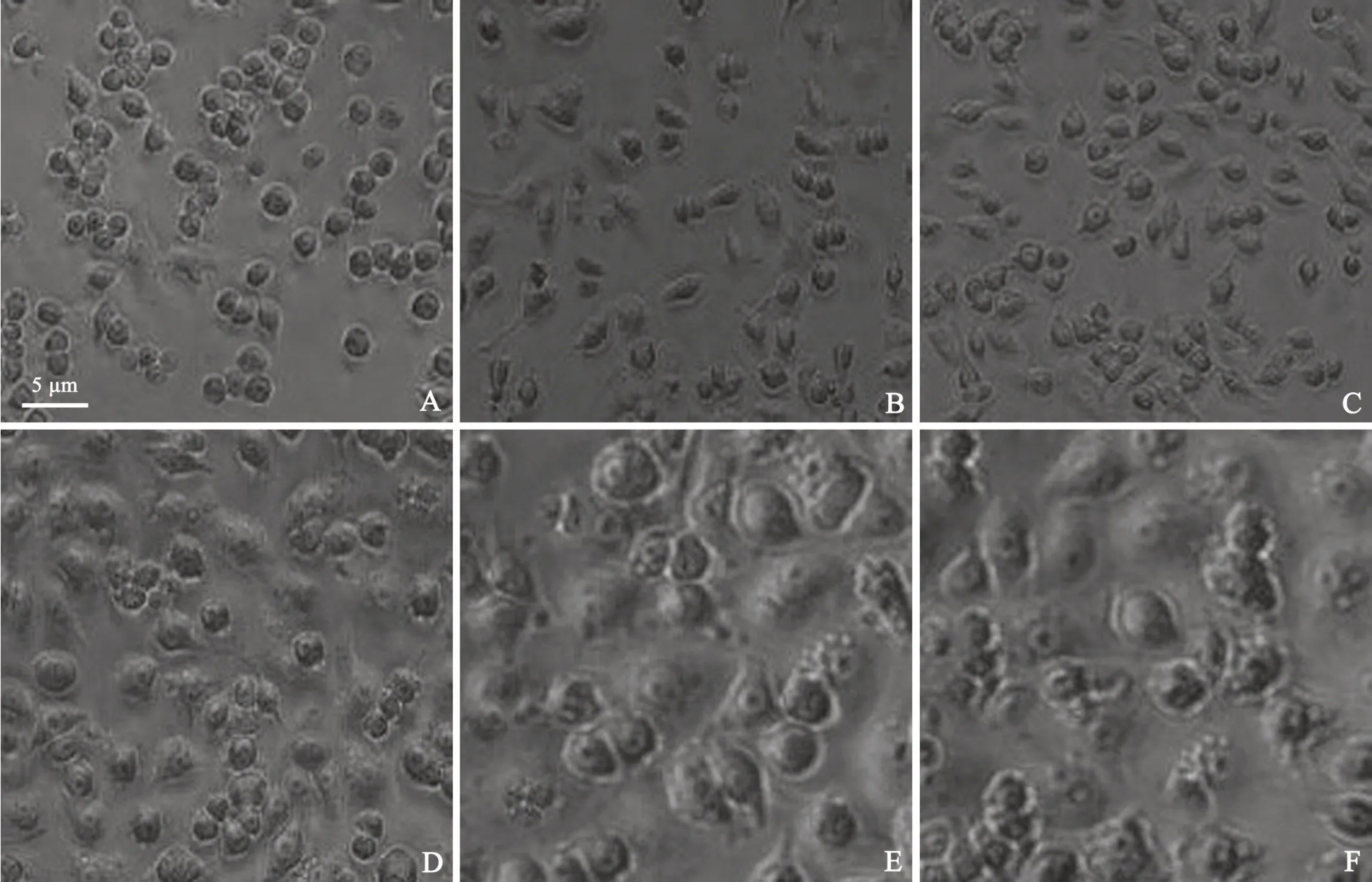
图1 不同浓度LPS 对RAW264.7 细胞24h 后形态的变化A:对照组B: LPS,1.0 µg/ml C: LPS,2.0 µg/ml D: LPS,5.0 µg/ml E: LPS,10.0 µg/ml F: LPS,25.0 µg/mlFig.1 The morphological changes of RAW264.7 cells 24h after stimulating by different concentrations of LPS A: Control; B: LPS,1.0 µg/ml; C: LPS,2.0 µg/ml; D: LPS,5.0 µg/ml; E: LPS,10.0 µg/ml; F: LPS,25.0 µg/ml
2.1.3 LPS 对NO 的表达的影响 RAW264.7 细胞在1.0、2.0、5.0、10.0、25.0 µg/ml 的LPS 刺激细胞24 h 后会释放促炎因子NO,NO 的含量较空白对照组极显著增加(P<0.001),且呈现出明显的剂量依赖性,其中1.0 µg/ml 的LPS 刺激下,NO 的表达量可以显著增加1.16 倍。
2.1.4 LPS 诱导RAW264.7 的细胞炎症模型的确定根据上述实验结果以及结合细胞活力、形态、状态变化及NO 表达结果,选取1µg/mL 的LPS 刺激RAW264.7 细胞24 h,建立炎症反应模型。
2.2 赪桐乙酸乙酯部位及其流份对细胞活性的影响
2~0.06 mg/ml 的赪桐乙酸乙酯部位及流份分别作用RAW264.7 细胞24、48 h,结果表明:随着浓度的增高,培养时间越长,赪桐乙酸乙酯部位及其洗脱流份对细胞活力的抑制作用越强,浓度在0.5 mg/ml 以上具有明显的细胞毒性,而0.5 mg/ml 以下浓度对细胞活力具有增强作用(P<0.05),说明当为0.5 mg/ml及以下浓度时,给药浓度在安全范围内,可以用于对细胞进行研究,结果见表3。
表3 乙酸乙酯部位及其流份对细胞活性的影响 (,n=3)Tab.3 The influence of ethyl acetate fraction and its fraction on cell viability (Mean±SD, n=3)

表3 乙酸乙酯部位及其流份对细胞活性的影响 (,n=3)Tab.3 The influence of ethyl acetate fraction and its fraction on cell viability (Mean±SD, n=3)
注:ΔP<0.05,ΔΔP<0.01,ΔΔΔP<0.001 与空白对照组比较Note: ΔP<0.05,ΔΔP<0.01,ΔΔΔP<0.001 vs blank control group
2.3 赪桐乙酸乙酯部位及其流份对LPS 诱导RAW264.7 细胞分泌NO 和TNF-α 的影响
与空白对照组比较,模型组的NO 的分泌量显著增加,这是巨噬细胞产生炎症的表现。与模型组相比:乙酸乙酯高剂量组、中剂量组均能显著的降低炎症因子NO 和TNF-α 的分泌;赪桐二氯甲烷-甲醇(50:1)洗脱部位高、中、低剂量组可以显著抑制NO 和TNF-α 的分泌;赪桐二氯甲烷-甲醇(30:1)洗脱部位和二氯甲烷-甲醇(20:1)洗脱部位的高、中剂量均有抑制作用;而赪桐二氯甲烷-甲醇(70:1)洗脱部位和赪桐二氯甲烷-甲醇(10:1)洗脱部位的高剂量组可以显著抑制(P<0.05)。低剂量有抑制趋势但与模型组比较没有显著差异,结果见表4。
表4 对LPS 诱导RAW264.7 细胞分泌TNF-a 的影响 (,n=4)Tab.4 Effect on LPS-induced TNF-a secretion in RAW264.7 cells (Mean± SD, n=4)

表4 对LPS 诱导RAW264.7 细胞分泌TNF-a 的影响 (,n=4)Tab.4 Effect on LPS-induced TNF-a secretion in RAW264.7 cells (Mean± SD, n=4)
注:ΔΔP<0.01,ΔΔΔP<0.001 与空白对照组比较;*P<0.05,**P<0.01,***P<0.001 与模型对照组比较Note: ΔΔP<0.01,ΔΔΔP<0.001 vs blank control group;*P<0.05,**P<0.01,***P<0.001 VS model control group
2.4 赪桐乙酸乙酯部位及其流份对LPS 诱导RAW264.7 细胞分泌IL-6、IL-12 和IL-1β 的影响
与空白对照组比较,在LPS 的诱导下,模型组的的分泌量显著IL-6、L-12 和IL-1β 增加。加入赪桐乙酸乙酯部位及其流份干预后,IL-6、L-12 和IL-1β 的分泌量得到明显的减少,与模型组相比:赪桐乙酸乙酯高剂量组、中剂量组能显著的降低炎症因子IL-6、L-12 和IL-1β 的分泌,而低剂量有抑制作用但没有显著差异;赪桐二氯甲烷-甲醇(50:1)洗脱部位的高、中、低剂量组可以极显著抑制IL-6、L-12 和IL-1β 的分泌;二氯甲烷-甲醇(30:1)洗脱部位和二氯甲烷-甲醇(20:1)洗脱部位的高、中剂量均能显著抑制IL-6、L-12 和IL-1β 的分泌,低剂量有抑制作用但没有显著差异;而赪桐二氯甲烷-甲醇(70:1)洗脱部位、二氯甲烷-甲醇(10:1)洗脱部位的高剂量组、中剂量组可以显著抑制(P<0.01),低剂量有抑制趋势但与模型组比较没有显著差异。结果见表5。
赪桐二氯甲烷-甲醇(70:1)洗脱部位高、中、低剂量组均能抑制炎症因子IL-12 的分泌;而赪桐二氯甲烷-甲醇(10:1)洗脱部位的高剂量组有显著差异,中剂量组具有抑制抑制作用但与模型组比较没有显著差异。赪桐二氯甲烷-甲醇(70:1)洗脱部位和赪桐二氯甲烷-甲醇(10:1)洗脱部位的高、中、低剂量组与模型组比较抑制炎症因子IL-1β没有显著差异。结果见表5。
表5 对LPS 诱导RAW264.7 细胞分泌IL-6、IL-12 和IL-1β 的影响 (,n=4)Tab.5 Effect on LPS-induced RAW264.7 cells to secrete IL-6,IL-12 and IL-1β(Mean±SD, n=4)

表5 对LPS 诱导RAW264.7 细胞分泌IL-6、IL-12 和IL-1β 的影响 (,n=4)Tab.5 Effect on LPS-induced RAW264.7 cells to secrete IL-6,IL-12 and IL-1β(Mean±SD, n=4)
注:ΔΔP<0.01,ΔΔΔP<0.001 与空白对照组比较;*P<0.05,**P<0.01,***P<0.001 与模型对照组比较Note: ΔΔP<0.01,ΔΔΔP<0.001 VS blank control group;*P<0.05,**P<0.01,***P<0.001 vs model control group
3 讨论
本研究以脂多糖(LPS) 诱导RAW264.7 作为炎症细胞模型,LPS 诱导激活RAW264.7 细胞分泌iNOS,iNOS 活化会直接催化NO 生成,NO 释放量明显升高,从而使得细胞释放重要的炎症标志因子TNF-a,而TNF-a在炎症网络中具有关键作用,是全身炎性反应的始动介质,可诱导IL-1、IL-6、IL-10、IL-1β 表达释放,使炎性损伤的级联效应放大,从而进一步加剧炎症反应[10-12]。
本研究结果显示,1µg/m L 的LPS 刺 激RAW 264.7 细胞后NO、TNF-a、IL-12、IL-6、IL-1β 炎症因子分泌显著增加,炎症模型成功。赪桐二氯甲烷-甲醇(50:1)洗脱部位(YSEJ50)高、中、低剂量都能显著抑制炎症因子的释放,二氯甲烷-甲醇(30:1)洗脱部位(YSEJ30)、二氯甲烷-甲醇(20:1)洗脱部位(YSEJ20)只有高、中剂量能炎症因子的释放,二氯甲烷-甲醇(70:1)洗脱部位(YSEJ70)、二氯甲烷-甲醇(10:1)洗脱部位(YSEJ10)只有高剂量能抑制炎症因子IL-12、IL-6、TNF-a 炎症因子释放,对NO 的分泌没有抑制作用。说明赪桐乙酸乙酯部位与其不同梯度二氯甲烷-甲醇洗脱部位抗炎机制是通过抑制NO、TNF-a、IL-12、IL-6、IL-1β 炎症因子的产生起作用。
赪桐乙酸乙酯部位及其不同极性洗脱部位抗炎机制是通过抑制NO、TNF-a、IL-12、IL-6、IL-1β 炎症因子的产生起作用,随着赪桐乙酸乙酯部位及其不同极性洗脱部位药物浓度越大,炎症因子分泌越少,有剂量依赖性,赪桐二氯甲烷-甲醇(50:1)洗脱部位和二氯甲烷-甲醇(30:1)洗脱部位的抗炎能力较大。本实验研究赪桐乙酸乙酯部位及其二氯甲烷-甲醇(70:1)、二氯甲烷-甲醇(50:1)、二氯甲烷-甲醇(30:1)、二氯甲烷-甲醇(20:1)、二氯甲烷-甲醇(10:1)梯度洗脱部位对LPS 诱导的细胞体外炎症的抗炎作用,而未涉及到体内抗炎作用研究,如果结合体内外实验研究抗炎作用,可更深入筛选出抗炎最强的有效部位(流份)。研究从赪桐对LPS 诱导的RAW264.7 巨噬细胞炎症入手,可以进一步研究赪桐对急、慢性炎症的影响,挖掘壮药赪桐药材新的治疗作用。
