顺阿曲库铵对肺腺癌细胞A549的影响
2022-12-28闪雅惠邓梅毓郭志青雷雪超梁国彩
闪雅惠,邓梅毓,郭志青,雷雪超,梁国彩
(河北北方学院附属第一医院呼吸与危重症医学科,河北 张家口 075000)
肺癌是导致癌症相关死亡的主要原因之一,其发病率和病死率近年来不断增加[1]。其中,非小细胞肺癌是最常见的肺癌组织学类型,占肺癌的84%,主要包括肺鳞状细胞癌和肺腺癌两种亚型[2]。根治性切除被认为是早期肺腺癌的首选治疗方法,但仍存在一定的复发风险以及远处转移[3]。近年来,越来越多的癌症患者接受手术和麻醉以治疗癌症和控制疼痛[4]。顺阿曲库铵(cisatracurium,Cisat)是一种新开发的非去极化肌松药,已广泛应用于临床麻醉。Cisat的松弛强度为阿曲库铵的4~5倍,具有疗效好、毒性低、代谢不依赖肝肾等特点,已成为最理想的肌松药[5]。最近研究发现,Cisat在癌症的发展进程中发挥着重要作用,Yang等[6]研究证实Cisat对乳腺癌细胞的增殖、侵袭和迁移具有抑制作用;Xia等[7]的研究结果证明Cisat可通过抑制TGF-β/SMAD2/3信号通路的激活从而抑制结肠癌进展。但是,对于Cisat在肺腺癌进展中的作用目前尚不清楚。因此,本研究主要探讨Cisat对肺腺癌A549细胞增殖、凋亡及侵袭能力的影响,以期为临床肺癌的治疗提供参考。
1 材料与方法
1.1 主要试剂
Cisat(批号:20200810)购自江苏东英药业有限公司;结晶紫、CCK-8试剂盒、线粒体膜电位(mitochondrial membrane potential,MMP)检测试剂盒(JC-1)购自美国sigma公司;RPMI 1640培养基(批号:22400097)、FBS(批号:12664025C)购自赛默飞世尔科技(中国)有限公司;caspase-3(批号:ab184787)、caspase-9(批号:ab184786)、Bax(批号:ab32503)、Bcl-2(批号:ab32124)、纤连蛋白(批号:ab268020)和GAPDH(批号:ab181602)抗体购自英国Abcam公司;抗波形蛋白(批号:bs-8533R)、血管内皮生长因子(vascular endothelial growth factor,VEGF)(批号:bs-34032R)、c-Myc(批号:bs-4963R)、p21(批号:bsm-60698R)抗体购自北京博奥森公司;辣根过氧化物酶标记的山羊抗兔IgG(批号:ZB-2301)购自北京中杉金桥公司;Transwell小室(带基质)购自美国BD公司;Annexin V-FITC细胞凋亡检测试剂盒购自上海碧云天公司。
1.2 细胞培养
人肺腺癌细胞系A549购自中国科学院典型培养物保藏委员会细胞库(上海),将细胞置于含10% FBS、100 U/mL青霉素和100 g/mL链霉素的RPMI 1640培养基中,于37 ℃、含5%CO2的湿润条件下培养。
1.3 CCK-8法检测细胞活力
将A549细胞以1×103个/孔的密度接种到96孔板中,加入不同浓度(1.25 μmol/L、2.5 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L、40 μmol/L、80 μmol/L、160 μmol/L、320 μmol/L)的Cisat。培养24 h后,加入10 μL的CCK-8溶液,37 ℃孵育2 h,酶标仪读取450 nm波长处的OD值。计算细胞存活率,细胞存活率=(加药组细胞OD值/0 μmol/L细胞OD值)×100%。每组设3个复孔,实验重复3次。
1.4 克隆形成实验检测细胞增殖能力
将Cisat 20 μmol/L、40 μmol/L和80 μmol/L孵育的A549细胞稀释后缓慢加入并分散于细胞培养板上。培养14 d后,PBS洗涤细胞2次,甲醇固定细胞,0.1 %结晶紫染色。然后对可见菌落进行计数。
1.5 Annexin-V/PI法检测细胞凋亡
将Cisat 20 μmol/L、40 μmol/L和80 μmol/L孵育的A549细胞用PBS调整细胞浓度为5×105个/孔,并接种至12孔板,分别加入5 μL Annexin V-FITC和10 μL PI染色液,室温避光孵育15 min,使用BD FACSAria Ⅱ流式细胞仪对样品进行分析,Flow Jo 7.6软件分析结果。
1.6 流式JC-1检测MMP[8]
将Cisat 20 μmol/L、40 μmol/L和80 μmol/L孵育的A549细胞用PBS调整细胞浓度至1×106/mL,加入终浓度为10 μg/mL的JC-1,于37 ℃细胞培养箱内孵育20 min,每隔5 min颠倒混匀,PBS洗涤3次,使用BD FACSAria Ⅱ流式细胞仪对样品进行分析,激发波长为488 nm,用Flow Jo 7.6软件分析结果。
1.7 Western blot检测蛋白表达
将Cisat 20 μmol/L、40 μmol/L、80 μmol/L处理的A549细胞用RIPA裂解缓冲液提取总蛋白。BCA测定蛋白浓度并调平,十二烷基硫酸钠聚丙烯酰胺凝胶电泳(80 V,40 min;120 V,1 h)分离蛋白,并将其转移到聚偏二氟乙烯(PVDF)膜上。用5%的脱脂牛奶在TBST中封闭2 h后,加入一抗caspase-3、caspase-9、c-Myc、p21、Bax、Bcl-2、VEGF、纤连蛋白和波形蛋白(均按1∶1 000的比例稀释),于4 ℃孵育过夜,TBST洗膜后加入辣根过氧化物酶标记的二抗(1∶3 000),37 ℃孵育1 h,洗膜后ECL曝光成像并用Image J软件分析蛋白条带的灰度值。
1.8 Transwell侵袭实验检测细胞侵袭能力
细胞侵袭通过涂有基质的Transwell小室确定。在无血清培养基中,将Cisat 20 μmol/L、40 μmol/L、80 μmol/L孵育的A549细胞以2×104个/孔的密度接种到Transwell的上室中。Transwell的下室装有含10% FBS的RPMI 1640培养基。37 ℃下孵育48 h后,用棉签剥离Transwell顶部未侵袭的细胞,而Transwell下部的侵袭细胞则用4%多聚甲醛固定20 min,然后用1%结晶紫染色15 min。在光学显微镜(Olympus)下随机选择5个区域对入侵的细胞进行计数。
1.9 统计学分析
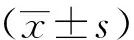
2 结果
2.1 不同浓度的Cisat对A549细胞活力的影响
A549细胞活力随Cisat浓度的增加而降低,Cisat浓度为0 μmol/L时,A549的细胞活力为100%,Cisat浓度为40 μmol/L时,A549细胞活力显著下降(P<0.05),见图1。因此,选择0 μmol/L、20 μmol/L、40 μmol/L和80 μmol/L Cisat进行后续实验。
*:与0 μmol/L相比,P<0.05
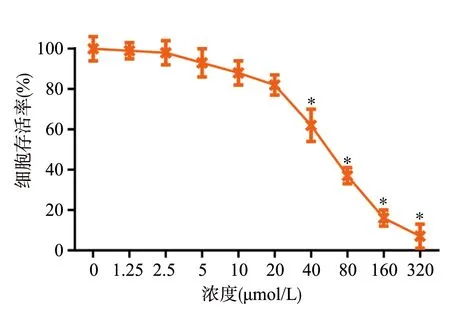
2.2 Cisat对A549细胞克隆形成的影响
与Cisat 0 μmol/L组相比,Cisat 40 μmol/L组和Cisat 80 μmol/L组A549细胞克隆形成率显著降低(P<0.05),而Cisat 20 μmol/L组无明显变化(P>0.05),见图2。
a:克隆形成实验检测A549细胞增殖;b:各组细胞克隆形成率统计 *:与Cisat 0 μmol/L组相比,P<0.05
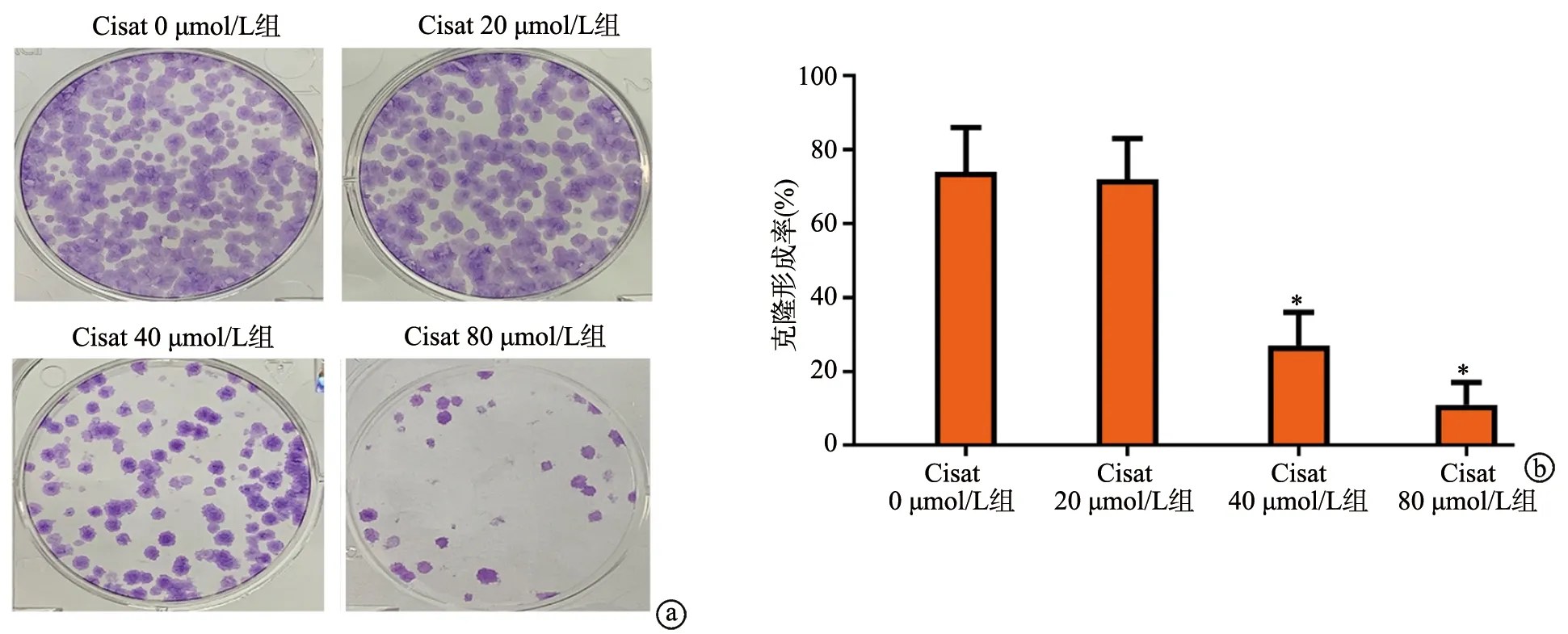
2.3 Cisat对A549细胞凋亡的影响
与Cisat 0 μmol/L组相比,Cisat 40 μmol/L组和Cisat 80 μmol/L组细胞凋亡率显著升高(P<0.05),而Cisat 20 μmol/L组无显著变化(P>0.05),见图3a。Cisat 0 μmol/L组JC-1红绿荧光比值接近100%,与之相比,Cisat 20 μmol/L组红绿荧光比值无明显变化,Cisat 40 μmol/L组和Cisat 80 μmol/L组JC-1红绿荧光比值明显降低,即MMP显著降低,见图3b。
a:流式细胞术检测细胞凋亡;b:JC-1检测细胞MMP *:与Cisat 0 μmol/L组相比,P<0.05
2.4 Cisat对A549细胞凋亡相关蛋白表达的影响
与Cisat 0 μmol/L组相比,Cisat 40 μmol/L组和Cisat 80 μmol/L组cleaved caspase-3/caspase-3、cleaved caspase-9/caspase-9、Bax/Bcl-2比值及p21的表达均显著上调(P<0.05),c-Myc的表达显著下调(P<0.05),而Cisat 20 μmol/L组无显著变化(P>0.05),见图4。
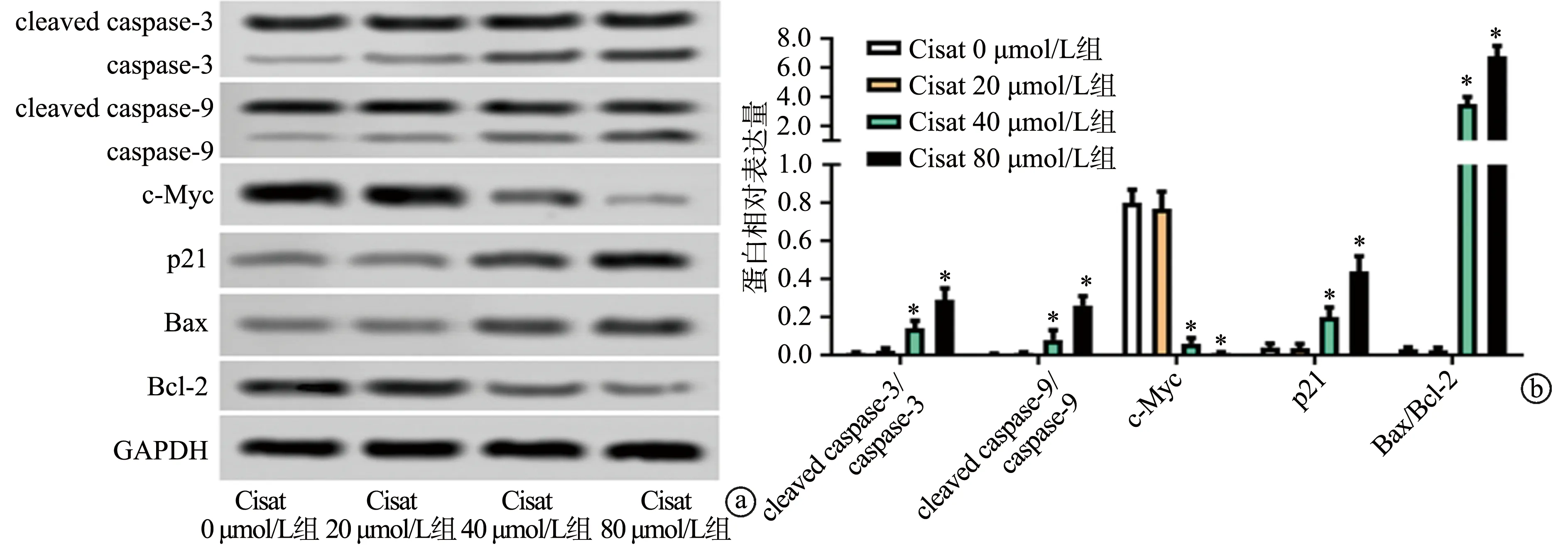
a:Western blot检测各组细胞中凋亡相关蛋白的表达;b:各组蛋白相对表达量统计 *:与Cisat 0 μmol/L组相比,P<0.05
2.5 Cisat对A549细胞侵袭能力的影响
与Cisat 0 μmol/L组相比,Cisat 20 μmol/L组细胞侵袭数无显著变化(P>0.05),Cisat 40 μmol/L组和Cisat 80 μmol/L组细胞侵袭数目显著减少(P<0.05),见图5a、b。与Cisat 0 μmol/L组相比,Cisat 20 μmol/L组VEGF、纤连蛋白和波形蛋白的表达无明显变化(P>0.05),Cisat 40 μmol/L组和Cisat 80 μmol/L组VEGF、纤连蛋白和波形蛋白的表达均显著下调(P<0.05),见图5c、d。
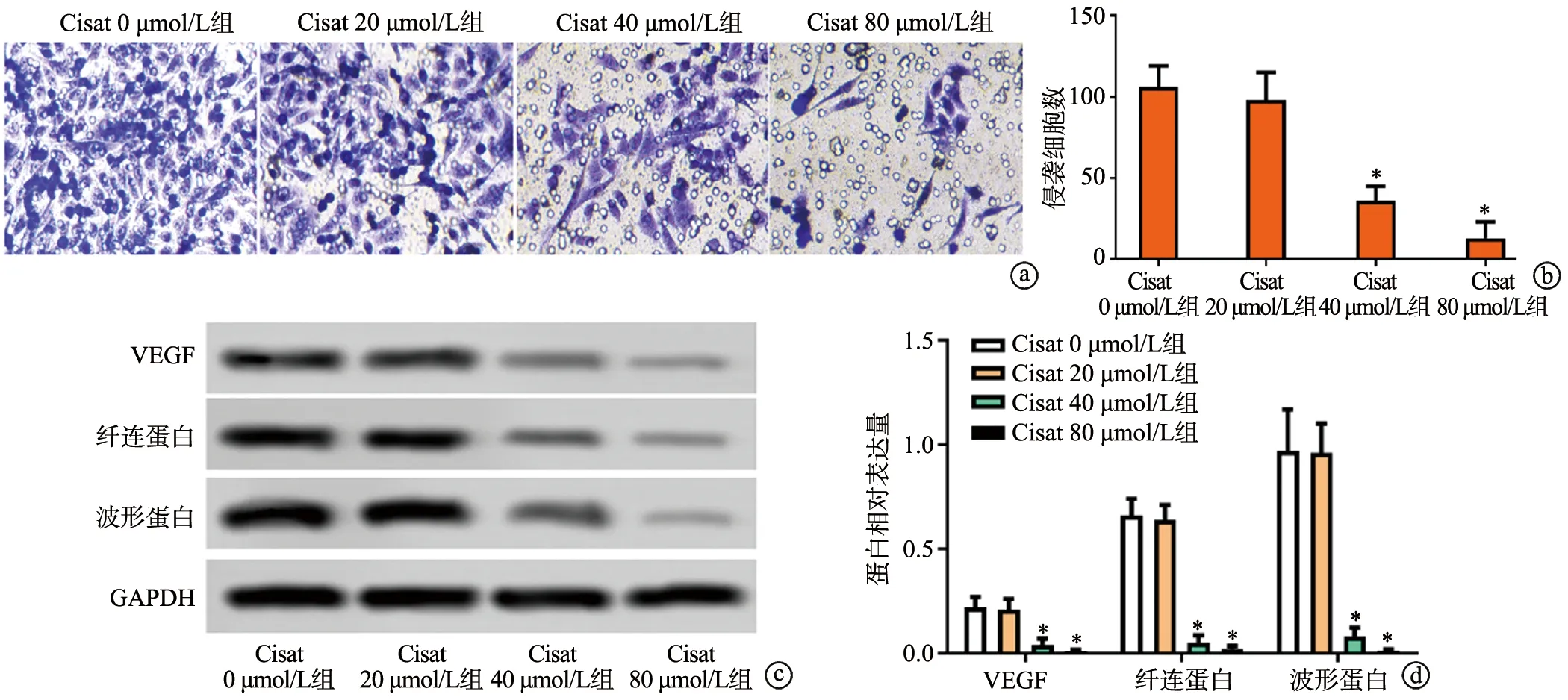
a:Transwell检测细胞侵袭能力(×200);b:各组侵袭细胞数统计;c:Western blot检测VEGF、纤连蛋白和波形蛋白的表达;d:各组蛋白相对表达量 *:与Cisat 0 μmol/L组相比,P<0.05
3 讨论
肺腺癌的治疗方案通常为手术切除辅以化疗,但残留的癌细胞可能导致术后复发和转移的发生率变高,是患者死亡的主要原因[9]。这些残留癌细胞的生存和进展取决于多种协同围术期因素,其中包括麻醉药和止痛药[10]。因此,优化手术和麻醉策略至关重要,这可能是减少手术切除后肺癌复发的关键。Cisat是一种非去极化的肌松药,通常用于需要有效骨骼肌麻痹的手术中。有研究证明,Cisat可显著抑制人卵巢癌OVACR-3细胞的增殖、迁移和侵袭,并诱导细胞凋亡[5]。本研究结果显示,A549细胞活力随着Cisat浓度的增加逐渐降低,Cisat浓度在40 μmol/L及以上时,A549细胞活力明显降低,因此,高浓度Cisat可抑制肺癌细胞活力。
MMP的下降是细胞早期凋亡的一个标志性事件。当MMP下降,线粒体膜通透性增加,细胞色素C释放到胞内后形成凋亡复合体,凋亡复合体通过招募并激活caspase-9,caspase-9进一步激活效应caspase-3和caspase-7,启动caspase级联反应,最终导致细胞凋亡[11]。据报道,c-Myc蛋白与肿瘤的发生有关,c-Myc过度表达对细胞增殖、存活、肿瘤血管生成和肿瘤转移有积极的调节作用,此外c-Myc还可介导细胞程序性凋亡的发生[12-13]。本研究结果显示,MMP随着Cisat浓度的增加而显著下降,且cleaved caspase-3/caspase-3、cleaved caspase-9/caspase-9表达上调,c-Myc表达明显下调。说明Cisat能够降低A549细胞MMP,从而引发细胞早期凋亡。
据报道,肿瘤抑制因子p21低表达是肿瘤发生的先决条件[14]。研究表明,激活p21表达可导致膀胱癌细胞中的G0/G1期细胞周期停滞[15]。Bcl-2家族蛋白是控制线粒体相关的凋亡因子释放的主要调节因子[16],促凋亡蛋白Bax与抗凋亡蛋白Bcl-2比值决定了细胞凋亡与否[17]。本研究中,Cisat浓度为40 μmol/L和80 μmol/L时细胞克隆形成率明显降低,p21表达及Bax/Bcl-2比值显著上调。说明Cisat可以抑制A549细胞的增殖并促进其凋亡。
上皮-间质转化(epithelial-mesenchymal transition,EMT)在肿瘤恶性转化中起关键作用,而纤连蛋白和波形蛋白是EMT的重要标志物[18]。VEGF是关键的血管生成因子,可使血管通透性增加,引起肿瘤血管中的蛋白外渗,有助于肿瘤生长、转移[19]。研究发现,Cisat可抑制食管癌细胞中的EMT[20]。本研究结果显示,Cisat显著下调了纤连蛋白、波形蛋白和VEGF的表达,表明Cisat可通过抑制A549细胞发生EMT阻遏肿瘤的侵袭和转移。
综上,本研究首次揭示了Cisat在抑制A549细胞增殖、侵袭、迁移和EMT以及诱导细胞凋亡中的重要作用,对于需要充分肌肉松驰或持续控制通气的肿瘤切除术,这些发现具有广阔的应用前景。然而,本研究仅使用单一的肺腺癌细胞系进行实验,未来还需要对更多的细胞系进行综合分析,以了解Cisat在肺癌中的作用。
