白细胞介素-4在小鼠急性肺损伤中的保护作用
2022-12-22赵琨肖云肖茗耀杨纯董敏娜向柄全
赵琨, 肖云**, 肖茗耀, 杨纯, 董敏娜, 向柄全
(1.昆明医科大学第三附属医院 重症医学科, 云南 昆明 650118; 2.昆明医科大学第一附属医院 急诊医学部, 云南 昆明 650032)
急性肺损伤(acute lung injury,ALI)是指感染、创伤等多种肺内外因素,直接或间接导致的以肺部炎症和通透性增加为主要表现的临床综合征。ALI和急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是连续的病理生理过程[1]。虽然近些年对于ALI的研究和治疗取得了一定的进展,但其发生率仍然较高,且缺乏特异性的治疗手段[2-3]。研究发现全身炎症反应是各种病因导致ALI的共同途径[4],主要因为炎症与抗炎反应的平衡被打破,导致肺部炎性损伤,因此纠正失衡的炎症反应,可能是ALI治疗的关键点[5]。细胞因子在介导和调节机体炎症反应中扮演重要角色,常见促炎细胞因子有肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素1(interleukin 1,IL-1)、IL-6、IL-8、干扰素γ(inerferon γ,IFN-γ)等,抗炎细胞因子有IL-4、IL-10及IL-13等[6]。IL-4是机体重要的抗炎细胞因子之一,可通过抑制促炎细胞因子及炎症介质的表达,诱导巨噬细胞向M2型转化而发挥抗炎作用[7-8]。本研究前期发现,IL-4具有抑制炎症反应、降低细胞凋亡的作用,在ALI中可能具有正向调节作用,本研究通过建立ALI小鼠模型,观察IL-4对ALI小鼠的治疗作用及机制,报告如下。
1 材料与方法
1.1 实验动物及试剂
月龄7~8周的c57小鼠,体质量约20 g,IL-4细胞因子购自PeproTech,脂多糖(lipopolysaccharide,LPS)购自北京索莱宝公司,BCA蛋白定量检测试剂盒购自Beyotime,SureScriptTMFirst-Strand cDNA Synthesis Kit及BlazeTaqTMSYBR®Green qPCR Mix 2.0试剂盒均购自广州Genecopoeia公司,Caspase-3抗体购自CST,Bcl-2 抗体购自GeneTex,Anti-beta Actin抗体购自Abcam,Immobilon Western HRP Substrate Luminol Reagent购自Affinity,小鼠IL-1β、IL-6、IL-10、TNF-α ELISA试剂盒均购自NeoBioscience,小鼠IFN-γ ELISA试剂盒购自Abmart。
1.2 研究方法
1.2.1实验分组 取雄性c57小鼠36只,随机分为ALI组、 ALI+IL-4治疗组和对照组,每组12只。ALI组和ALI+IL-4治疗组小鼠腹腔注射LPS 10 μg/只[9],建立小鼠ALI模型,对照组注射等体积的生理盐水。ALI+IL-4治疗组于30 min后腹腔注射IL-4 10 μg/kg[10],此时,ALI组和对照组均腹腔注射等体积生理盐水。3组小鼠均在完成注射后的12 h及24 h分别选取6只小鼠行眼球采血并颈椎脱臼法处死。
1.2.2细胞因子检测 小鼠眼球采血0.5 mL、采集的血液离心后收集上清液,根据IL-1β、IL-6、IL-10、TNF-α、IFN-γ不同细胞因子配制相应浓度梯度的标准液,将标准液及上述待测上清液加入相应的预包被 ELISA 试剂盒, 37 ℃孵育1 h,清洗后加入TMB底物,37 ℃放置30 min后加入停止液。使用酶标仪测定各孔450 nm波长处吸光度,根据标准液浓度及其OD450 nm绘制标准曲线,并测算小鼠血清中IL-1β、IL-6、IL-10、TNF-α、IFN-γ浓度。
1.2.3肺泡灌洗液蛋白含量测定 处死小鼠后,T字形剪开胸部皮肤,暴露胸腔,结扎气管和右肺后,使用PBS 1 mL分3次对左肺进行肺泡灌洗,重复灌洗3遍,回收灌洗液离心吸取上清液测定体积并备用;重悬细胞沉淀进行细胞计数,若细胞数为109个/L,则认为灌洗液合格。配制0~1 g/L的梯度浓度蛋白标准液,并将待测的肺泡灌洗上清液及各浓度蛋白标准液加入96孔板中,最后按说明书加入BCA蛋白定量检测试剂,37 ℃恒温箱孵育30 min,测定各孔OD562 nm。根据蛋白标准液浓度及其OD562 nm绘制蛋白浓度标准曲线,计算肺泡灌洗液中的蛋白浓度,通过肺泡灌洗液蛋白浓度反映小鼠肺部炎性渗出程度、间接评估小鼠肺损伤程度。
1.2.4细胞凋亡相关基因及蛋白 处死小鼠后,取小鼠右肺下叶组织,检测Caspase3、Bcl-2 基因mRNA及蛋白的表达。提取小鼠肺组织的总RNA,使用总RNA反转录得到cDNA,根据NCBI基因数据库的转录组序列,合成Caspase3、Bcl-2以及内参GAPDH的引物,通过荧光实时定量聚合酶链式反应(real time quantitative polymerase chain reaction,RT-qPCR)检测Caspase3及Bcl-2 mRNA相对表达量;提取小鼠肺组织总蛋白,总蛋白经过电泳、转膜、膜封闭后,分别加入Caspase3、Bcl-2、β-actin一抗,4 ℃过夜孵育后加入二抗孵育,以ECL发光试剂成像,以β-actin为内参,对比各组Caspase3、Bcl-2蛋白的表达。
1.3 统计学分析

2 结果
2.1 血清细胞因子检测
与对照(Control)组比较,ALI组中IL-β分泌量虽然有所增加,但差异无统计学意义(P>0.05),而IL-6、IL-10、TNF-α、IFN-γ的分泌量均明显增加,且差异具有统计学意义(P<0.05),以上结果表明ALI会导致细胞因子分泌量增加,引发炎症反应。而在ALI+IL-4组与ALI组的比较中,除IL-10在12 h时分泌量高于ALI组外(P<0.05),ALI+IL-4组其余细胞因子的分泌量均低于ALI组(P<0.05),以上结果表明,采用IL-4治疗可以降低ALI小鼠中各类炎症细胞因子的分泌量,减轻炎症反应。见图1。

注:图A、B、D、E,(1)与12 h-Control组比较,P<0.05;(2)与24 h-Control组比较,P<0.05;(3)与12 h-ALI组比较,P<0.05;(4)与24 h-ALI组比较,P<0.05;图C,(1)与24 h-Control组比较,P<0.05;(2)与12 h-ALI组比较,P<0.05;(3)与24 h-ALI组比较,P<0.05。图1 ELISA检测小鼠血清中TNF-α、IFN-γ、IL-1β、IL-6、IL-10含量Fig.1 Concentrations of serum TNF- α, IFN-γ, IL-1β, IL-6, and IL-10 by ELISA
2.2 肺泡灌洗液中蛋白含量
渗出液蛋白含量测定可作为评估肺泡-毛细血管屏障通透性的客观指标。与对照(Control)组比较,ALI组中肺灌洗液中的蛋白浓度升高,但差异无统计学意义(P>0.05),该结果表明ALI会增加肺泡-毛细血管屏障的通透性,加重肺部炎症反应。而采用IL-4治疗后,ALI小鼠肺灌洗液中蛋白浓度出现了下降,但差异也无统计学意义(P>0.05),结果表明IL-4治疗后降低肺泡-毛细血管屏障的通透性,减轻肺部炎症反应。见图2。

图2 BCA法检测各组小鼠肺灌洗液中的蛋白含量Fig.2 Protein concentrations of mouse lung lavage fluids in each group by BCA
2.3 细胞凋亡相关基因及蛋白表达
对肺组织凋亡相关基因及蛋白的表达情况分析结果显示,ALI组肺组织中Caspase3 mRNA和蛋白的表达量均升高,在24 h时差异具有统计学意义(P<0.05),而Bcl-2 mRNA和蛋白表达量在12 h和24 h时均出现了下降,差异具有统计学意义(P<0.05),以上结果表明ALI造成了肺组织细胞的损伤。而采用IL-4治疗后,可以明显降低ALI小鼠肺组织细胞中Caspase3 mRNA和蛋白的表达量(P<0.05),增加Bcl-2 mRNA和蛋白表达量(P<0.05),提示采用IL-4治疗后肺组织的损伤情况得到显著缓解。见图3、图4。
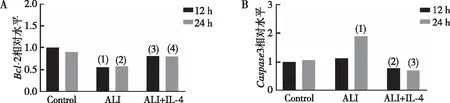
注:图A,(1)与12 h-Control组比较,P<0.05;(2)与24 h-Control组比较,P<0.05;(3)与12 h-ALI组比较,P<0.05;(4)与24 h-ALI组比较,P<0.05。图B, (1)与24 h-Control组比较,P<0.05;(2)与12 h-ALI组比较,P<0.05;(3)与24 h-ALI组比较,P<0.05。图3 qPCR检测小鼠肺组织中Caspase3、Bcl-2的表达Fig.3 The expression levels of Caspase3 and Bcl-2 in mouse lung tissues by qPCR

注:(1)与12 h-Control组比较,P<0.05;(2)与24 h-Control组比较,P<0.05;(3)与12 h-ALI组比较,P<0.05;(4)与24 h-ALI组比较,P<0.05。图4 Western blot法检测小鼠检测小鼠肺组织中Caspase3、Bcl-2蛋白表达Fig.4 Protein expression levels of Caspase3 and Bcl-2 in mouse lung tissues by Western blot
3 讨论
ALI是指感染、创伤等多种肺内外因素,直接或间接导致的以肺部炎症和通透性增加为主要表现的临床综合征[11];目前临床治疗措施主要为机械通气及药物治疗等,有研究表明,采用保护性呼吸机策略能在一定程度上帮助ALI/ARDS患者的治疗, 却无法有效降低其死亡率[4]。目前临床针对ALI仍缺乏特异性治疗,发病率及死亡率仍较高。
ALI的发病机制错综复杂,至今仍未完全阐明。目前认为全身炎症反应是各种病因导致ALI的共同途径[12]。机体在感染和创伤等应激状态下,多种炎性细胞、细胞因子释放,引起广泛性全身反应,同时反馈引起抗炎介质的释放,从而达到制衡炎症反应的目的。当二者之间的平衡被打破,则会导致全身炎症反应[13-14]。肺脏的病理改变主要是微血管病变、肺泡通透性增加、大量炎症细胞浸润和炎症介质的产生增加[15]。TNF-α直接损伤肺血管内皮细胞,同时可抑制Ⅱ型肺泡上皮细胞分泌肺泡表面活性物质。IL-1与TNF-α相似,同样是ALI中另一个重要的炎症介质;IL-6能够促进巨噬细胞的分化及浸润,同时上调黏附分子和其他细胞因子表达,从而加强炎症反应[16]。
IL-4是机体重要的抗炎细胞因子之一,大量研究表明,IL-4可通过下调机体促炎细胞因子,促使机体促炎及抗炎细胞因子恢复平衡[17]。本研究结果显示:与ALI组相比,ALI+IL-4治疗组中各促炎细胞因子在造模后12 h及24 h均明显下降,说明IL-4可通过下调促炎细胞因子水平来抑制肺部炎症反应。同时有研究表明,在IL-4敲除的小鼠 ALI 模型中,其发病进展及炎症反应远高于IL-4正常的小鼠模型,这表明IL-4在ALI过程中扮演重要角色[18]。另一研究也得出同样的结论,该研究通过移植分泌IL-4的巨噬细胞治疗ALI,结果表明在移植后,小鼠肺部炎症、组织损伤程度均明显减轻,ALI小鼠死亡率明显下降[19]。本研究结果表明:与ALI组相比,ALI+IL-4治疗组中Caspase3表达显著降低, Bcl-2的表达显著升高,治疗组小鼠死亡率明显下降。
ALI/ARDS另一重要病理生理改变为炎症反应导致肺泡-毛细血管通透性增高,富含蛋白的液体通过弥散机制向血管外和肺泡内移动,造成肺间质及肺泡水肿[20]。目前认为其机制主要为大量炎性细胞积聚于肺毛细血管,释放炎性介质、活性氧代谢产物和蛋白酶等物质,造成肺血管内皮细胞和肺泡上皮细胞损伤[21]。本研究通过测定小鼠肺泡灌洗液中蛋白含量来评估肺泡-毛细血管屏障通透性[22],结果显示:与对照组相比,ALI组中肺灌洗液中的蛋白浓度升高,ALI+IL-4治疗组肺灌洗液中蛋白浓度较ALI组降低,但未达到统计学差异。李维维等[23]研究发现:IL-4组小鼠肺泡灌洗液蛋白浓度明显减少,说明IL-4可以改善ALI小鼠肺毛细血管通透性。
综上,通过前期研究及动物实验,本研究发现IL-4可下调机体促炎细胞因子的分泌水平,调节炎症反应,减轻ALI肺部组织损伤,减轻毛细血管内皮细胞及肺上皮细胞损伤,因此在ALI中具有一定的保护作用。Wehrmann等[24]研究发现,IL-4 表达会降低常驻肺泡巨噬细胞产生的 TNF-α,从而减少肺部巨噬细胞的积累、炎症和肺泡毛细血管泄漏。段晓光等[25]也有研究表明,提高抗炎因子IL-4水平可有效减轻LPS诱导ALI大鼠的肺部炎症反应。因此,IL-4在ALI发生发展过程中可能具有一定的保护作用,具有进一步研究及探讨的价值。
