银杏黄酮的抑菌活性及机理
2022-12-20刘芮张文成
刘芮,张文成
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
食源性致病菌引起的食品安全问题严重危及人类生命安全[1]。大肠杆菌是一种条件致病菌,可引起肠道、膀胱、泌尿道等各种组织和器官的感染或全身播散性感染[2]。金黄色葡萄球菌最大的致病性来自于其产生的高度耐药的肠毒素,其会引起食物中毒[3]。此外,金黄色葡萄球菌感染会导致白细胞和巨噬细胞的破坏和免疫功能的下降[4]。丙二酸盐克罗诺杆菌为罗诺杆菌属(Cronobacter spp.),属于革兰氏阴性菌,是一种治愈率极低、致死性极强的食源性致病菌,尤其易感染新生儿[5]。食源性致病菌引起的食物中毒日益严重和普遍,开发相应的防腐剂显得尤为重要。其中,人工合成防腐剂及其副产品可能会引发人体器官功能障碍,存在损害人体健康的风险。因此,研究开发天然食品防腐剂成为一个重要课题[6]。相关学者对天然物质的抗菌保鲜活性进行了大量的基础理论和应用研究[7-9]。
银杏(Ginkgo biloba L.,GBL),作为我国传统的药食同源植物,含有多种活性成分,包括黄酮类、内酯类、酚类、萜类、多糖等活性物质[10]。研究表明银杏黄酮化合物具有广谱抑菌效果,对细菌、真菌都有不同程度的抑制作用。作为天然物质的银杏黄酮化合物对人体没有毒副作用并且具有预防心脑血管疾病、糖尿病等生理功效[11],在国外已被用作食品添加剂[12]。然而,植物中黄酮类化合物含量低,纯化工艺复杂,产量低,纯度低,限制了黄酮类化合物的开发应用[6]。本研究采用大孔树脂纯化银杏黄酮提取物,以提高其抑菌活性。通过测定最小抑菌浓度(minimum inhibitory concentrations,MIC)和最小杀菌浓度(minimum bactericidal concentration,MBC),比较纯化前后银杏黄酮提取物对致病菌的抑菌活性,并探讨其可能的抑菌机理,以期为开发安全、高效、广谱的天然植物源防腐剂提供数据支撑。
1 材料与方法
1.1 材料和试剂
银杏黄酮提取物:合肥拓峰生物有限公司;NKA-9大孔树脂:郑州和成新材料科技有限公司;黄酮标准品(槲皮素、山奈酚、异鼠李素):北京北方伟业计量技术研究院;金黄色葡萄球菌[CMCC(B)26003]、大肠杆菌(CMCC 44102):中国菌种保存中心保存;丙二酸盐克罗诺杆菌(LMG 23826):合肥工业大学食品与生物工程学院微生物实验室保存;甲醇(色谱级):德国默克公司;LB肉汤培养基、LB琼脂培养基:杭州微生物试剂有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO)、无水乙醇(均为分析纯):国药集团化学试剂有限公司;磷酸盐缓冲溶液(phosphate buffered saline,PBS,分析纯):赛默飞世尔科技(中国)有限公司;四环素(分析纯):上海易恩化学技术有限公司;碱性磷酸酶(alkaline phosphatase,AKP)活性测定试剂盒:南京建成生物工程研究所;2,7-二氯荧光素二醋酸酯(分析纯):北京百奥莱博科技有限公司。
1.2 仪器与设备
AL204分析天平:梅特勒-托利多仪器(上海)有限公司;1260液相色谱仪:美国安捷伦公司;Varioskan Flash全波长扫描酶标仪:美国Thermo公司;ZHJH-C超净工作台:上海智诚分析仪器制造有限公司;KQ-300E超声波清洗器:昆山市超声仪器有限公司;TG16-WS离心机:湖南湘立科学仪器有限公司;Regulus 8230高分辨率场发射扫描电镜:日本日立公司;FLS980荧光分光光度计:英国爱丁堡仪器有限公司。
1.3 方法
1.3.1 银杏黄酮提取物的纯化
用乙醇溶解银杏黄酮提取物配成0.8 mg/mL的溶液,用2 mol/L的盐酸调节溶液的pH值为5。将100 mL预处理后的NKA-9大孔树脂湿法装柱到玻璃层析柱(500mm×25mm)中。将550mL银杏黄酮提取物溶液以1mL/min的流速加入层析柱中,吸附完全后,用100mL蒸馏水洗去水溶性杂质。以70%乙醇溶液作为洗脱剂,洗脱层析柱,直至流出的洗脱液为无色。收集洗脱液,浓缩干燥后得到银杏黄酮纯化物,采用硝酸铝比色法[13]测得总黄酮含量从20.69%提高到56.42%。
1.3.2 高效液相色谱分析
采用高效液相色谱法对样品进行测定。采用C18柱(5 μm,4.6 mm ×150 mm),柱温为30℃,流动相为溶剂 A(0.1%甲酸水溶液)和溶剂 B(甲醇),体积比 1∶1,流速0.7 mL/min,检测波长360 nm。梯度洗脱条件:0~15 min 35%B、15 min~30 min 40%B、30 min~45 min 50%B、45 min~70 min 55%B。
1.3.3 MIC和MBC的测定
MIC和MBC采用二倍稀释法进行测定。用10%DMSO溶解银杏黄酮纯化物,配成浓度为7.2 mg/mL的纯化物溶液。取无菌96孔板,1号孔中加入100 μL纯化物溶液和100 μL LB肉汤培养基,2号~7号孔中分别加入 LB肉汤培养基100 μL。从1号孔吸取100 μL加到2号孔,再从2号孔中吸取100 μL加入3号孔,依次进行二倍稀释,从7号孔中吸取100 μL溶液弃去。随后,从每个孔中吸出10 μL悬浮液用致病菌菌液代替,使菌液的最终接种浓度为107CFU/mL。含有107CFU/mL浓度的菌液和四环素溶液培养物孔为作为阳性对照。另外用10%的DMSO溶剂作为阴性对照。96孔板在37℃培养24 h后测定OD600值,OD600值变化小于0.05的浓度即为MIC。从浓度高于MIC的孔中取100 μL培养液涂布于LB琼脂培养基平板上,37℃培养24 h,无菌落生长的最低浓度即为MBC。
1.3.4 细菌生长曲线测定
在无菌96孔板中,加入10 μL生长至对数期的3种致病菌菌液,再加入90 μL银杏黄酮纯化物溶液使最终浓度分别为1/4 MIC、1/2 MIC、MIC,对照组添加90 μL的LB肉汤培养基。每组设置3个平行,37℃孵育24 h,前12 h每小时测定OD600,24 h后再次测定OD600,绘制细菌生长曲线。
1.3.5 扫描电镜(scanning electron microscope,SEM)观察
扫描电镜观察操作参照Bajpai等[14]的方法。向对数期的致病菌菌液(107CFU/mL)加入最终浓度为MIC的银杏黄酮纯化物,37℃孵育8 h。8 500 r/min离心5 min,收集细菌沉淀,用无菌PBS洗涤2次。将细菌重悬于含2.5%戊二醛的溶液中,4℃孵育过夜以固定细胞。离心后分别用30%、50%、70%、80%、90%、100%的乙醇溶液每15 min进行梯度洗脱。干燥后,样品喷金。采用高分辨率场发射扫描电镜进行观察。
1.3.6 碱性磷酸酶活性测定
收集对数期的致病菌菌液,调节菌液浓度为107CFU/mL,8 500 r/min离心5 min收集细菌沉淀,用无菌PBS洗涤2次,使细菌重悬于无菌PBS中,加入最终浓度分别为MIC和MBC的银杏黄酮纯化物溶液,置于37℃下孵育24 h。每隔2 h离心(8 500 r/min,5 min)取上清液,用AKP测定试剂盒检测上清液中AKP活性。
1.3.7 活性氧检测
参考Dwivedi等[15]方法,对细胞内的活性氧(reactive oxygen species,ROS)进行检测,研究银杏黄酮化合物对致病菌细胞的氧化应激作用。将3种致病菌培养至对数中期,细胞浓度为107CFU/mL。将致病菌菌液与20 μmol/L的2,7-二氯荧光素二醋酸酯混合,在37℃下孵育1 h。6 000 r/min离心10 min收集细胞沉淀,去除细胞外多余的2,7-二氯荧光素二醋酸酯。用无菌PBS重悬细菌,加入到最终浓度为1/2MIC、MIC和MBC的银杏黄酮纯化物溶液中,37℃孵育12 h,使用荧光分光光度计检测荧光强度,参数设置为激发光波长495 nm,发射波长525 nm。
1.4 数据分析
试验重复3次,结果以平均值±标准差表示。数据处理以及作图使用 GraphPad Prism 8以及Microsoft Excel软件。p<0.05为差异显著。
2 结果与分析
2.1 纯化前后黄酮组分分析
银杏黄酮提取物、银杏黄酮纯化物以及标准品的高效液相色谱图见图1。
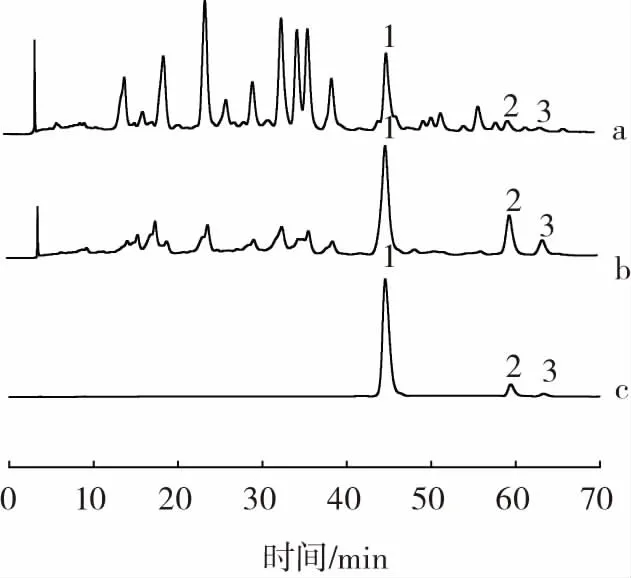
图1 银杏黄酮提取物、银杏黄酮纯化物以及标准品的高效液相色谱图Fig.1 High performance liquid chromatography image of flavonoid extraction and purified flavonoids from Ginkgo biloba L.and standard sample
如图1所示,槲皮素、山奈酚和异鼠李素的保留时间分别为 44.572、59.446、63.355 min,银杏黄酮提取物和银杏黄酮纯化物均检测出这3种组分。银杏黄酮提取物纯化前后的色谱图存在较大差异,通过对保留时间和峰面积进行分析,得到纯化前后3种主要的黄酮类化合物含量,见表1。

表1 纯化前后黄酮类化合物含量Table 1 Flavonoid content before and after purification
槲皮素、山奈酚和异鼠李素是黄酮类化合物中的黄酮醇类,也是抑菌活性很强的一类黄酮类化合物[16]。由表1可以看出,银杏黄酮纯化物中槲皮素、山奈酚、异鼠李素含量较纯化前显著增加(p<0.05),三者含量分别为51.77%、5.82%、1.54%。
2.2 抑菌活性
纯化前后银杏黄酮对3种致病菌的抑菌活性见表2。
由表2可知,银杏黄酮纯化物对3种致病菌的抑菌效果明显优于银杏黄酮提取物。银杏黄酮提取物对3种致病菌的MIC分别为0.900、1.800、1.800 mg/mL,MBC不小于3.600mg/mL。银杏黄酮纯化物对金黄色葡萄球菌的MIC和MBC分别为0.450mg/mL和0.900mg/mL,对于大肠杆菌和丙二酸盐克罗诺杆菌的MIC均为0.900 mg/mL,MBC均为1.800 mg/mL。阳性对照四环素作为一种革兰氏阴性菌(G-)抗生素,对大肠杆菌和丙二酸盐克罗诺杆菌的MBC较小,说明对G-的杀菌效果更强。通过比较3种致病菌,银杏黄酮化合物对于革兰氏阳性菌(G+)——金黄色葡萄球菌的抑菌效果更好,MIC和MBC均较其他两种致病菌小。银杏黄酮纯化物中山奈酚含量显著提高,相关研究发现,山奈酚对于G+尤其是金黄色葡萄球菌的抑制作用要强于G-,如Tajuddeen等[17]从植物中提取出的山奈酚对金黄色葡萄球菌的MIC仅为6.25 μg/mL。

表2 纯化前后银杏黄酮对3种致病菌的MIC和MBCTable 2 MIC and MBC of flavonoids from Ginkgo biloba L.against three pathogens before and after purification
2.3 细菌生长曲线
不同浓度的银杏黄酮纯化物对3种致病菌生长的影响见图2。
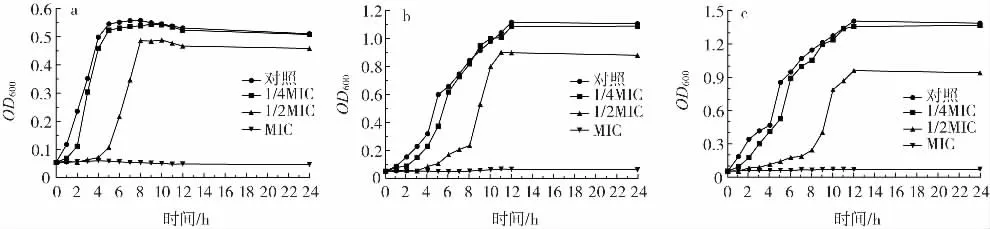
图2 不同浓度银杏黄酮纯化物作用下的致病菌生长曲线Fig.2 Growth curves of pathogens treated with different concentration of purified flavonoids from Ginkgo biloba L.
如图2所示,当银杏黄酮纯化物浓度为1/4MIC时,3种致病菌的迟缓期有所延长,但总体上仍保持典型的细菌生长曲线,与对照组无明显差别。当银杏黄酮纯化物浓度为1/2MIC时,细菌的生长受到一定程度的抑制,表现出较长的迟缓期,延迟了细菌进入稳定期的时间,且细菌数总量减小。经MIC浓度的银杏黄酮纯化物处理后,3种致病菌均被完全抑制且不再增殖。表明低浓度的银杏黄酮纯化物能延缓细菌的生长和繁殖。
2.4 扫描电镜
银杏黄酮纯化物处理后的3种致病菌扫描电镜图见图3。

图3 银杏黄酮纯化物处理前后致病菌的扫描电镜图Fig.3 SEM images of pathogens treated with different concentration of purified flavonoids from Ginkgo biloba L.
如图3所示,未处理的金黄色葡萄球菌(图3A)呈规则球状,表面光滑,边界清晰,而当MIC浓度的银杏黄酮纯化物处理8 h后(图3B)菌体表面存在凸起和凹陷,部分细胞破裂,内容物溢出,细胞边界模糊。正常大肠杆菌(图3C)呈规则的杆状,而经MIC浓度的银杏黄酮纯化物处理后菌体(图3D)呈现畸形凹陷,细胞形态完全破坏,大量细胞堆积在一起。丙二酸盐克罗诺杆菌在处理前(图3E)是饱满立体的,MIC浓度的银杏黄酮纯化物处理后,菌体细胞变短变细,绝大部分菌体出现萎缩凹陷,部分细胞出现干瘪或空洞,细胞形态完全被破坏。这种形态异常主要是由膜结构的破坏和内容物泄漏所导致的[18]。
2.5 AKP活性
银杏黄酮纯化物对致病菌AKP活性的影响见图4。
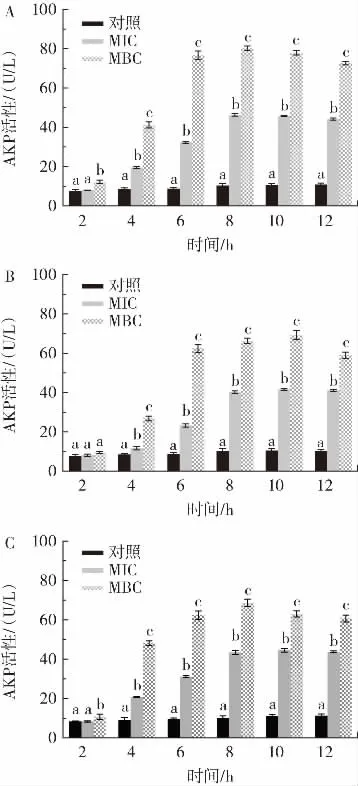
图4 银杏黄酮纯化物对致病菌AKP活性的影响Fig.4 Effect of purified flavonoids from Ginkgo biloba L.on AKP activity of pathogens
AKP仅存在于细胞壁和细胞膜之间,所以正常情况下胞外不能检测到AKP活性。致病菌菌液中AKP的活性可以反映细菌细胞壁的完整性[19]。如图4所示,与对照组相比,银杏黄酮纯化物处理4 h~12 h的3种致病菌菌液中的AKP活性均显著提高(p<0.05)。菌液中检测到的AKP活性在8 h~10 h时维持在较高水平,说明此时细胞壁破裂程度较大,有大量AKP泄漏到细胞外。银杏黄酮纯化物对3种致病菌的抑菌活性不同,金黄色葡萄球菌菌液中检测到的AKP活性最大值为80.338 U/L,而大肠杆菌和丙二酸盐克罗诺杆菌菌液中AKP活性最大值分别为69.255 U/L和68.676 U/L,这主要与G+(金黄色葡萄球菌)和G-(大肠杆菌和丙二酸盐克罗诺杆菌)细胞壁结构和组成的差异有关。G-具有双层外膜,脂多糖包裹的外膜对小分子物质的进出具有很大的阻碍。大多数小分子物质无法快速穿过G-的外膜,G-特殊的双膜结构可以保护其抵御抗菌物质的渗入[20-21]。从这个角度来看,G-的细胞壁外较厚的脂多糖外膜可以提供额外的保护,抵御胞外抗菌化合物的作用。
2.6 ROS分析
在不同浓度的银杏黄酮纯化物处理下,3种致病菌细胞内的ROS水平见图5。

图5 银杏黄酮纯化物处理后细胞内ROS水平Fig.5 Intracellular ROS level of purified flavonoids from Ginkgo biloba L.after treatment
研究表明,过量的外源性ROS可以损伤细胞内的DNA、RNA、脂质和蛋白质等,并且会引起细菌生长减缓[22-23]。如图5所示,对照组中,3种致病菌细胞内检测到的荧光强度为3 425~3 557,浓度为1/2MIC的银杏黄酮纯化物处理后,荧光强度变化不显著(p>0.05)。随着黄酮浓度的增大,荧光强度显著增强。在MIC和MBC浓度时,检测到的荧光强度分别为4 606~4 700和6 687~6 788,与对照组相比增加显著(p<0.05),说明经MIC浓度的银杏黄酮纯化物处理后便可引起致病菌细胞内ROS水平增长。在细胞中ROS水平突然增多时,通常都伴随着抗氧化系统活性的减弱[24],因此推测MIC浓度的银杏黄酮纯化物处理后的致病菌细胞内ROS水平升高,可能是由于黄酮类化合物抑制了抗氧化酶活性,从而使ROS增多,使得致病菌产生氧化损伤从而生长减缓。
3 结论
采用大孔树脂纯化银杏黄酮提取物,槲皮素、山奈酚、异鼠李素这3种黄酮化合物均得到明显的富集,含量分别提高到51.77%、5.82%和1.54%。银杏黄酮纯化物对3种致病菌均有明显的抑制作用,银杏黄酮纯化物抑菌效果较未纯化前增强,且对金黄色葡萄球菌的抑菌效果更好,MIC为0.450 mg/mL,MBC为0.900 mg/mL。通过抑菌机理试验表明,银杏黄酮纯化物能够破坏致病菌细胞形态,导致细胞活力丧失。银杏黄酮纯化物能明显提高细胞膜的通透性,破坏细胞壁和细胞膜的结构,使细菌细胞内容物泄漏。另外,银杏黄酮纯化物处理后的致病菌细胞内ROS水平升高,使致病菌细胞发生氧化损伤,致使细胞死亡。