右雷佐生对非蒽环类肿瘤心脏病的保护作用
2022-12-16伦静雯卢宇靖袁宇玺黎秋茹冯启荣赵海山
伦静雯,卢宇靖,袁宇玺,黎秋茹,冯启荣,赵海山
(广东工业大学1.生物医药学院、2.轻工化工学院,广东 广州 510006;3.广东省人民医院广东省医学科学院,广东 广州 510080)
迄今,癌症治疗的技术手段得到快速发展,全球大部分地区癌症死亡率呈下降趋势[1]。但多种化疗药物在治疗肿瘤的同时,也会造成正常细胞的损伤,引起多种化疗的不良反应,因此肿瘤治疗的预后成为主要的关注点。目前,已报道的化疗药物引起的毒性有多种,其中肿瘤心脏病(onco-cardiology),主要是指肿瘤诊疗过程中产生的心血管疾病[2]。肿瘤心脏病已成为影响肿瘤预后的因素,是癌症幸存者的一个重要问题[3],并且它导致的死亡风险已经超过癌症复发的风险[4-5]。因此,解决肿瘤心脏病的难题迫在眉睫。已知市面上有大量抗肿瘤药物具有心脏毒性,包括蒽环类、烷基化剂类、铂类、抗代谢类、抗微管剂类等[6-7]。右雷佐生(Dexrazoxane, Dex)作为FDA唯一批准可用于降低蒽环类化合物心脏毒性的药物[8],它是一种铁螯合剂,可去除铁,防止自由基的形成,诱导拓扑异构酶IIβ的快速降解[9]。但是,Dex对其他类型的肿瘤心脏病的研究并没有明确的报道。
动物模型是药物发现的基石,斑马鱼模型由于其与人类大部分基因组相同,同源性高达80%~90%,胚胎透明,可观察早期发育进程,具有非凡的繁殖速度,可进行高密度生长,成本低,能进行显微注射操纵基因表达等特点,常用于疾病的研究,尤其是心血管和代谢类疾病的研究[10-11]。本文通过早期斑马鱼胚胎模型评价非蒽环类抗肿瘤药物的急性毒性、整体动物形态、心脏功能,以确定5种非蒽环类抗肿瘤药物的疾病模型,为寻找治疗非蒽环类肿瘤心脏病的药物提供快速、高效的方法[12-13]。并且通过建立的疾病模型进一步探究Dex对非蒽环类抗肿瘤药物引起的肿瘤心脏病的保护作用,为Dex的进一步研究提供新的论据。
1 材料与方法
1.1 仪器Axio Observer A1型研究型倒置显微镜(ZEISS)、DHP-9012型恒温培养箱(上海一恒)、Stemi 508型体式显微镜(ZEISS)、Axio Imager.2型研究型正置显微镜(ZEISS)、KG-SX-500型灭菌锅(日本TOMY公司)、L500型医用离心机(湖南湘仪实验室仪器开发有限公司)、CO2细胞培养箱(美国Thermo公司)、TriStar2S型多功能酶标仪(BERTHOLD)
1.2 材料
1.2.1细胞株 H9C2传代细胞(大鼠心肌细胞系)来自广东工业大学生物医药研究院实验室冻存。
1.2.2试剂 Dex(D134376,97%,阿拉丁生化公司),顺铂(cisplatin, DDP,A2111110001,98%)、紫杉醇(paclitaxel, Taxol,A2007230001,100%)、5-氟尿嘧啶(5-fluorouracil,5-FU,A2108230002,99%)、硫酸长春新碱(vincristine sulfate, VCR,A2007230002,98%)和环磷酰胺(cyclophosphamide, CTX,A2108230001,97%)均够自广州优南科技有限公司,氯化钠(7647-14-5,99.5%,天津市大茂化学试剂厂),碳酸氢钠(144-55-8,99.5%,天津市大茂化学试剂厂),氯化钾(P112134,99.5%,阿拉丁生化公司),氯化钙(C110766,96.0%,阿拉丁生化公司),甲基纤维素(S14012)购自源叶生物,DMSO(Q5733)购自MP Biomedlcals,LLC,高糖DMEM培养基、胰蛋白酶和胎牛血清(FBS)均购自美国Gibco公司,CCK-8试剂盒(Cell Counting Kit,FC101-04)购自北京全式金生物技术有限公司。
1.2.3鱼系 Tg[myl7:EGFP]和Wild-type AB strain品系的成年斑马鱼(包含雄雌),鱼龄为6~12个月,两种鱼系均购于国家斑马鱼资源中心。
1.3 方法
1.3.1制备溶液 配制Holt buffer,分别将0.100 g KCl、7.000 g NaCl、0.235 g CaCl2和0.400 g NaHCO3置于装有1.900 L超纯水的烧杯中,并定容为2.000 L,待完全溶解后于121 ℃灭菌30 min,最后使用真空过滤器(孔径为0.22 μm)进行过滤,室温保存。Dex用DMSO溶解,配制为50 mmol·L-1的储备液,于-20 ℃冰箱避光保存。DDP、Taxol、VCR、CTX、 5-FU使用含0.6%DMSO的Holt buffer溶解至相对应的浓度,且以上5种溶液均采用现配现用的方式进行实验。
1.3.2获取早期斑马鱼胚胎 在实验前一天斑马鱼进食1 h后,选取健康的Tg[myl7:EGFP]或者Wild-type AB strain品系的成年斑马鱼置于交配缸中,用隔板将雄、雌鱼按1 ∶1分隔开。次日早上8 ∶00,让雄、雌鱼自由交配,并在1 h后收集胚胎。每个培养皿加入100颗发育正常的卵以及适量的Holt buffer,在温度为28.5 ℃的恒温培养箱中培养。
1.3.3早期斑马鱼急性毒性实验 挑选健康的受精24 h(hours post-fertilization,hpf) Wild-type AB strain斑马鱼胚胎置于24孔板中,每孔加入20颗卵,设置4组重复。每种化疗药物分别设置6个或以上浓度进行测试,以每孔1 mL相应浓度药液的体积量加入到孔板中,同时设置含体积分数为0.6%DMSO的Holt buffer为空白组。以胚胎心脏停止跳动为判定死亡的标准,在48、72、96 hpf时,对胚胎的存活状况进行统计。最后计算每种药物的胚胎96 hpf的LC50值。然后采用联合给药的方式,以化疗药物的LC50值为模型组浓度评价Dex的保护作用,联合不同浓度梯度的Dex(20、40、60、80、100 μmol·L-1)处理72 h,统计斑马鱼胚胎存活率。
1.3.4评价早期斑马鱼胚胎组织器官毒性和心脏功能 选取健康的24 hpf Tg[myl7:EGFP]的转基因斑马鱼胚胎置于24孔板,每孔放入15颗,设置4组重复,并用Holt buffer稀释DDP、Taxol、5-FU、VCR和CTX至相应浓度(LC50值),同时设置含0.6%DMSO的Holt buffer为空白组。待胚胎在72 hpf时,使用质量分数为4%的甲基纤维素将斑马鱼侧躺固定在载玻片上,置于研究型正置显微镜下进行拍照。使用录像系统记录每分钟心跳次数(heart rate, HR)。测量每条斑马鱼的1个心跳周期心脏的舒张和收缩末期的心室,计算收缩分数(fractional shortening, FS)、心室容积(stroke volume, SV)和心脏输出量(cardiac output, CO)。然后采用联合给药的方式,以Dex的最佳药效浓度评价对化疗药物的心脏功能的保护作用。每组选取8条斑马鱼进行统计。
1.3.5细胞急性毒性实验 采用高糖DMEM完全培养基将H9C2细胞以每孔6 000个的细胞密度接种于96孔板中,每孔加入100 μL培养基,设置5个复孔,然后将孔板置于培养箱中培养48 h。弃去培养基,以每孔100 μL药液加入孔板中,同时设置空白组,继续培养24 h,测量450 nm处的OD值,从而获得药物的毒性曲线。根据曲线,确定细胞活力值接近50%的药物浓度为造模浓度,先给予Dex预处理24 h,然后弃去培养基,加入相应浓度的药液,继续培养24 h,最后测定450 nm处的OD值,从而获得给药后的活力曲线。

2 结果
2.1 Dex在斑马鱼模型上的药效安全性根据经Dex处理24 h、48 h、72 h的斑马鱼胚胎存活率以及孵化率(Fig 1A、B),结果表明Dex的给药浓度为500 μmol·L-1以下时,胚胎的孵化率与空白组相比没有明显改变,说明此浓度范围不影响斑马鱼胚胎的发育周期。结合斑马鱼96 hpf的胚胎整体形态(Fig 1C),经400 μmol·L-1Dex处理72 h的斑马鱼胚胎出现轻微围心腔水肿,经300 μmol·L-1以下浓度的Dex处理72 h并未出现明显毒性。因此,确定Dex的安全浓度为300 μmol·L-1以下(包括300 μmol·L-1)。
2.2 非蒽环类抗肿瘤药物对斑马鱼胚胎急性毒性的影响为了评价Dex对DDP、Taxol、5-FU、VCR和CTX的保护作用,需确定它们对斑马鱼胚胎急性毒性的影响。结果显示,空白组的96 hpf斑马鱼胚胎存活率无明显变化。胚胎经不同梯度浓度的DDP、VCR、5-FU和CTX处理72 h后,各组胚胎存活率明显降低,其96 hpf斑马鱼胚胎的LC50见Tab 1,而Taxol在最大水溶解度下,其存活率与空白组相比并没有明显改变(Fig 2A)。
在探究5种药物对斑马鱼急性毒性的基础上,研究Dex对斑马鱼胚胎存活率的影响,结果如Fig 2B所示:只有DDP联合Dex处理后,胚胎的存活率明显上升,当Dex的浓度为40~100 μmol·L-1时差异有显著性(P<0.01),且Dex的浓度为80 μmol·L-1时达到最大药效浓度,LC50值达639.448 μmol·L-1(590.582~725.419 μmol·L-1)。而VCR联合Dex后,胚胎的存活率明显降低,加剧胚胎毒性。因此,Dex能降低DDP的急性毒性,不影响5-FU和CTX的急性毒性,加剧VCR的急性毒性。
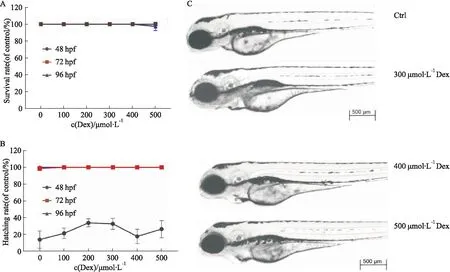
Fig 1 Effects of Dexrazoxane on survival rate, hatching rate and morphology of zebrafish

Tab 1 Acute toxicity LC50 value of 96 hpf zebrafish embryos
2.3 非蒽环类抗肿瘤药物对斑马鱼胚胎组织器官毒性的影响为了进一步评价Dex对DDP、5-FU、VCR和CTX的组织器官的保护作用,本研究对斑马鱼胚胎的主要组织器官进行观察。结果为,空白组斑马鱼胚胎发育正常,已脱壳孵化为幼鱼,心血管系统无形态学改变,心房和心室部分重叠,且心脏环化正常。与空白组相比,经438 μmol·L-1DDP处理48 h后,胚胎出现卵黄囊肿大、身体脊椎弯曲、小眼畸形、心脏轻微畸形、心室和心房容积减少,心房变小;经65 mmol·L-1的5-FU处理48 h后胚胎出现心包膜明显的水肿、卵黄囊出血且凹陷、小眼畸形、心房和心室肿大畸形;经25 μmol·L-1VCR处理48 h后胚胎出现身体脊椎弯曲、尾部卷曲、卵黄囊轻微肿大、小眼畸形、心室变小;经20 mmol·L-1CTX处理48 h后胚胎心包膜出现明显的水肿、卵黄囊出血且轻微凹陷、小眼畸形、心房和心室轻微肿大畸形。见Fig 3。
联合80 μmol·L-1Dex给药处理后,明显改善DDP引起的毒性,但并没有明显改善5-FU、VCR或CTX所产生的组织器官毒性,结果见Fig 3。
因此,斑马鱼胚胎经过DDP、5-FU、VCR和CTX处理后,除心脏毒性外还表现出其他组织器官毒性。而Dex只对DDP引起的组织器官毒性具有保护作用,对5-FU、VCR和CTX并没有影响。
2.4 非蒽环类抗肿瘤药物对斑马鱼胚胎的心脏功能影响为了更进一步评价4种非蒽环类抗肿瘤药物对斑马鱼胚胎心脏功能的影响,选取HR、FS、SV和CO 4项指标进行评价,见Tab 2。与空白组相比,DDP与VCR均明显降低斑马鱼胚胎的4项心功能指标;5-FU与CTX除降低斑马鱼胚胎的HR外,其余3项指标均上调,表现为扩张型心脏病。而经过Dex联合处理后,可恢复DDP引起的斑马鱼4项心功能指标的降低,明显保护斑马鱼胚胎由于DDP引起的心脏毒性(P<0.01),但不影响5-FU、VCR和CTX 4项心功能指标的变化。
2.5 Dex和DDP对细胞活力的影响结合斑马鱼急性毒性、组织器官毒性以及心脏毒性3个维度评价Dex对非蒽环类抗肿瘤药物引起的毒性保护作用,认为只有Dex对DDP具有保护作用,因此我们进一步采用哺乳动物细胞模型进行验证,DDP对H9C2大鼠心肌细胞毒性影响见Fig 4。单独给予不同DDP药物浓度处理H9C2细胞24 h后,H9C2细胞的存活率随浓度增大而降低(Fig 4A)。而采用Dex对H9C2细胞进行24 h预处理,结果显示:Dex明显提高由DDP引起的细胞活力降低,且最佳浓度为1.25 μmol·L-1,说明Dex可以降低DDP引起的心肌细胞毒性。
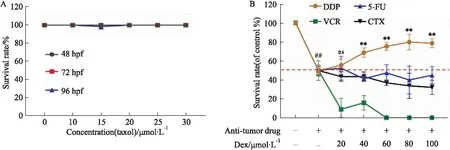
Fig 2 Effects of five anti-tumor drugs and combined Dexrazoxane on survival rate of zebrafish
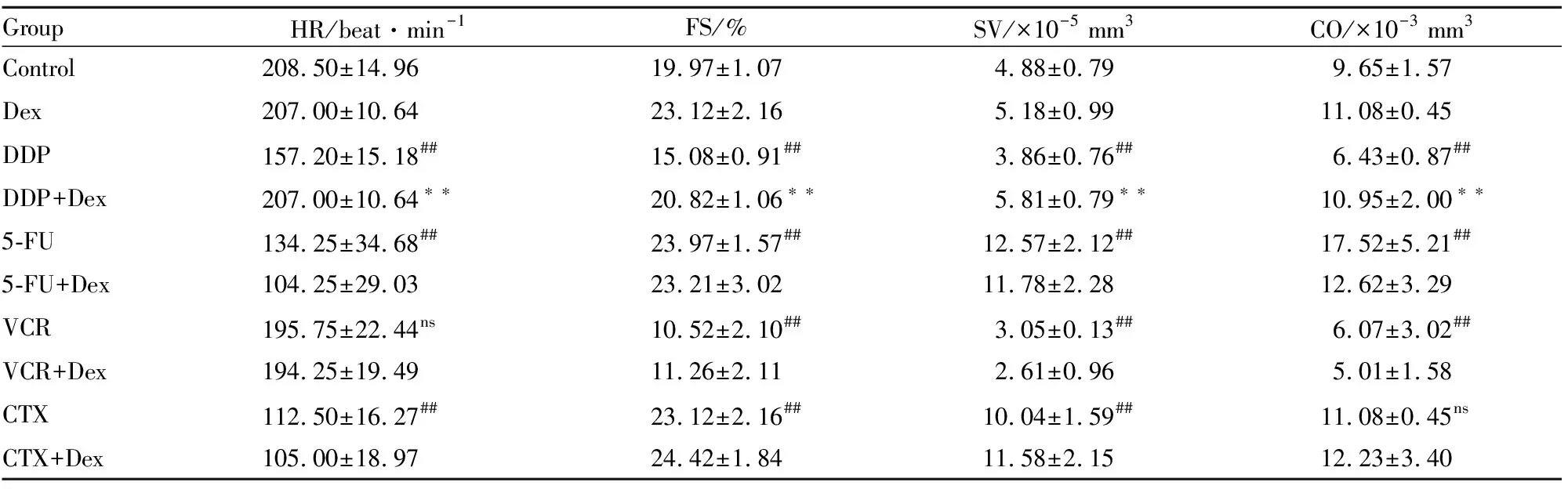
Tab 2 Heart function of 72 hpf zebrafish embryos

Fig 3 Effects of four anti-tumor drugs and combined Dexrazoxane on overall development of 72 hpf zebrafish

Fig 4 Effects of cisplatin and combined Dexrazoxane on survival rate of H9C2
3 讨论
抗肿瘤药物在杀伤肿瘤细胞的同时也对正常细胞造成损伤,引起不良反应,影响患者的生活质量,即使现在肿瘤治疗明显提高患者的寿命,但是目前的新药还没完全实现高活性与低不良反应相结合,心脏毒性严重影响肿瘤治疗的预后,仍然是我们现在所要关注的问题[14]。抗肿瘤药物中,以阿霉素为代表的蒽环类抗肿瘤药物对于心脏毒性的不良反应研究甚多,目前Dex是FDA唯一批准用于降低蒽环类化合物心脏毒性的药物[15],但是其能否降低其他抗肿瘤药物的不良反应尚属未知。
斑马鱼是常用于药物筛选的整体动物模型,拥有82%的人类疾病相关基因的直系同源基因,表现出接近,有时候甚至超过啮齿动物的生理和药理学保守性[16]。本课题组前期已使用斑马鱼模型对多种抗肿瘤药物的心血管毒性进行了描述[13]及药物筛选[17]。因此,本研究选择斑马鱼作为模型对Dex的心脏保护作用进行进一步探索。
本研究选取了若干种具有代表性的,且被报导具有心血管毒性的抗肿瘤药物进行研究,包括烷基化类的CTX、铂类的DDP、抗代谢类的5-FU、抗微管剂型的VCR以及Taxol。结果显示:在斑马鱼急性毒性测试中,5种抗肿瘤药物中只有4种药物(DDP、5-FU、VCR和CTX)明显降低斑马鱼的胚胎存活率。DDP、5-FU、VCR和CTX在斑马鱼胚胎中也表现出明显的心脏毒性。此外,DDP、5-FU、VCR和CTX还引起其他组织器官毒性,分别为:DDP表现为肝脏及代谢毒性、发育延缓和神经毒性;5-FU表现为肝脏及代谢毒性和神经毒性;VCR表现为神经毒性、肝脏及代谢毒性和发育延缓;CTX表现为肝脏及代谢毒性和神经毒性。我们进一步研究发现,Dex对DDP引起的斑马鱼胚胎死亡率增加,明显的心脏毒性及发育毒性均有较好的保护作用,而对5-FU、VCR和CTX的各种毒性均未见明显作用。
由此说明,Dex不仅可以保护蒽环类抗肿瘤药物的心脏毒性,还可以保护DDP引起的心脏毒性,同时还能改善DDP引起的肝脏及代谢毒性、发育延缓和神经毒性。但在本研究的条件下,Dex并不能保护5-FU、VCR和CTX引起心脏毒性以及其他毒性。因此我们认为,Dex发挥作用的机制并非直接靶向心脏,而是通过影响抗肿瘤药物产生毒性的毒理机制起作用。由于DDP产生多种毒副作用的根本原因是DDP与DNA相互作用,并与嘌呤DNA碱基形成共价加合物[18],所以Dex对DDP发挥保护作用的机制可能影响此通路,具体机制有待进一步研究。
综上所述,本研究发现Dex可能降低由抗肿瘤药物DDP引起的心脏及其他组织毒性,但并未发现对5-FU、VCR和CTX毒性的保护作用。本研究的发现说明,Dex可作为降低DDP化疗不良反应的潜在药物进行开发,并为Dex进一步的药理机制研究提供了线索和理论基础。
