Ag-Fe2O3活化过一硫酸盐降解水中磺胺甲唑
2022-12-15杨宇航秦庆东
杨宇航,秦庆东
(东南大学 土木工程学院,江苏 南京 210096)
磺胺甲唑(Sulfamethoxazole,SMX)是一种在我国天然水体中被多次检出的磺胺类抗生素[1]。该物质分子结构复杂、毒性大、难以被生物降解,在水体中不断累积会对人类健康和生态环境造成威胁,迫切需要开发高效的SMX水处理技术。基于过一硫酸盐(PMS)的高级氧化技术(AOPs)是近年来发展起来的一种新兴废水处理技术。PMS过氧键裂解所产生的硫酸根自由基(SO4-·)和羟基自由基(·OH)具有强氧化性,可以有效降解水中的有机污染物[2]。PMS活化方法中,过渡金属氧化物被认为是最经济的活化剂[3]。赤铁矿(α-Fe2O3)具有成本低、无毒、结构稳定等优点,在催化领域应用广泛[4]。研究表明,掺加其他金属能够提高α-Fe2O3的催化性能[5],如在α-Fe2O3中掺加Ag,不仅可以通过降低电阻、加速电子转移提高催化效率[6],而且Ag+本身对PMS也有着一定的活化作用[7]。
本工作采用沉淀-煅烧法制备了A g掺加α-Fe2O3催化剂(Ag-Fe2O3),通过TEM、XRD和XPS等手段进行了表征,并将该催化剂用于活化PMS降解水中SMX,考察了不同因素对SMX去除率的影响,探讨了SMX的降解机理,以期为Ag掺加金属氧化物活化PMS降解有机污染物作参考。
1 实验部分
1.1 试剂和仪器
SMX(纯度≥98%)、PMS、硝酸银、七水合硫酸亚铁、醋酸钠、氢氧化钠、盐酸、氯化钠、无水碳酸钠、硝酸钠、硫代硫酸钠、甲醇、叔丁醇、对苯醌、糠醇:均为分析纯;超纯水。
LC-16型高效液相色谱仪:岛津仪器有限公司;JEM-200CX型透射电子显微镜:日本电子株式会社;ASAP 2020型氮气吸附-脱附仪:美国麦克默瑞提克仪器有限公司;PW1710型X射线衍射仪:德国Bruker公司;PHI 5000 VersaProbe型X射线光电子能谱分析仪:日本真空技术株式会社;EMX 10/12型电子自旋共振(EPR)波谱仪:德国Bruker公司;Agilent 1290/6545型超高效液相色谱-质谱(UPLC-MS)联用仪:安捷伦科技有限公司。
1.2 Ag-Fe2O3催化剂的制备
采用沉淀—煅烧法制备Ag-Fe2O3催化剂[3]。具体步骤为:称取13.9 g七水合硫酸亚铁与7.2 g醋酸钠溶解于250 mL超纯水中,40 ℃条件下搅拌10 min;再加入0.845 g硝酸银,继续搅拌1 h,形成灰黑色悬浊液;经离心分离后,用超纯水、乙醇清洗3次,得到灰黑色固体;将固体烘干后置于马弗炉中,在300 ℃条件下焙烧2 h;冷却,得到Ag-Fe2O3。
α-Fe2O3的制备:除不添加硝酸银外,其余步骤与Ag-Fe2O3的制备方法相同。
1.3 实验方法
取100 mL浓度为10 μmol/L的SMX溶液于锥形瓶中,用浓度为0.1 mol/L的氢氧化钠溶液或盐酸调节pH,依次加入一定量的Ag-Fe2O3和PMS,搅拌并开始计时,间隔一定时间取样,并用饱和硫代硫酸钠溶液终止反应,分别考察Ag-Fe2O3和PMS投加量、初始pH、反应温度等因素对SMX去除率的影响。
采用5,5-二甲基-1-吡咯啉-N-氧化物(DMPO)作为·OH、SO4-·和O2-·的自旋捕获剂,2,2,6,6-四甲基-4-哌啶醇(TEMP)作为1O2的自旋捕获剂,通过EPR仪判断反应过程中的活性物种。
1.4 分析方法
采用高效液相色谱法[3]测定SMX的质量浓度。检测条件:C18型色谱柱(4.6 mm×200 mm×5 μm),UV检测器(波长为265 nm),流动相为体积比40∶60的乙腈-酸化超纯水,流量为1.0 mL/min,柱温为30 ℃。
采用高效液相色谱-质谱法[3]测定SMX的降解产物。检测条件:C18型色谱柱(2.1 mm×50 mm×1.7 μm),流动相为体积比20∶80的甲醇-超纯水溶液,流量为0.2 mL/ min,使用正离子模式进行全扫描。
2 结果与讨论
2.1 Ag-Fe2O3催化剂的表征
2.1.1 TEM和XRD分析
图1为Ag-Fe2O3的TEM照片。由图1可见,Ag-Fe2O3呈均匀针状,粒径为30~50 nm。

图1 Ag-Fe2O3的TEM照片
图2为Ag-Fe2O3的XRD谱图。由图2可见:Ag-Fe2O3的部分衍射峰出现在2θ为33.1°,35.6°,49.5°,54.1°处,与α-Fe2O3标准谱图(PDF#33-0664)中的特征峰基本相符;部分Ag0的衍射峰出现在2θ为38.1°,44.2°,64.4°,77.2°处[8]。在Ag-Fe2O3的XRD谱图中未检测到其他形态Ag的特征峰,说明部分Ag以单质的形式存在于催化剂中。
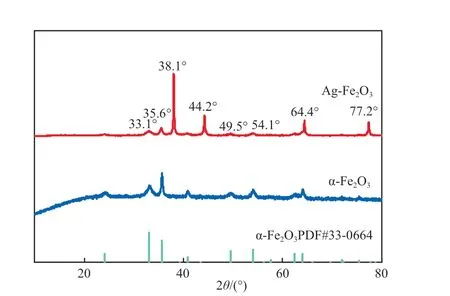
图2 Ag-Fe2O3的XRD谱图
2.1.2 XPS分析
图3为Ag-Fe2O3的XPS全谱图(a)和XPS Ag 3d谱图(b)。图3a中检测到了Fe,Ag,O 3种元素,说明Ag成功地负载在α-Fe2O3上。图3b中结合能为367.7,373.7 eV的特征峰分别对应Ag+的3d5/2和3d3/2轨道,结合能为369.3,375.3 eV的特征峰分别对应Ag0的3d5/2和3d3/2轨道[8],由此可见,Ag-Fe2O3表面的Ag主要以Ag+和Ag0的形式存在。
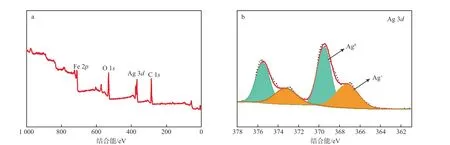
图3 Ag-Fe2O3的XPS 全谱图(a)和XPS Ag 3d谱图(b)
2.1.3 N2吸附-脱附等温线
图4为Ag-Fe2O3的N2吸附-脱附等温线和孔径分布。由图4a可见:Ag-Fe2O3的N2吸附-脱附等温线呈Ⅳ型,具有明显的H3 滞后环,表明材料中可能存在一定的介孔结构。由图4b可知:Ag-Fe2O3的比表面积为81.81 m2/g,平均孔径为9.22 nm,孔体积为0.188 cm3/g。
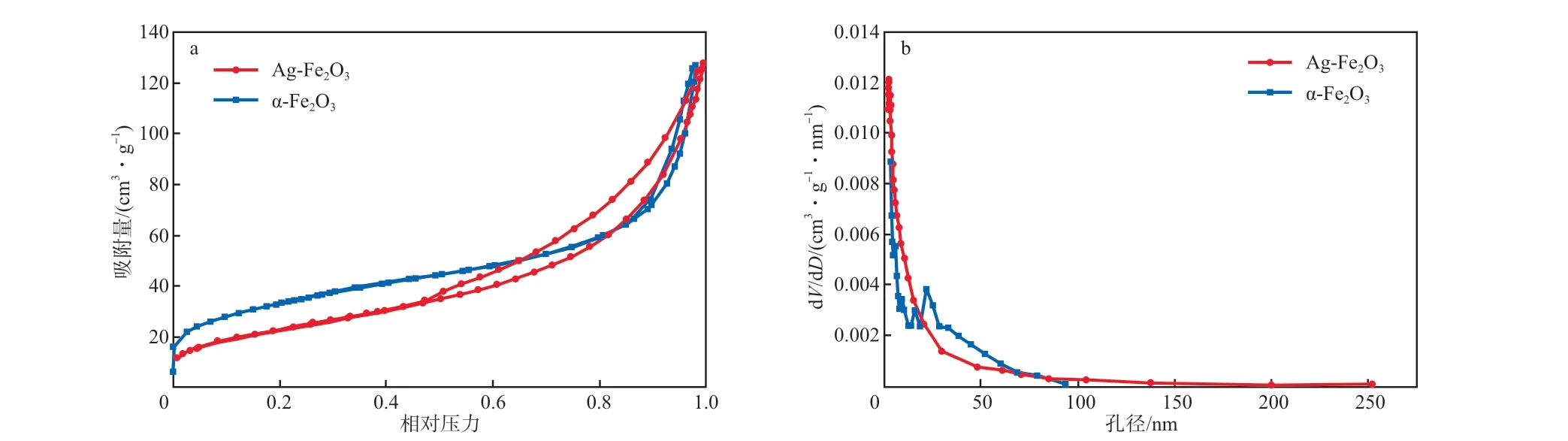
图4 Ag-Fe2O3的N2吸附-脱附等温线(a)和孔径分布(b)
2.2 不同体系的降解效果
在催化剂投加量为0.10 g/L、PMS浓度为0.10 mmol/L、初始pH为7.0、反应温度为25 ℃的条件下,考察不同体系中SMX的降解效果,结果见图5。
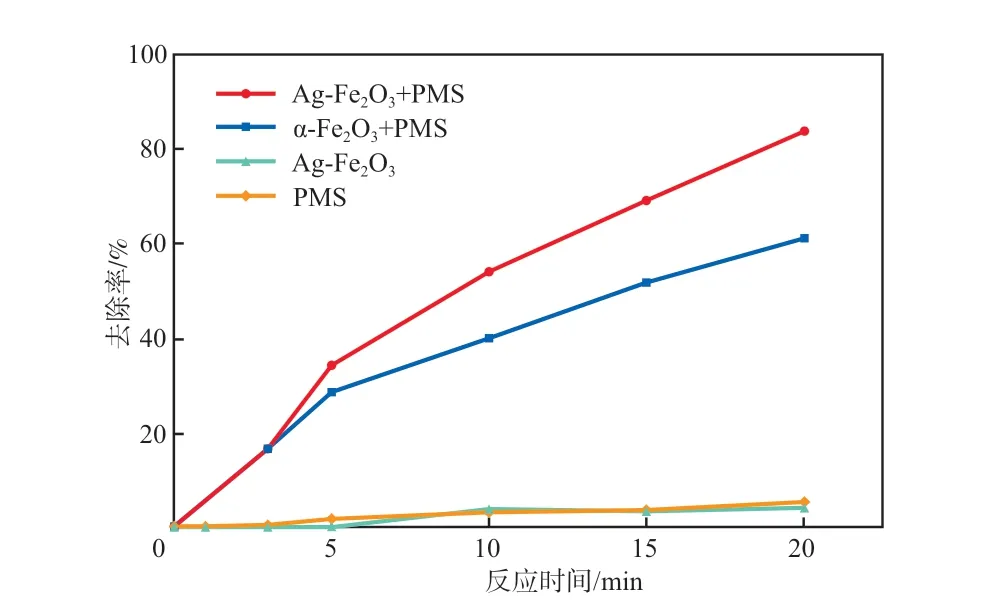
图5 不同体系中SMX的去除率
由图5可见:反应20 min后,在PMS体系和Ag-Fe2O3体系中,SMX的去除率均小于10%,表明单独使用PMS氧化或Ag-Fe2O3吸附对SMX的去除效果均不好;α-Fe2O3+PMS体系和Ag-Fe2O3+PMS体系对SMX的去除率分别为61.2%和83.8%,与α-Fe2O3+PMS体系相比,Ag-Fe2O3+PMS体系对SMX的去除率提高了22.6个百分点,表明掺加Ag可以提高α-Fe2O3对PMS的活化能力,这是因为Ag既可以加快电子转移速率从而加快Fe2+/Fe3+循环反应速率[6],又可以为反应提供更多的活性位点。
2.3 SMX降解的影响因素
2.3.1 Ag-Fe2O3投加量
在PMS浓度为0.10 mmol/L、初始pH为7.0、反应温度为25 ℃的条件下,考察Ag-Fe2O3投加量对SMX去除率的影响,结果见图6。由图6可见:随着Ag-Fe2O3投加量的增加,SMX去除率逐渐增大;当Ag-Fe2O3投加量为0.05 g/L时,反应20 min后SMX去除率为52.7%;当Ag-Fe2O3投加量为0.10 g/L时,反应20 min后SMX去除率达到了83.8%;继续增加Ag-Fe2O3投加量至0.50 g/L时,反应5 min后SMX去除率已达到了84.5%,反应10 min后SMX去除率接近100%。这是因为随着Ag-Fe2O3投加量的增多,反应体系中活性位点增多,对PMS的活化作用增强,有利于SMX的降解。综合考虑处理成本等因素,Ag-Fe2O3投加量选择0.10 g/L为宜。
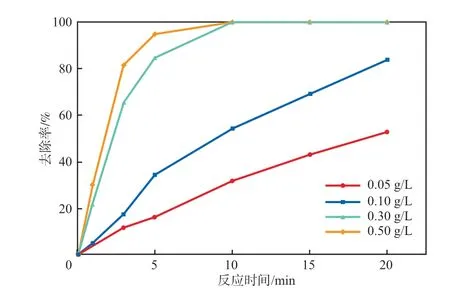
图6 Ag-Fe2O3投加量对SMX去除率的影响
2.3.2 PMS浓度
在Ag-Fe2O3投加量为0.10 g/L、初始pH为7.0、反应温度为25 ℃的条件下,考察PMS浓度对SMX去除率的影响,结果见图7。由图7可见:随着PMS浓度的增加,SMX去除率明显升高;当PMS浓度为0.05 mmol/L时,反应20 min后SMX去除率为70.8%;当PMS浓度为0.10 mmol/L时,反应20 min后SMX去除率为83.8%;当PMS浓度增加至0.30 mmol/L时,反应20 min后SMX去除率接近100%,表明SMX几乎被完全降解。这是因为随着PMS浓度的增大,PMS与Ag-Fe2O3催化剂表面活性位点反应更加充分,从而增强了催化降解效果。综合考虑处理成本等因素,PMS浓度选择0.10 mmol/L为宜。
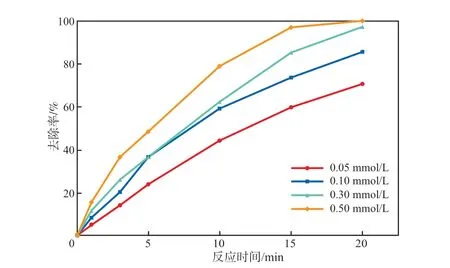
图7 PMS浓度对SMX去除率的影响
2.3.3 初始pH
在Ag-Fe2O3投加量为0.10 g/L、PMS浓度为0.10 mmol/L、反应温度为25 ℃的条件下,考察初始pH对SMX去除率的影响,结果见图8。由图8可见:随着溶液初始pH的增加,SMX去除率先增大后减小;当初始pH为5.0时,反应20 min后SMX去除率为60.1%;当初始pH增加至7.0时,SMX去除率为81.1%;继续增加初始pH至9.0时,SMX的去除率达到最大,为84.3%;进一步增加初始pH至11.0时,SMX去除率下降至59.1%。这是因为:Ag-Fe2O3的等电点在9.0左右,此时对PMS的活化效果最好;当初始pH为11.0时,Ag-Fe2O3表面带负电荷,PMS在水溶液中以阴离子形式存在,二者之间产生静电斥力导致SMX去除率降低;当初始pH为5.0时,PMS以HSO5-的形式存在,HSO5-具有高稳定性,难以被Ag-Fe2O3激活[9]。综合考虑处理成本等因素,pH选择7.0为宜。
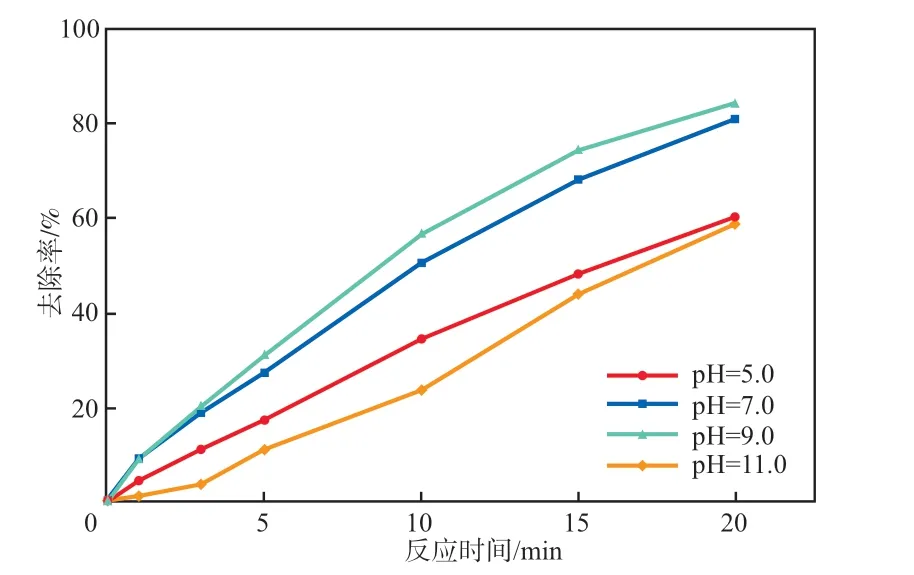
图8 初始pH对SMX去除率的影响
2.3.4 反应温度
在Ag-Fe2O3投加量为0.10 g/L、PMS浓度为0.10 mmol/L、初始pH为7.0条件下,考察反应温度对SMX去除率的影响,结果见图9。由图9可见:随着反应温度的升高,反应速率逐渐加快。当反应温度为15 ℃时,反应20 min后SMX的去除率为69.0%;继续升高反应温度至25℃和35 ℃时,SMX的去除率分别增加至90.1%和94.1%;进一步升高反应温度至45 ℃时,SMX的去除率达到99.5%,表明温度升高有利于SMX的降解。由于升高温度还需要外部提供能量,因此选择25 ℃为适宜反应温度。
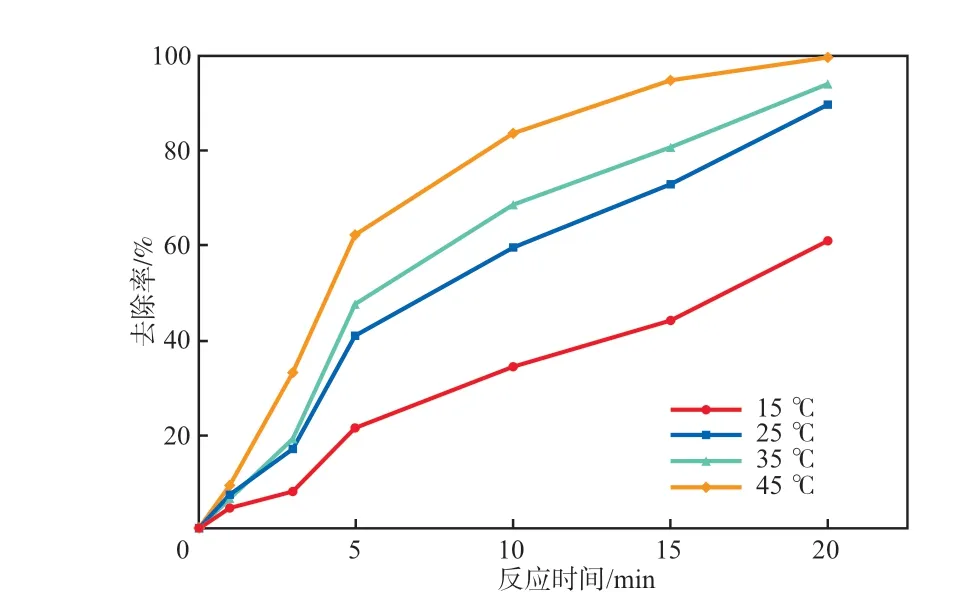
图9 反应温度对SMX去除率的影响
2.3.5 阴离子种类
在Ag-Fe2O3投加量为0.10 g/L、PMS浓度为0.10 mmol/L、初始pH为7.0、反应温度为25 ℃的条件下,分别向反应体系中加入10 mmol/L的Cl-、NO3-和CO32-,考察不同阴离子对SMX去除率的影响,结果见图10。由图10可见:NO3-的加入对SMX的降解几乎没有影响;Cl-对SMX的降解表现出明显的抑制作用,反应20 min后SMX去除率由88.6%下降至33.7%,这可能是由于Cl-会和体系中的SO4-·发生反应,生成反应活性较低的Cl·和Cl2-·自由基[10](见式(1)和式(2)),同时Cl-还可能会和催化剂表面的Ag反应,从而导致SMX去除率下降;加入CO32-后,SMX去除率由88.6%下降至54.9%,这可能是由于CO32-会和SO4-·反应生成CO3-·(见式(3)),SO4-·反应速率常数高于CO3-·[11],因此SMX去除率下降。
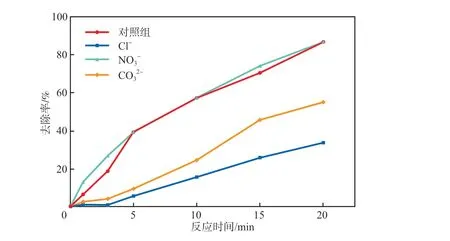
图10 不同阴离子对SMX去除率的影响
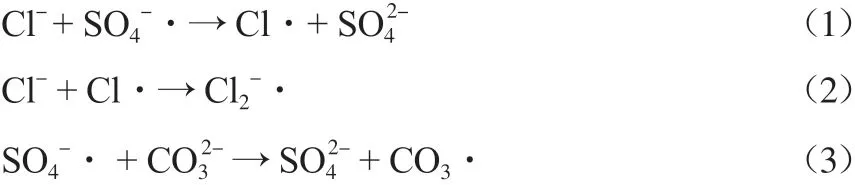
2.4 机理研究
2.4.1 淬灭实验
不同淬灭剂对SMX去除率的影响见图11。其中叔丁醇(TBA)为·OH的淬灭剂,甲醇(MeOH)为·OH和SO4-·的淬灭剂,对苯醌(p-BQ)为O2-·的淬灭剂,糠醇(FFA)为1O2的淬灭剂[3]。由图11可见:TBA对SMX去除率基本没有影响,表明体系中不存在·OH;加入MeOH后,SMX去除率略有降低,表明SMX的降解受到轻微的抑制,体系中可能存在少量的SO4-·;加入p-BQ和FFA 后,SMX的去除率明显降低,表明p-BQ和FFA对SMX的降解起到明显的抑制作用,由此推断体系中存在O2-·和1O2反应。综上,推断体系中存在的主要活性物种为O2-·、1O2和SO4-·。
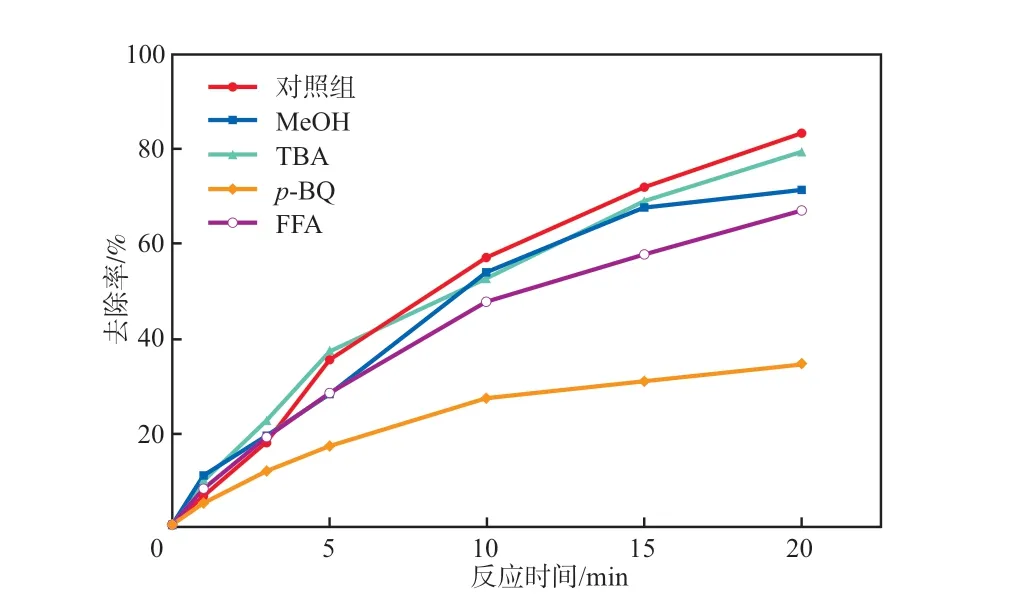
图11 不同淬灭剂对SMX去除率的影响
为了进一步证实反应体系中存在的活性物种,进行了EPR测试,结果见图12。由图12a可见,在反应体系中加入捕获剂DMPO后,可以得到产物5,5-二甲基-2-吡咯烷酮-N-氧基(DMPOX)。DONG等[12]认为:DMPOX通常是由于体系中的氧化剂氧化能力过强导致DMPO过度氧化而形成的。因此DMPOX的形成说明反应过程中DMPO氧化的速度大于捕获剂捕获自由基的速度,这也可以间接证明反应体系中存在活性物种[13]。图12a中还观察到O2-·峰的存在,表明体系中存在O2-·。由图12b可见,在反应体系中加入TEMP捕获剂后出现了对应2,2,6,6-四甲基哌啶-N-氧基(TEMPO)的信号[14],再次表明体系中存在1O2,1O2的产生可能是通过PMS活化产生的O2-·重组形成的[13]。综上,Ag-Fe2O3+PMS体系中主要存在的活性物种为O2-·、1O2和SO4-·。
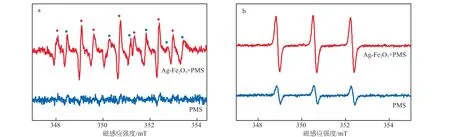
图12 加入 DMPO捕获剂(a)和TEMP捕获剂(b)后反应体系的EPR谱图● DMPOX;■ O2-·
2.4.2 XPS分析
图13为反应前后Ag-Fe2O3催化剂的XPS谱图。由图13a可见:在Fe 2p3/2轨道上结合能为710.0,711.3 eV处分别对应Fe2+,Fe3+[15];反应后,Ag-Fe2O3表面Fe3+占Fe的质量分数由44.3%降低至33.8%。由图13b可见:在Ag 3d5/2轨道上结合能为367.7,369.3 eV处分别对应Ag+,Ag0[8];反应后催化剂表面Ag+占Ag的质量分数由38.9%降低至36.5%,这是因为在催化氧化过程中Ag+会接受电子形成Ag0,导致Ag+含量下降。
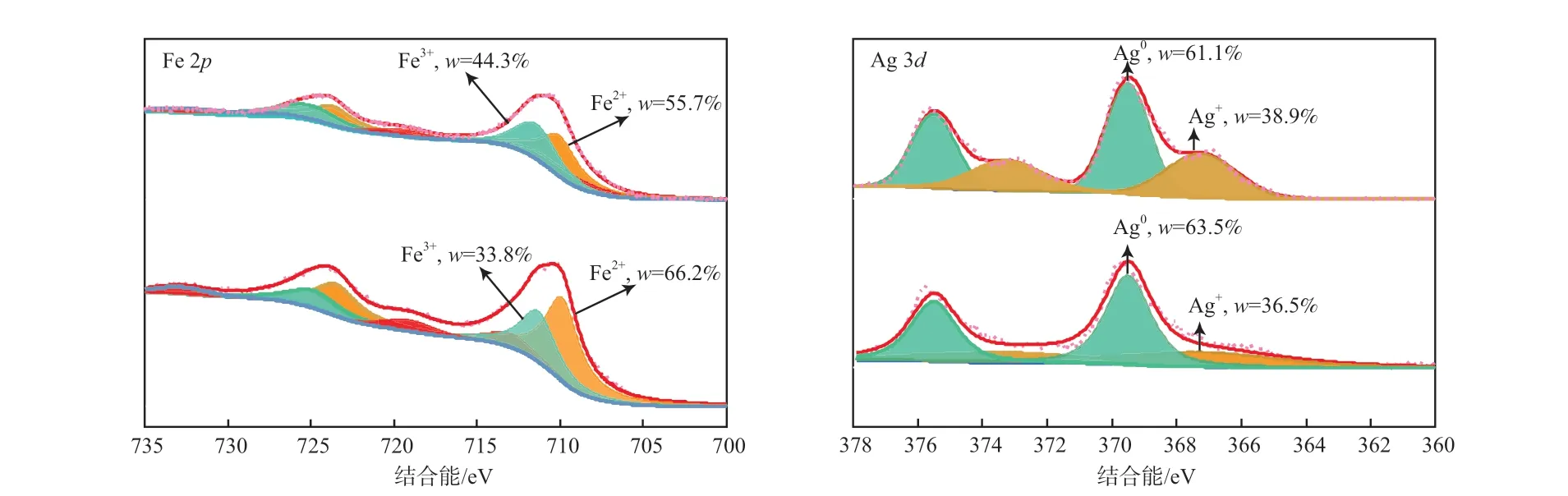
图13 反应前后Ag-Fe2O3催化剂的XPS谱图
综上,推测Ag-Fe2O3活化PMS的过程如式(4)~(12)所示[16]。水分子吸附在部分金属离子上,在催化剂表面生成Ag+/Fe3+—OH-;加入PMS后,HSO5-会与Ag+/Fe3+—OH-通过氢键结合形成Ag+/Fe3+—OH-—HSO5-[16];由于Ag+/Fe3+的强电子引力,HSO5-的O—H伸缩带变弱,导致Ag+/Fe3+分别被还原为Ag0/Fe2+(式(4));Ag0/Fe2+可以与吸附在催化剂表面的HSO5-反应生成SO4-·,其自身被氧化为Ag+/Fe3+(式(5))。同时通过式(6)~(11)生成O2-·和1O2。
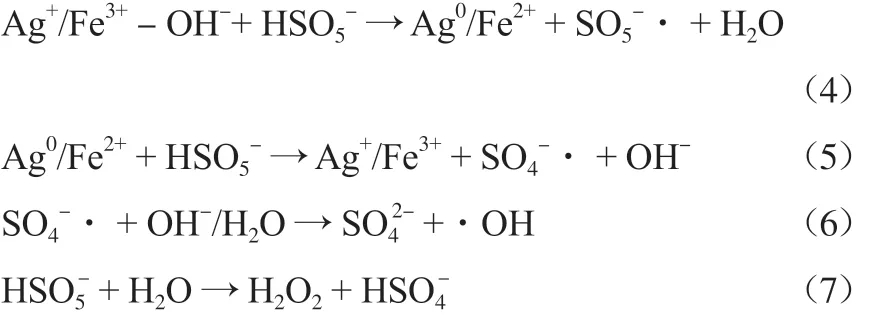

2.4.3 SMX的降解路径
采用UPLC-MS对反应后的降解产物进行分析,推测SMX的降解路径可能有3种(见图14):1)SMX被多种活性物质攻击,导致SMX—NH2氧化为SMX—NO2(m/z=284),这在以往的研究中曾观察到[3];2)m/z为99和206的产物是由S—N键断裂和羟基化形成,随后苯胺环上的脱羟基和脱氨基作用生成m/z为159的产物[17];3)SMX的C—S键也可以被直接氧化,生成m/z为94和179的两种产物[18]。
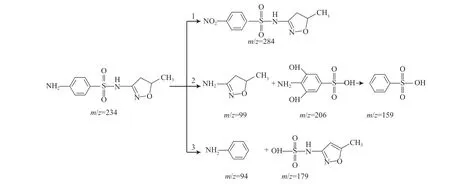
图14 SMX可能的降解路径
3 结论
a)通过沉淀—煅烧法制备了Ag-Fe2O3催化剂,该催化剂呈针状,其表面的Ag主要以Ag0和Ag+的形式存在。
b)在Ag-Fe2O3投加量为0.10 g/L、PMS浓度为0.10 mmol/L、初始pH为7.0、反应温度为25 ℃的条件下,反应20 min后,Ag-Fe2O3+PMS对SMX的去除率达到83.8%,与α-Fe2O3+PMS体系相比,SMX的去除率提升了22.6个百分点。
c)SMX的去除率随Ag-Fe2O3投加量、PMS浓度和反应温度的增加而增大,在初始pH为7.0~9.0时,Ag-Fe2O3+PMS对SMX的去除效果较好;NO3-对SMX的降解影响不大,Cl-和CO32-对SMX的降解表现出明显的抑制作用。
d)自由基淬灭实验和EPR测试结果表明,Ag-Fe2O3+PMS体系中的主要活性物种为O2-·、1O2和SO4-·。
