Al掺加赤铁矿去除水中U(Ⅵ)的机理研究
2022-12-15朱成朋谢水波谭文发
朱成朋,谢水波,谭文发,黎 媛
(1. 南华大学 资源环境与安全工程学院,湖南 衡阳 421001;2. 南华大学 土木工程学院,湖南 衡阳 421001)
低浓度含铀废水的有效处理是目前亟待解决的问题,常用的处理方法有化学沉淀法、吸附法、生物处理法、膜法和离子交换法等,其中,吸附法因其吸附速率快、操作简单、去除率高而备受关注[1]。铁氧化物在自然界广泛存在,其中赤铁矿具有比表面积大、热稳定性好、表面氧空位多等优点,可作为理想的吸附材料[2-3]。研究表明,单一赤铁矿(Hem)表面的活性位点不足、耐酸性和化学稳定性不强,导致其吸附效果和可重复利用性不佳,常温下Hem对U(Ⅵ)的平衡吸附量仅为5.59 mg/g[4-5]。SU等[6]研究了Hem掺加Mn后结构和形貌的变化情况,结果表明,掺加Mn后Hem的粒径变小,对污染物的吸附性能提高。CAO和LIANG等[7-8]研究了Hem掺加Al后结构和形貌的变化,结果表明,由于铝氧化物表面含有丰富的含氧基团,因此Hem掺加Al后,其表面的羟基位点增加,吸附性增强。
本文采用共沉淀法制备了吸附剂Al掺加Hem (Al-Hem),并通过XRD、TEM等手段进行了表征,考察了初始pH、Al-Hem加入量、吸附时间和初始U(Ⅵ)质量浓度等因素对Al-Hem吸附去除低浓度含铀溶液中U(Ⅵ)效果的影响,在此基础上分析了Al-Hem对U(Ⅵ)的吸附机理。
1 实验部分
1.1 材料、试剂和仪器
FeCl3·6H2O、AlCl3·6H2O、无水乙醇、氨水、NaOH、盐酸、硝酸、H2O2、U3O8:均为分析纯。实验用水为去离子水。
U(Ⅵ)溶液:称取1.179 2 g U3O8于250 mL烧杯中,依次加入10 mL盐酸、3 mL H2O2(30%)和两滴浓硝酸,放置5 min,待反应完成后,置于电炉加热至固体完全溶解,冷却后转移至1 000 mL容量瓶中,用pH小于3的硝酸溶液定容,得到质量浓度为1.0 g/L的U(Ⅵ)储备液。稀释得到质量浓度分别为5,10,20,30,40,50 mg/L的U(Ⅵ)溶液。
THZ-82型恒温振荡箱:上海力辰仪器科技有限公司;DF-101S型集热式恒温加热磁力搅拌器:上海力辰邦西仪器科技有限公司;Talos F200S型透射电子显微镜:美国FEI公司;ASAP 2460型比表面与孔隙度分析仪:美国麦克仪器公司;PE Spectrum 100型傅里叶红外光谱仪:珀金埃尔默股份有限公司;布鲁克D8型X射线衍射仪:德国布鲁克光谱仪器公司;T6新悦型可见分光光度计:北京普析通用仪器有限责任公司。
1.2 Al-Hem的制备
取100,90,85,80 mL 浓度为0.01 mol/L的FeCl3·6H2O溶液分置于4个250 mL锥形瓶中,依次加入0,10,15,20 mL浓度为0.01 mol/L的AlCl3·6H2O溶液,用2 mol/L的氨水调pH至8~9;在温度80 ℃、转速800 r/min的条件下,老化24 h;用浓度为2 mol/L的NaOH溶液将产物表层未与Hem结合的铝颗粒去除,再用去离子水和乙醇洗净;在400 ℃条件下热解2 h,得到铝的摩尔分数分别为0、10%、15%和20%的最终产物,分别记作Hem、Al10-Hem、Al15-Hem和Al20-Hem。
1.3 实验方法
1.3.1 Al-Hem 对U(Ⅵ)的吸附实验
取100 mL一定质量浓度的U(Ⅵ)溶液于锥形瓶中,加入一定量的Al15-Hem,调节pH;将锥形瓶放置在恒温振荡器中,在温度为(25±1)℃、转速为120 r/min的条件下反应一定时间。间隔一定时间取样,离心,测定上清液在652 nm处的吸光度。
1.3.2 Al-Hem 的解吸实验
将50 mg吸附后的Al15-Hem置于锥形瓶中,用50 mL浓度为0.1 mol/L的HCl溶液作解吸液,在温度为30 ℃、转速为120 r/min的条件下解吸4 h,离心分离出Al15-Hem,用去离子水和无水乙醇洗净,烘干后重复吸附实验。上述步骤重复4次,计算每次吸附实验后Al15-Hem对U(Ⅵ)的去除率。
1.4 分析与表征
采用分光光度法[9]测定上清液在652 nm处的吸光度,计算溶液中U(Ⅵ)的质量浓度及去除率。
采用XRD分析吸附剂的物相结构;采用TEM观察吸附剂的形貌特征;采用FTIR分析吸附剂表面的官能团;采用XPS分析吸附剂中铀的价态。
2 结果与讨论
2.1 吸附剂的表征
图1为Hem和Al-Hem的XRD谱图。由图1可见:随着Al-Hem中 Al含量的增加,Hem所对应的特征峰强度均减弱,表明Hem中Al的含量影响其结晶度;当Al的摩尔分数达到20%时,在2θ为35°和63°处有两个较宽泛的峰,为双线铁氧化物的特征峰[10];与Hem 相比,Al10-Hem和Al15-Hem的晶面均向右偏移,表明Al3+进入了Hem晶格。
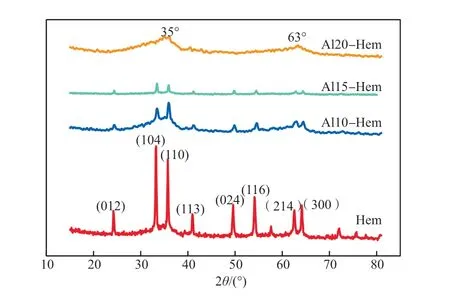
图1 Hem和Al-Hem的XRD谱图
图2为Hem和Al-Hem的TEM照片。由图2a、2b可见:Hem和Al15-Hem都是由较小的球形微粒组成的,其中,Al15-Hem的粒径约为7 nm,略小于Hem的粒径。

图2 Hem(a)和Al15-Hem(b)的TEM照片
对Al15-Hem进行透射电子显微镜元素扫描。Al15-Hem的高角环形暗场像-扫描透射电子(HAADF)图像(a)和Al(b)、Fe(c)、O(d)在空间上的分布表征见图3。图3a为各原子的分布情况。由图3b、3c可见;Al的分布情况与Fe的分布情况基本一致;Al分布均匀,表明Al成功掺加进Hem的晶格。由图3d可见,O分布很稠密,表明Al15-Hem表面含有大量的含氧官能团。

图3 Al15-Hem的HAADF图像(a)和Al(b)、Fe(c)、O(d)在空间上的分布表征
掺加Al前后Hem的比表面积、孔体积和平均孔径的变化见表1。由表1可见,与Hem相比,掺加Al后,Al15-Hem的比表面积增大、孔体积和平均孔径均降低。
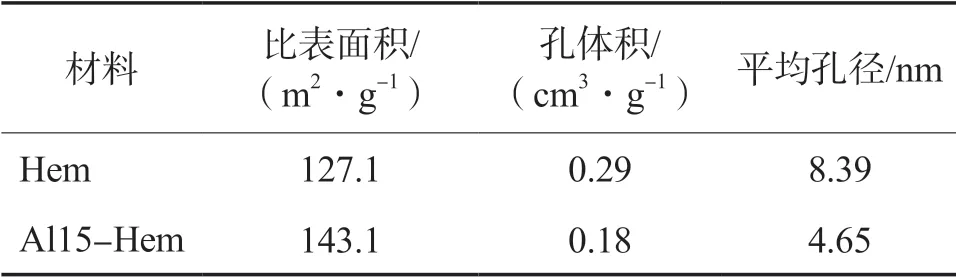
表1 Hem掺加Al前后比表面积、孔体积和平均孔径的变化
2.2 Al-Hem对U(Ⅵ)的吸附性能
在初始pH为6、吸附剂投加量为0.20 g/L、初始U(Ⅵ)质量浓度为5 mg/L、吸附时间为120 min的条件下,考察不同Al含量的Hem对U(Ⅵ)去除率的影响,结果见图4。由图4可见:Hem对U(Ⅵ)的去除率为88.8%;随着Hem中Al含量的增加,吸附剂对U(Ⅵ)的去除率逐渐增大,当掺加Al的摩尔分数为15%(Al15-Hem)时,对U(Ⅵ)的去除率增加至97.5%;继续增加Al的摩尔分数至20%(Al20-Hem)时,对U(Ⅵ)的去除率基本保持不变。由此确定Al15-Hem为最适宜的吸附剂,以下实验均采用Al15-Hem。
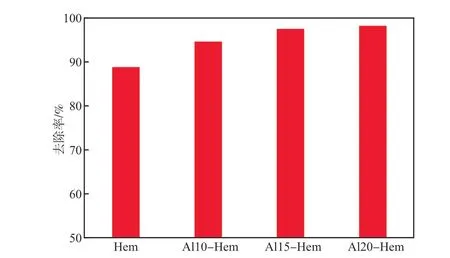
图4 不同铝含量的Hem对U(Ⅵ)的去除率
2.3 U(Ⅵ)吸附效果的影响因素
2.3.1 初始pH
不同pH条件下,U(Ⅵ)的存在形态不同:当pH<5时,主要以UO22+存在;当pH为5~7时,主要以羟基铀酰存在;当pH>7时,主要以碳酸铀酰存在。
在Al15-Hem投加量为0.20 g/L、吸附时间为120 min、初始U(Ⅵ)质量浓度为5 mg/L的条件下,考察初始pH对U(Ⅵ)去除率的影响,结果见图5。由图5可见:与Hem相比,相同pH条件下,Al15-Hem对U(Ⅵ)的去除率更高,表明Al的取代增强了Hem的吸附能力;在较低pH条件下,由于溶液中存在大量H+,Al15-Hem表面质子化,对U(Ⅵ)的吸附去除效果不佳;当pH升高到7时,Al15-Hem表面逐渐脱质子化,吸附能力增加,U(Ⅵ)去除率升高;继续升高pH至9时,溶液中的U主要以碳酸铀酰的形式存在,由于同种电荷离子的排斥作用,吸附能力降低,U(Ⅵ)去除率开始下降。综上,当pH为6~7时,Al15-Hem对U(Ⅵ)的吸附效果最佳,U(Ⅵ)去除率可达97.4 %。
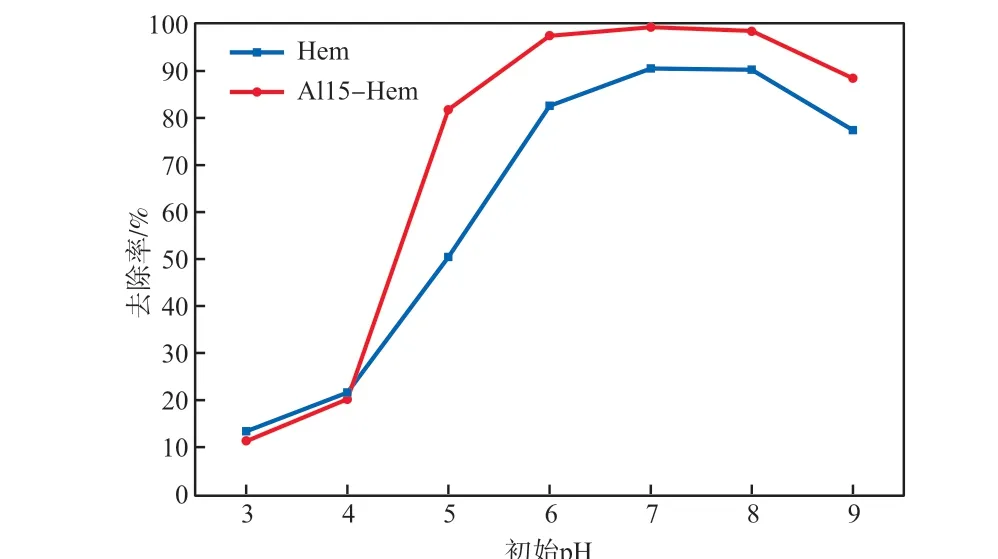
图5 初始pH对U(Ⅵ)去除率的影响
2.3.2 Al15-Hem投加量
在初始pH为6、吸附时间为120 min、初始U(Ⅵ)质量浓度为5 mg/L的条件下,考察Al15-Hem投加量对U(Ⅵ)去除率的影响,结果见图6。由图6可见:与Hem相比,相同条件下,Al15-Hem对U(Ⅵ)的去除率明显提高;当Al15-Hem投加量从0.05 g/L增加到0.20 g/L时,U(Ⅵ)的去除率显著提高,从74.2%提高到99.2%,继续增加Al15-Hem用量至0.50 g/L时,U(Ⅵ)的去除率变化不大。由此可见,Al15-Hem的适宜投加量为0.20 g/L。
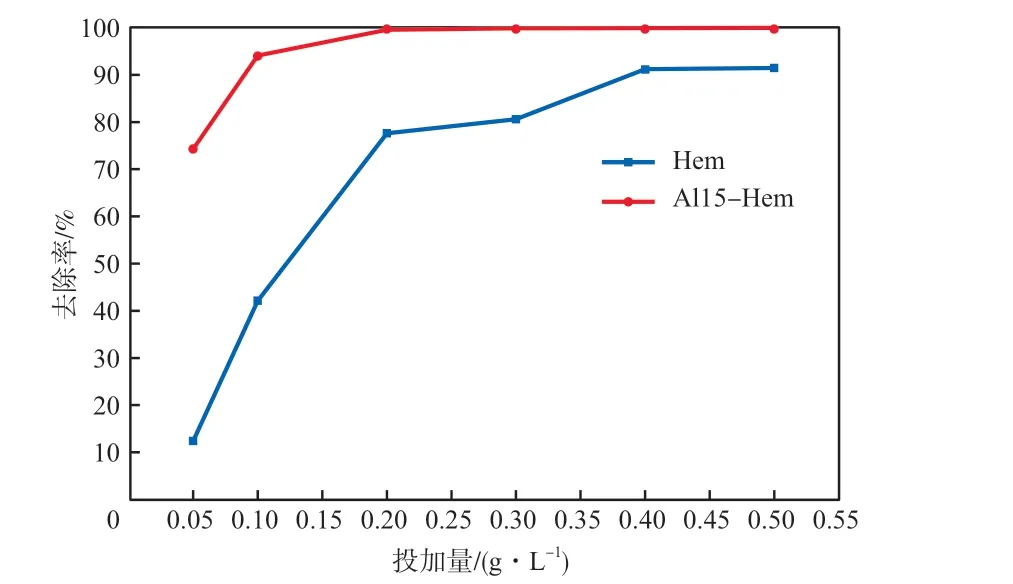
图6 Al15-Hem投加量对U (Ⅵ)去除率的影响
2.3.3 吸附时间
在初始pH为6、Al15-Hem投加量为0.20 g/L、初始U(Ⅵ)质量浓度为5 mg/L的条件下,考察吸附时间对U(Ⅵ)去除率的影响,结果见图7。由图7可见:在0~60 min内,随着吸附时间的延长,U(Ⅵ)去除率迅速增加,这是因为一方面初始阶段吸附剂具有丰富的活性位点,另一方面吸附剂中的Fe3+能与U(Ⅵ)络合,加速了吸附[11];随着吸附时间的延长,U(Ⅵ)去除率增加缓慢,在120 min时Al15-Hem和Hem对U(Ⅵ)的去除率分别为98.8%和88.8%。确定吸附时间以120 min为宜。

图7 吸附时间对U(Ⅵ)去除率的影响
Al15-Hem和Hem吸附U(Ⅵ)的准一级动力学和准二级动力学模型拟合参数见表2。如表2所示:Al15-Hem对U(Ⅵ)的平衡吸附量实测值(qt)为24.8 mg/g,与准二级吸附动力学的拟合值(qe=24.5 mg/g)更为接近;相比较而言,准二级动力学能够更好地描述Al15-Hem对U(Ⅵ)的吸附过程,表明该 吸附过程以化学吸附为主。
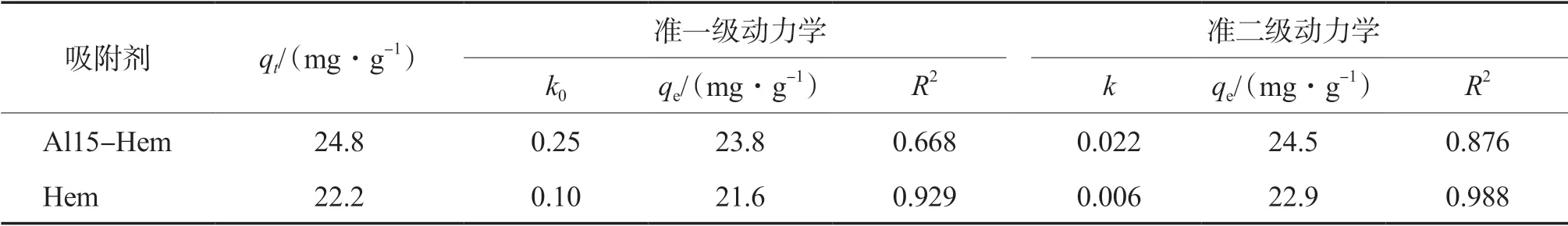
表2 准一级吸附动力学和准二级吸附动力学模型拟合参数
2.3.4 初始U(Ⅵ)质量浓度
在初始pH为6、Al15-Hem投加量为0.20 g/L、吸附时间为120 min的条件下,考察初始U(Ⅵ)质量浓度对U(Ⅵ)去除率的影响,结果见图8。由图8可见:相同条件下,Al15-Hem对U(Ⅵ)的去除率明显高于Hem,表明Hem掺加Al后对U(Ⅵ)的吸附性能得到改善,这与文献[12]的报道相符;随着初始U(Ⅵ)质量浓度的升高,Al15-Hem和Hem对U(Ⅵ)的去除率均逐渐降低;当初始U(Ⅵ)质量浓度从5 mg/L增加到50 mg/L,Al15-Hem对U(Ⅵ)的去除率从98.2 %降低到52.4 %。
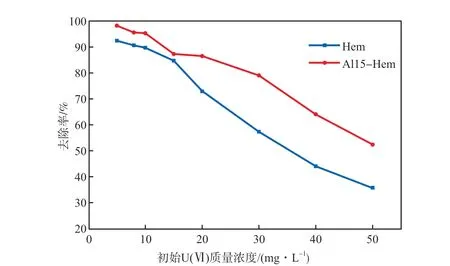
图8 初始U(Ⅵ)质量浓度对U(Ⅵ)去除率的影响
采用Langmuir 模型和Freundlich 模型对实验数据进行拟合,结果见表3。由表3可见:相比较而言,Langmuir 模型能够更好地描述Al15-Hem和Hem对U(Ⅵ)的吸附过程,表明该吸附过程以单层吸附为主;通过Langmuir模型得到Al15-Hem对U(Ⅵ)的理论饱和吸附量qsat为136.2 mg/g。
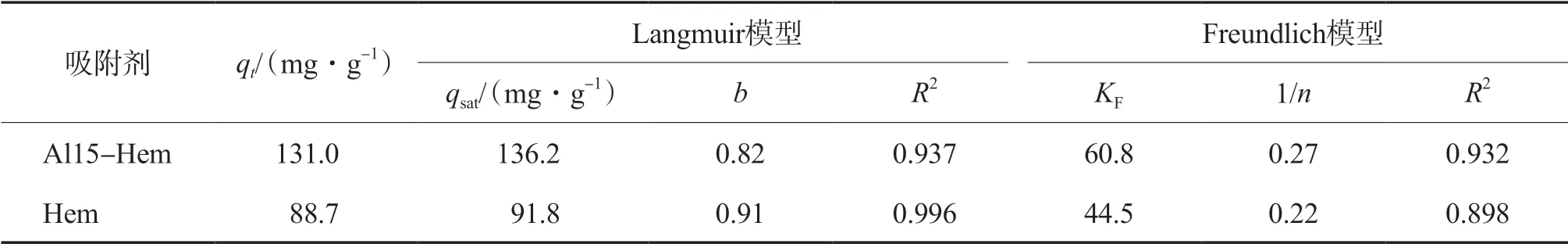
表3 Langmuir和Freundlich模型拟合参数
2.4 Al15-Hem的重复使用性能
Al15-Hem的吸附—解吸实验结果见图9。
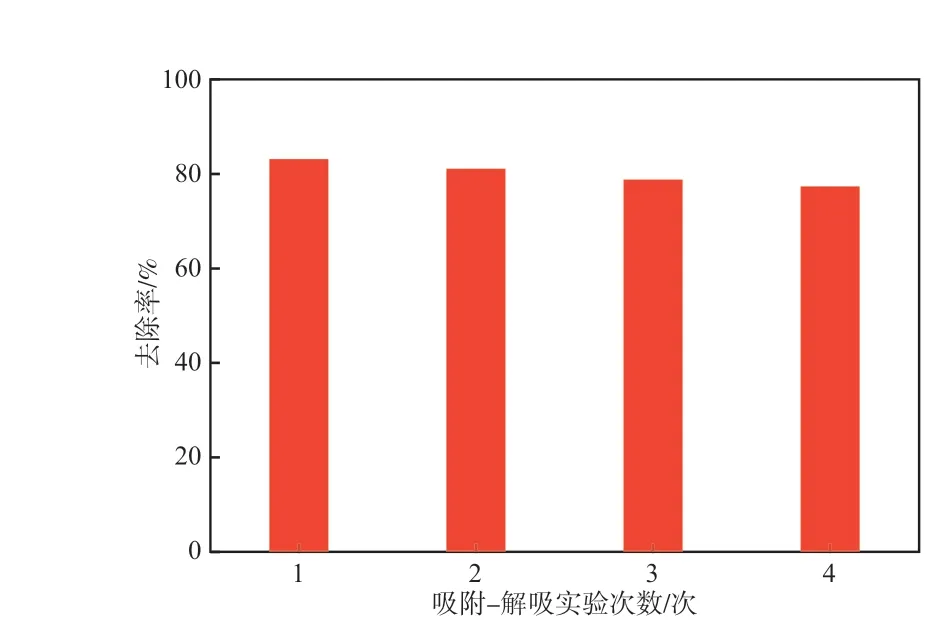
图9 Al15-Hem的吸附—解吸实验结果
由图9可见,Al15-Hem经过4次吸附—解吸后,U(Ⅵ)去除率仍大于77.6 %,表明Al15-Hem具有一定的重复利用性。
2.5 机理研究
2.5.1 官能团分析
图10为Hem和Al15-Hem吸附U(Ⅵ)前后的FTIR谱图。由图10可见:3 399 cm-1处是Hem表面—OH的伸缩振动特征峰[13],1 381 cm-1处为M—OH(M为Fe/Al)的—OH的弯曲振动峰[14];吸附U(Ⅵ)后,含氧官能团—OH和M—OH所对应的峰面积均有所减弱,峰位置从3 399 cm-1、575 cm-1和486 cm-1处移动至3 418 cm-1、584 cm-1和483 cm-1处,推测U(Ⅵ)与—OH和M—O官能团发生了配位反应[15]。
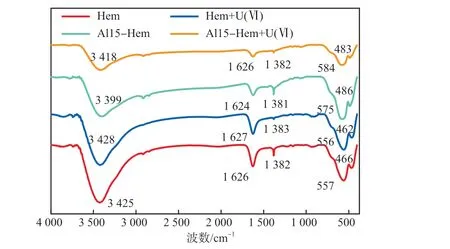
图10 Hem和Al15-Hem吸附U(Ⅵ)前后的FTIR谱图
2.5.2 XPS图谱分析
图11为Al15-Hem吸附U(Ⅵ)后的XPS谱图。由图11a可见:谱图中出现了U 4f的特征峰,表明U成功地吸附在了Al15-Hem上;U 4f7/2和U 4f5/2的两个峰分别在381.75 eV和392.40 eV[16],U的价态并未发生变化,表明U(Ⅵ)是以化学键的形式与Al15-Hem结合。由图11b可见:吸附U(Ⅵ)后,—OH、Fe—O和Al—O结合能分别由531.78,529.76,531.17 eV变为531.85,529.77,531.19 eV,推测Al15-Hem中的含氧官能团(—OH、Fe—O、Al—O)与U(Ⅵ)可能发生了配位反应。
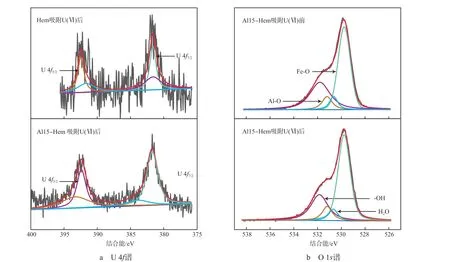
图11 Al15-Hem吸附U(Ⅵ)后的XPS谱图
3 结论
a)Hem掺加Al后,对U(Ⅵ) 吸附去除能力显著提高。在吸附温度为25 ℃、初始pH为6、Al15-Hem投加量为0.20 g/L、吸附时间为120 min、初始U(Ⅵ)质量浓度为5 mg/L的条件下,U(Ⅵ)去除率可达98.8%。4次吸附—解吸实验后,Al15-Hem对U(Ⅵ)的去除率仍大于77.6%,具有一定的可重复利用性能。
b)准二级动力学能够较好地描述Al15-Hem对U(Ⅵ)的吸附过程。通过Langmuir模型得到Al15-Hem对U(Ⅵ)的理论饱和吸附量为136.2 mg/g。
c)Al15-Hem对U(Ⅵ)的吸附以化学吸附为主,其机理可能是U(Ⅵ)与吸附剂表面的含氧官能团发生了配位反应。
