心脏磁共振在评估肝豆状核变性心肌受累中的应用
2022-12-12张杰邓炜喻绪恩徐银石永光赵韧李裕国安书田张亮亮束宏敏钱银锋刘斌杨任民余永强李小虎
张杰,邓炜,喻绪恩,徐银,石永光,赵韧,李裕国,安书田,张亮亮,束宏敏,钱银锋,刘斌,杨任民,余永强,李小虎*
1.安徽中医药大学神经病学研究所附属医院神经内科,安徽 合肥 230061;2.安徽医科大学第一附属医院放射科,安徽 合肥 230022;3.安徽医科大学第一附属医院心血管内科,安徽 合肥 230022
肝豆状核变性(Wilson's disease,WD)是一种罕见的常染色体隐性遗传病,患病基因携带率为1/90,发病率约为0.25/10 000~4/10 000[1-2]。WD患者由于过量的铜无法代谢而造成铜沉积于肝脏和神经系统[3-6]。此外,过量的铜会耗尽肝脏的铜存储能力,最终导致铜释放到血液中,并在其他器官积累[7]。既往研究显示,铜可以沉积于心脏,导致心血管系统疾病相关临床症状[8]。WD患者普遍存在不同程度的心脏受累,尤其是无创早期识别WD患者的亚临床心肌损害,早期干预治疗,可以显著改善预后[9-11]。
目前,临床检测WD患者的心肌损害主要依靠心电图和超声心动图[12-16],但两者检测心肌微结构和功能改变的敏感度不足,缺乏典型特征,难以准确识别WD的心肌损害[17-18]。心脏磁共振(cardiac magnetic resonance,CMR)是近年无创识别心脏受累的影像检查方法,不仅可以一站式评价心脏的形态、结构和功能,还可以识别心脏的亚临床损害和心肌纤维化等心肌组织学表征[19-20]。目前国内鲜有关于WD的CMR研究,本研究拟对WD患者的CMR资料进行分析,探究CMR在WD患者心肌受累中的应用价值。
1 资料与方法
1.1 研究对象 回顾性收集2022年4—6月安徽医科大学第一附属医院行CMR检查的12例WD患者,其中男7例,女5例,年龄16~53岁。纳入标准:①WD的临床诊断符合《肝豆状核变性诊疗指南(2022年版)》[21]中的诊断标准(Leipzig评分系统),总分≥4分即可确诊,3分为疑似诊断,≤2分排除诊断,对于疑似诊断为WD者,进一步行ATP7B基因检测以明确诊断;②超声心动图检查未见明显异常。排除标准:①患有高血压、糖尿病等其他心血管风险疾病;②CMR图像出现严重伪影,影响诊断。同时纳入年龄、性别、体重指数、体表面积等与WD患者相匹配的12名健康志愿者作为对照组,年龄23~34岁。收集受试者的临床基线资料、心电图结果和CMR检查结果。本研究经医院伦理委员会批准(PJ2022-09-59),免除患者知情同意。
1.2 CMR图像采集和分析 采用Philips Ingenia 1.5T超导MR仪及商用32通道相控阵体线圈。扫描序列及参数:采用黑血序列采集从主动脉弓至心尖18~20层图像,观察心脏和心脏大血管的形态结构,扫描参数:视野(FOV)300 mm×300 mm,TR 1 500 ms,TE 28 ms,翻转角90°,层厚8 mm,层间隔8 mm,矩阵168×130。采用回顾性心电门控平衡稳态自由进动序列进行心功能电影成像,采集心脏8~10层连续短轴电影图像和左心室长轴两腔心、长轴三腔心、长轴四腔心、左心室流出道切面,扫描参数:FOV 300 mm×300 mm,TR 3.4 ms,TE 1.68 ms,翻转角60°,层厚8 mm,层间隔8 mm,矩阵176×166。采用改良的Look-Locker反转恢复序列采集左心室短轴切面(基底层、中间层和心尖层)增强前T1 mapping(初始T1)图像。注射钆喷替酸葡甲胺后约15 min采集与增强后T1 mapping(post T1)图像,注射剂量0.2 mmol/kg,扫描参数:FOV 300 mm×300 mm,TR 3.0 ms,TE 1.4 ms,翻转角35°,层厚7 mm,层间隔14 mm,矩阵152×150。采用梯度自旋回波序列采集左心室短轴切面(基底层、中间层和心尖层)T2 mapping图像,扫描参数:FOV 300 mm×300 mm,TR 750 ms,ΔTE 9.3 ms,回波链9,翻转角90°,层厚7 mm,层间隔14 mm,矩阵152×150。采用相位敏感反转恢复序列于注射钆喷替酸葡甲胺10~15 min后进行心肌延迟增强(late gadolinium enhancement,LGE)成像,包括心脏8~10层连续短轴电影图像以及左心室长轴两腔心、长轴三腔心、长轴四腔心切面,扫描参数:FOV 300 mm×300 mm,TR 6 ms,TE 3 ms,翻转角25°,层厚8 mm,层间隔8 mm,矩阵188×152。采用CVI42后处理软件在8~10层连续短轴电影图像的收缩末期与舒张末期自动勾画心内膜与心外膜轮廓(必要时手动调整),并自动计算生成一系列心功能指标,包括左心室射血分数(left ventricular ejection fraction,LVEF)、左心室舒张末期容积指数(left ventricular end-diastolic volume index,LVEDVI)、左心室每搏输出量指数(left ventricular stroke volume index,LVSVI)、右心室射血分数(right ventricular ejection fraction,RVEF)、右心室舒张末期容积指数(right ventricular end-diastolic volume index,RVEDVI)、右心室每搏输出量指数(right ventricular stroke volume index,RVSVI)。于T1 mapping与T2 mapping短轴切面图像中自动勾画心内膜与心外膜轮廓(必要时手动调整),并自动计算生成左心室短轴(基底层、中间层和心尖层)心肌的平均T1弛豫时间与T2弛豫时间。结合受检者24 h内红细胞压积,根据公式[22]计算左心室短轴(基底层、中间层和心尖层)心肌的平均细胞外容积分数(extracellular volume,ECV)。
1.3 可重复性分析 随机选取6例WD患者和6名健康志愿者,由2位具有MR诊断经验的放射科医师独立进行T1 mapping和T2 mapping分析,其中1位观察者30 d后再进行一次分析,分别评价观察者间和观察者内的可重复性。
1.4 心电图和实验室检查 收集患者行CMR检查前24 h内的心电图检查与实验室检查指标。实验室检查指标包括血浆铜蓝蛋白(正常参考值为200.0~420.0 mg/L)、血清铜(正常参考值为10.5~24.4 μmol/L)、24 h尿铜(正常参考值>100 μg/d)[21]。
1.5 统计学方法 使用SPSS 26.0 软件,采用Kolmogorov-Smirnov检验计量资料的正态性分布。符合正态分布的计量资料以表示,两组间比较采用独立样本t检验;不符合正态分布的计量资料以[M(Q1,Q3)]表示,两组间比较采用Mann-WhitneyU检验。计数资料以例数(%)表示,两组间比较采用χ2检验。采用组内相关系数(ICC)评估观察者间和观察者内测量的一致性,P<0.05表示差异有统计学意义。
2 结果
2.1 可重复性分析结果 初始T1的观察者内与观察者间一致性较好[ICC=0.99(95%CI0.98~1.00)、0.98(95%CI0.93~0.99)],T2的观察者内与观察者间一致性较好[ICC=0.98(95%CI0.94~0.99)、0.98(95%CI0.92~0.99)]。
2.2 两组受试者临床基线资料比较 研究组与对照组受试者的年龄、性别、心率、体重指数、体表面积比较,差异均无统计学意义(P>0.05),见表1。两组受试者均无高血压、高血脂、糖尿病、冠心病家族史、房颤、心衰、呼吸困难、胸痛、外周水肿、心悸、意识丧失等。研究组4例有吸烟史。
表1 研究组与对照组临床基线资料比较()

表1 研究组与对照组临床基线资料比较()
2.3 研究组患者心电图与实验室检查结果 研究组患者血浆铜蓝蛋白为(50.0±26.5)mg/L,血清铜为(2.2±1.1)μmol/L,均较正常参考值降低。24 h尿铜为(976.2±679.8)μg/d,较正常参考值升高。心电图结果显示,12例WD患者中,频发室性早搏2例,窦性心律不齐3例,窦性心动过缓1例。
2.4 心脏MRI结果 12例WD患者中,LGE阳性2例,均为室间隔右心室插入部(图1A),呈小斑片状,其中1例可见心中部左心室室间隔处心肌裂(图2)。研究组患者的初始T1、T2与ECV(图1B~D)较对照组显著升高(P<0.05)。研究组LVEF、LVEDVI、LVSVI、RVEF、RVEDVI、RVSVI与对照组比较,差异均无统计学意义(P>0.05)。两组CMR检查结果比较见表2。
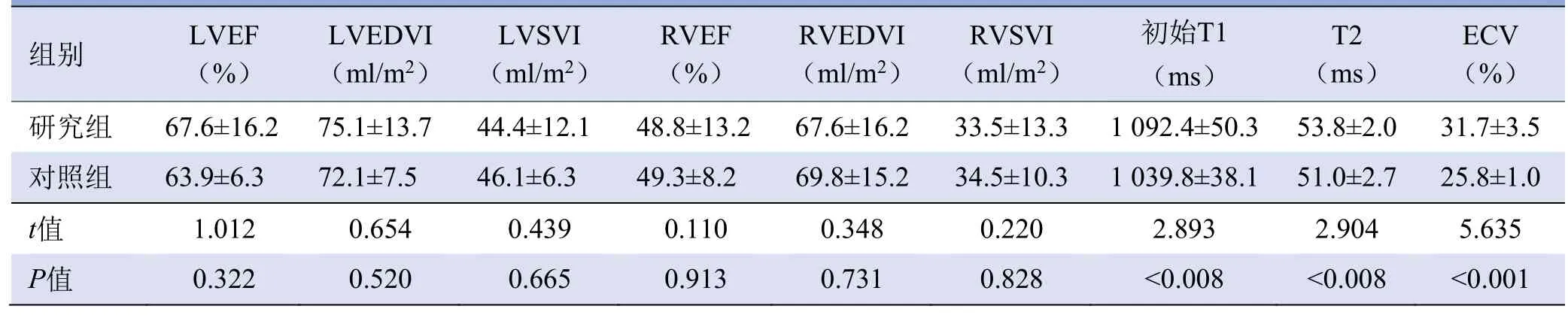
表2 研究组与对照组的CMR检查结果比较

图1 女,17岁,WD患者CMR图像。心肌延迟增强示短轴心中部左心室下壁右心室插入部可见小斑片状延迟强化(A);左心室整体心肌初始T1为1 110 ms(B);左心室心肌整体ECV为31%(C);左心室整体心肌T2为55 ms(D)

图2 男,53 岁,WD 患者CMR 图像。四腔心电影序列示室间隔中部(A)可见由心内膜凹向室间隔的间隙(心肌裂);心肌延迟增强四腔心层面可以清晰显示心肌裂结构(B)
3 讨论
本研究为国内首次报道关于WD患者的CMR研究。本研究结果显示,尽管WD患者早期无明显的心血管系统疾病相关临床症状,心脏结构与心功能均正常,但其初始T1、T2、ECV较健康志愿者明显升高,且在WD患者中出现LGE与左心室心肌裂征象,表明CMR对早期识别WD患者心肌受累具有较好的临床应用价值。
3.1 CMR在WD患者心肌受累中的应用 心肌T1值与ECV是与弥漫性纤维化相关的心脏疾病的重要指标,对患者预后具有良好的预测价值[23-27]。本研究发现,WD患者的初始T1值、T2值与ECV较对照组显著升高,与Salatzki等[28]的研究结果一致。Factor等[9]通过尸检报告发现WD患者普遍存在不同程度的间质性和替代性纤维化、心肌内小血管疾病和局灶性心肌炎,可能解释本研究中CMR的异常改变。因此,本研究推测心肌纤维化与心肌水肿或炎症可能是WD患者早期心肌受累的表现之一。
LGE是无创评估心肌纤维化的“金标准”[29]。本研究发现2例心肌LGE阳性,均为心肌基底部下侧壁与右心室插入部LGE,与既往研究中WD队列患者存在心肌LGE,且LGE最常见于右心室插入点[26,28]基本一致。Quick等[18]发现11例(18.0%)WD患者存在室间隔心肌LGE,58例(95.1%)WD患者存在右心室插入点LGE。Salatzki等[28]发现8例(10.5%)WD患者出现室间隔LGE,5例(6.6%)出现下侧壁LGE,13例(17.1%)存在右心室插入点LGE。但右心室插入点的LGE是否为WD最常见的心肌强化模式,以及其强化特点与病程、种族之间是否相关,仍需要多中心大样本队列研究深入探讨。
心肌裂是与心肌纤维或肌束紊乱相关的先天性异常,其临床意义尚存在争议。本研究中,1例WD患者存在左心室心肌裂征象,这也是国内首次在WD患者中报道该发现。Zhang等[30]在WD队列中基于CMR电影序列识别的心肌裂占20%(12/61)。本研究中尚不能确定左心室心肌裂由何种病理机制引起,亦不能确定是否与病理性铜在心脏内蓄积有关,仍需进一步深入研究。但值得提出的是,超声心动图并未发现本例患者存在心肌裂,因此建议将CMR作为评估WD患者心肌受累的常规成像方式,尤其是在明确患者是否存在心肌裂时。
本研究中,所有WD患者的超声心动图均正常,6例存在非特异性心电图异常改变。本研究结果表明,由于缺乏典型特征,仅依靠心电图和超声心动图不足以检测心肌微结构和功能的变化,难以发现和诊断WD患者的早期心肌损害。CMR定量成像技术可在WD患者无临床症状时发现异常心肌改变,对评价患者是否存在早期心肌受累有潜在的临床应用价值。
3.2 本研究的局限性 本研究为回顾性研究,存在一定的选择偏倚;本研究为单中心研究,且样本量较小;所有患者均未进行心肌活检,无法探究T1、T2、ECV、心肌LGE区域与心肌组织学之间的相关性。
总之,无明显心脏临床症状的WD患者可能存在亚临床心肌损伤,使用CMR多参数T1 mapping、T2 mapping和ECV可以早期识别WD患者是否存在心肌受累,CMR可以作为评估WD患者心脏受累的重要检查方法。
利益冲突 所有作者均声明不存在利益冲突
