利用多重连接探针扩增结合熔解曲线法鉴别五味子与南五味子掺杂*
2022-12-09程华春王文斌莫静聂晶汪波
程华春,王文斌,莫静,聂晶,,汪波
(1.湖北中医药大学药学院,武汉 430065;2.湖北大学生命科学学院,武汉 430062;3.湖北省药品监督检验研究院国家药品监督管理局中药质量控制重点实验室,武汉 430075)
中药五味子为木兰科植物五味子Schisandrachinensis(Turcz.) Baill.的干燥成熟果实,习称北五味子;南五味子为木兰科植物华中五味子SchisandrasphenantheraRehd.et Wils.的干燥成熟果实[1]。长期以来,五味子和南五味子均作五味子使用,自《中华人民共和国药典》2000年版开始将二者作为两个品种分开收录并制定不同质量标准,但对性味归经、功能主治没有进行区分,临床用药也没有明确规定,二者常常被混用[2]。对二者的疗效各时期医药学家持不同观点[3],五味子偏于补益五脏,而南五味子敛肺平喘功效更佳,在木脂素类型和含量方面也存在显著差异[4-6],化学成分的差异可能是其功效不同的主要原因。此外,二者市场价格差异很大,但外观形态相似,加工炮制后使鉴定更加困难,致使两者常掺混出售,给临床用药有效性和安全性带来巨大隐患。因此,开发快速准确鉴别五味子及南五味子的方法对安全用药具有重要意义。
多重连接依赖性探针扩增(multiplex ligation-dependent probe amplification,MLPA)技术是近年发展起来的一种DNA定性和半定量分析的核酸检测技术,可同时检测 40~50 个核苷酸序列,每个扩增片段长度唯一,可通过毛细管电泳分离判断目标基因的有无及相对含量[7-8],已广泛用于基因诊断、甲基化检测、遗传疾病分析等多个分子学诊断领域[9-11]。本研究基于五味子ITS2序列38bp处的T/G变异位点[12],设计多重连接依赖性探针,利用MLPA技术高效、快速、特异等优势,并与熔解曲线相结合,建立五味子和南五味子的熔解曲线模型,并根据熔解曲线Tm值的差异,建立中药材五味子和南五味子的分子鉴定方法,为准确鉴别五味子、南五味子及其掺混品提供参考。
1 材料与方法
1.1实验材料 五味子(批号120922-201610)、南五味子(批号121118-201003)对照药材购自中国食品药品检定研究院,31份商品药材收集于四川荷花池、安徽亳州、河北安国等药材市场,经湖北省药品监督检验研究院中药检验研究中心肖凌博士鉴定,16份为五味子,15份为南五味子,样品信息见表1。

表1 五味子和南五味子样品信息 Tab.1 Sample information of Schisandra chinensis and Schisandra sphenanthera
1.2仪器 电子天平(MS204S,瑞士梅特勒托利多科技有限公司,感量:0.1 mg),冷冻高速离心机(75002420型,美国Thermo Fisher公司,离心半径:8 cm),超微量分光光度计(Nano drop-2000,美国Thermo Fisher公司),PCR扩增仪(T100型,美国Bio-Rad),Gel Doc XR+凝胶成像系统(美国Bio-Rad),DYY-10C电泳仪(北京君意东方电泳设备有限公司),微波炉(格兰仕),MyGo Mini(Life Technologies,Carlsbad,California),SYERGYUV 超纯水系统(美国 Millipore),GGI54TW蒸汽消毒锅(ZEALWAY),BCD-25TMPM冰箱(海尔),MX-RL-E旋转混旋仪(大龙兴创实验仪器有限公司),LWB-26双列六孔电热恒温水浴锅(上海龙跃仪器设备有限公司),UF55干燥箱(德国美墨尔特公司),手动移液器(德国艾本德股份公司)。
1.3试剂 乙二胺四乙酸(分析纯,批号:20140728),氯化钠(分析纯,批号:20150519),三氯甲烷(分析纯,批号:20200601),异戊醇(分析纯,批号:20141114),异丙醇(分析纯,批号:20190902),无水乙醇(分析纯,批号:20210510),DDH2O,PVP-40(BS912,biosharp,纯度≥99.0%),β-Mercaptoethanol (M8210,Solarbio),CTAB(C8440,Solarbio),1.5 mol·L-1Tris-HCl缓冲液(T010,Solarbio),植物基因组DNA提取试剂盒(DP305-03,TSINGKE),DNA产物纯化试剂盒(D1300,Solarbio),金牌Mix(green)(TSE101,TSINGKE),琼脂糖(BIOWEST,182215),DL 1000 DNA Marker (Takara公司),9°NTMDNA ligase (M0238S,TSINGKE),2×T5 Fast qPCR Mix (SYBE Green Ⅰ)(TSE202,TSINGKE),引物和MLPA 探针由生工生物工程(上海)股份有限公司合成,其他试剂购自国药集团化学试剂有限公司。
1.4实验方法
1.4.1MLPA探针设计 在NCBI(https://www.ncbi.nlm.nih.gov/)数据库中下载五味子和南五味子ITS2序列,导入MEGA6软件筛选主导单倍型并进行比对,五味子ITS2序列第38个碱基为G,南五味子为T,且该位点较稳定。在该位点上下游各截取适宜长度设计两对探针,使用UNAfold(http://www.unafold.org/mfold/ applications/dna-folding-form.php)网站对探针质量进行评价,在NCBI GenBank中通过BLAST搜索评估探针序列的特异性,使用Primer3(https://bioinfo.ut.ee/primer3-0.4.0/)网站设计扩增引物,设计好的引物和探针交由生工生物工程(上海)股份有限公司合成。新合成的引物和探针使用前在冷冻高速离心机中12 000 r·min-1离心30 min,按照标示加入缓冲液配成10 μmol·L-1的溶液储存,使用时稀释成1 μmol·L-1工作溶液备用。探针和引物序列信息见表2。

表2 MLPA探针和引物序列信息 Tab.2 MLPA probe and primer sequence information
1.4.2样品DNA的制备 分别取对照药材和样品粉末50~80 mg,参照文献[13]的改良CTAB法提取样品DNA并做适当修改:将样品放入2 mL离心管中,加入两粒钢珠,于研磨仪中研磨2 min,向研磨好的样品中加入CTAB提取液并于65 ℃下水浴加热1 h,每隔10 min摇匀一次,水浴后加入等体积三氯甲烷/异戊醇(24:1),颠倒摇匀后12 000 r·min-1离心5 min。取上清液加入等体积的三氯甲烷/异戊醇(24:1),颠倒摇匀后12 000 r·min-1离心5 min。将冰的异丙醇加入到1.5 mL离心管中,然后取等体积上清液加入到该离心管,于-20 ℃冰箱放置30 min后拿出,从上往下吸取加入到吸附柱,12 000 r·min-1离心1 min,弃去收集管中废液。加入无水乙醇,静置5 min,12 000 r·min-1离心1 min,弃废液,重复操作两次。空吸附柱12 000 r·min-1离心2 min,将吸附柱移入1.5 mL离心管中,打开吸附柱盖子,风干。风干后加入5 ℃预热的TE缓冲液40~80 μL ,静置5 min,12 000 r·min-1离心2 min,制备好的DNA样品原液置于-20 ℃冰箱中保存备用。
使用超微量分光光度计测定DNA 含量,根据A260/A280评估DNA质量,当A260/A280比值<1.8时,说明可能有蛋白质污染,当比值>2.0时,可能有RNA存在,该比值在1.8~2.0范围内表明DNA质量良好[13-14]。取质量较好的DNA用扩增引物WWZ-F和WWZ-R进行聚合酶链反应(PCR)扩增,随后参照试剂盒中说明书步骤纯化,得到MLPA反应的DNA模板。将反应模板逐步稀释,得到不同含量的DNA模板。另取DNA模板制成掺混样品,使南五味子所占比例依次为90%,80%,70%,60%,50%,40%,30%,20%,10%,5%。制备好的样品保存在-20 ℃冰箱中供后续实验使用。
1.4.3MLPA-熔解反应 取样品DNA1 μL,探针1.5 μL,加入TE缓冲液5.5 μL,混匀后置PCR仪中进行杂交反应,98 ℃变性5 min,70 ℃杂交20 min,45 ℃取出[15]。杂交完成后,取DNA杂交产物1.28 μL,加入9°N DNA ligase连接酶体系6.72 μL,置PCR仪中45 ℃ 15 min,98 ℃ 5 min,使探针连接成一条完整链。冷却后取5 μL连接产物,加入2×T5 Fast qPCR Mix 10 μL,正向引物Primer_F 0.8 μL,反向引物Primer_R 0.8 μL,50×Rox Reference Dye Ⅰ 0.4 μL,加DDH2O补齐到20 μL体系,95 ℃ 60 s ;95 ℃ 10 s,60 ℃ 5 s,72 ℃ 15 s,扩增30个循环;72 ℃ 5 min。95 ℃ 保温3 min后进行熔解程序,荧光采集温度设置为45~97 ℃(0.05 ℃·s-1)。每个反应进行 3 次重复实验。
2 结果
2.1探针特异性分析 将表 2中所列探针按照 MLPA 扩增反应要求制备成单一探针和混合探针,分别以五味子及南五味子对照药材提取的DNA以及混合DNA为模板进行MLPA-熔解反应。单一探针特异性结果见图1A。从图中可以看出,五味子DNA模板与五味子探针进行实验时,产生82.3 ℃熔解曲线峰;南五味子DNA模板与南五味子探针进行试验时,产生80.7 ℃熔解曲线峰。五味子探针与南五味子DNA模板、南五味子探针与五味子DNA模板以及以TE缓冲液1 μL代替DNA模板进行实验时,均不产生熔解曲线峰。表明两个物种只与其对应的MLPA探针进行杂交,不出现非特异性熔解曲线峰,可以认为单一探针的特异性良好。混合探针特异性结果见图1B。制备的混合探针分别与五味子、南五味子DNA模板进行实验时,分别产生82.3和80.7 ℃熔解曲线峰,与单一探针结果一致,说明两种探针混合后并不影响探针特异性,表明混合探针特异性良好。
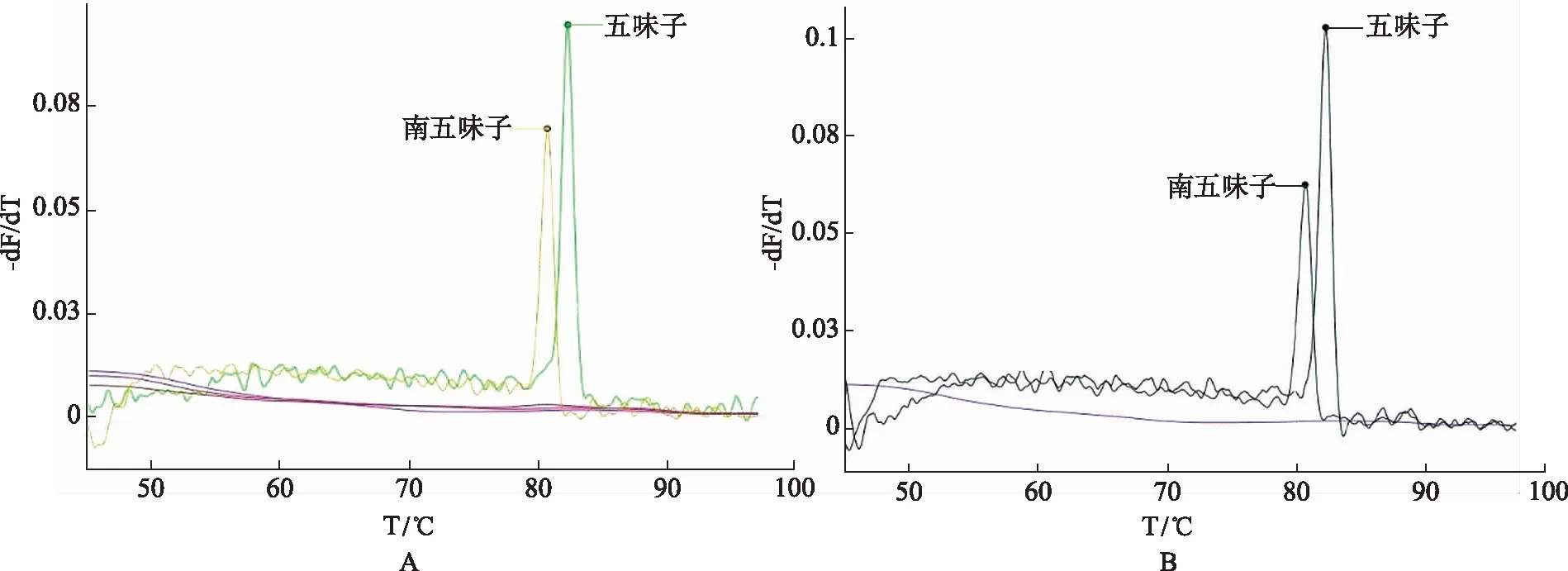
A.单一探针特异性;B.混合探针特异性。图1 探针特异性实验熔解曲线图谱 A.Single probe specificity ;B.Mixed probe specificity.Fig.1 Melting curve of probe specificity test
2.2敏感性实验结果 将五味子、南五味子的DNA模板量逐渐由高降低,分别与混合探针杂交进行敏感性试验,验证方法的灵敏度。当五味子模板DNA量为221.5,109.4,50.5,25.2,14.1,11.1,5.7,2.6,1.2,0.9,0.45,0.25 ng,南五味子模板DNA量为221.3,110.5,55.1,27.1,11.2,10.3,5.5,1.6,1.1,0.8,0.55,0.4 ng时,可产生相对应的熔解曲线峰,熔解曲线的峰高与模板DNA的量不存在相关性。直到五味子、南五味子模板DNA量降至0.1,0.2 ng时,熔解曲线接近于水平(图2,图3)。此结果表明MLPA技术鉴别这两个物种有较高的灵敏度,五味子的检出限为0.1 ng,南五味子的检出限为0.2 ng,且此方法的重复性好,因而可以用于市场上五味子和南五味子的鉴定。
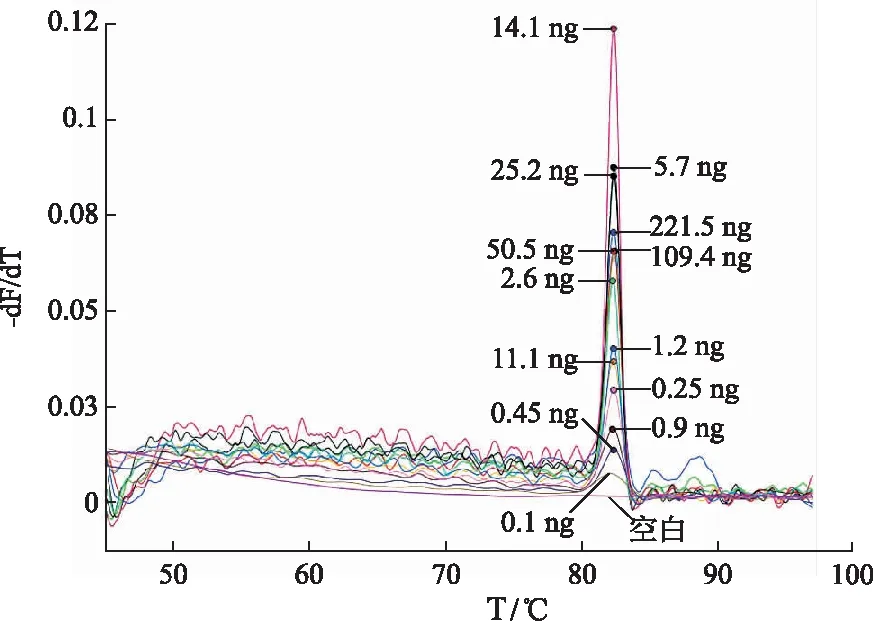
图2 五味子探针灵敏度实验结果 Fig.2 The sensitivity test results of Schisandra chinensis probe
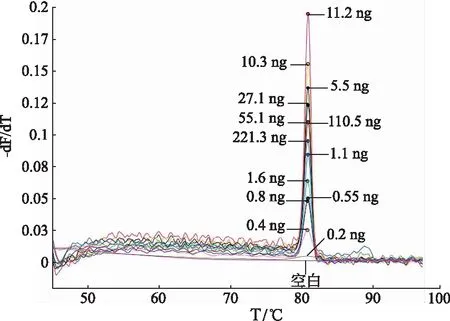
图3 南五味子探针灵敏度实验结果 Fig.3 The sensitivity test results of Schisandra sphenanthera probe
2.3混合样品实验结果 将五味子和南五味子DNA模板按比例混合进行MLPA反应,检测该方法是否适合检测混合样品,结果见图4。当南五味子所占比例为80%,70%,60%,50%,40%,30%时,能检测到归属于五味子(Tm=82.3 ℃)和南五味子(Tm=80.7 ℃)的熔解曲线双峰。当南五味子比例下降至20%及更低,北五味子比例下降至10%及更低时,便只产生单一的熔解曲线峰。这表明当五味子样品中南五味子所占比例≥30%或者南五味子样品中五味子所占比例时≥20%时可用此方法来检测掺混样品。
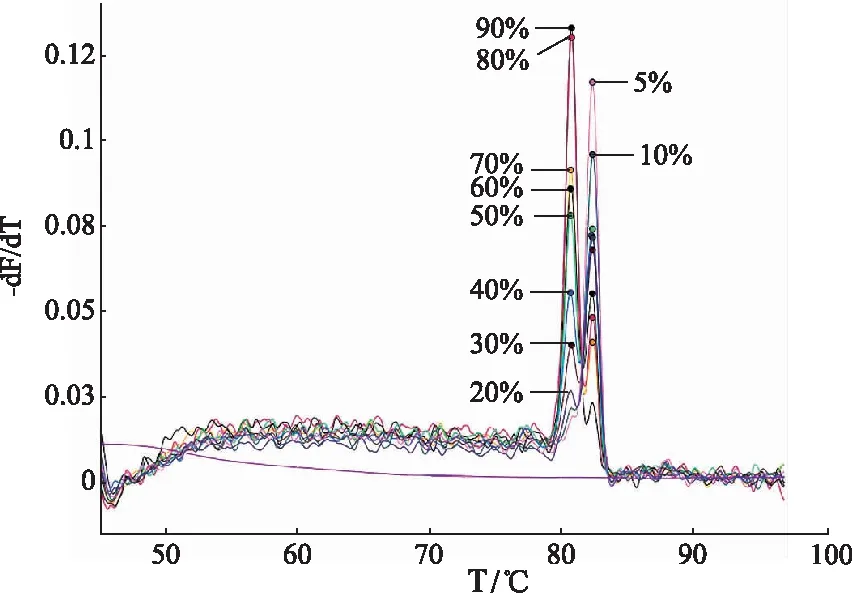
图4 混合样品实验结果 Fig.4 Test results of mixed samples
2.4市场商品分析 对市场上收集到的31份商品药材提取DNA后一部分进行MLPA-熔解反应,比较分析所得到的熔解曲线峰;另一部分送至测序公司进行测序,并与GeneBank中的序列对比,确认其基源。16份五味子药材出现(82.3±0.3) ℃的熔解曲线峰,15份南五味子药材出现(80.7±0.3) ℃的熔解曲线峰,表明16份为五味子,15份为南五味子,结果与测序结果一致,表明本研究建立的方法检测结果无误,根据Tm值能够准确的将五味子和南五味子区分开。
3 讨论
目前关于中药材的DNA提取大多数基于DNA含量丰富的新鲜干燥叶片,然而在市场上流通以及供临床使用的更多的是药材,所以直接以药材作为DNA提取的原料更为合适。五味子是一种果实类中药,本课题组前期在DNA提取过程中,首先采用了试剂盒提取的方法,提取到的DNA浓度较低、质量差,通过查阅相关文献[16],以种仁为提取材料,对比发现采用改良CTAB法得到的DNA质量最佳。
我国的药用植物品种繁多,基源复杂。近年来,因为误用混用造成中药毒副事件常有发生,因而建立一种简单准确、易于操作的方法鉴定药用植物基源确保临床用药安全至关重要。相比于性状鉴别、显微鉴别、理化鉴别来说,分子生物学鉴定技术准确性高、重复性好、不易受环境因素和加工炮制方法的影响,受到了广大研究者的青睐。目前虽已有学者利用ISSR[17-18]、RAPD[19-20]、DNA条形码[12,21]等方法对南、北五味子进行了鉴定,但这些方法在检测速度和检测准确度方面存在一些局限性。
传统的MLPA产物采用毛细管电泳进行结果分析,不仅费时,而且将PCR产物取出过程中存在可能产生气溶胶污染的风险。为弥补传统MLPA技术的不足,本研究引入熔解曲线分析,在分子生物学基础上,将MLPA技术和熔解曲线相结合建立了一种快速鉴定五味子和南五味子的方法。选用ITS2序列作为扩增片段,MLPA反应基本步骤包括探针和目的序列 DNA 杂交、连接、PCR 扩增,此方法的特异性体现在探针的设计上,每条探针包括两个核苷酸片段,只有当两个片段完全与目的序列杂交互补后才能被连接酶连接成一条完整的序列,进而进行后续反应,即使有一个碱基不匹配也会导致连接反应无法进行。随后进行PCR扩增和熔解,这两个步骤只需一个荧光定量PCR仪就能完成,且在完成PCR过程之后,无需将样品取出直接进行熔解程序,通过实时监控DNA双链熔解过程中荧光信号的积累,就能直观地看到DNA双链熔解随温度变化曲线的差异,扩增片段的碱基序列、片段长度、GC含量都会对Tm值产生影响[22],从而在不同的位置出现熔解曲线峰,以此将不同的物种区分开。本实验设计的两条探针长度分别为113和110 bp,但是实际参与杂交的序列只有约60 bp,其余的为引物和填充序列,对样品DNA的完整性要求低,即使DNA发生降解也不会对实验结果产生影响。在不计算DNA提取时间的情况下,仅需要2~3 h就能完成至少16个样品的鉴定,而且操作简单、结果准确性高、重现性好。
通过MLPA技术结合熔解曲线能够高效快速地将五味子和南五味子区分开,在今后的研究中,可以尝试将此方法应用到含五味子的中成药的检测中,同时此研究也可以为其他中药品种的MLPA鉴定提供参考。
