LC-MS/MS法测定苯磺酸氨氯地平胶囊中两种潜在基因毒性杂质的含量
2022-12-09孙朗石明睿熊志立
孙朗,石明睿,熊志立
(1.沈阳药科大学药学院,沈阳 110016;2.丽珠集团丽珠制药厂,珠海 519045)
近年国内仿制药及一致性评价审评中日益重视杂质谱的研究,特别是潜在基因毒性杂质的评估[1-2]。苯磺酸氨氯地平胶囊临床应用广泛,是治疗高血压病的首选药物之一[3]。由于苯磺酸在合成过程中可能引入苯磺酸甲酯、苯磺酸乙酯、苯磺酸异丙酯等基因毒性杂质,目前国内外对苯磺酸氨氯地平各剂型药物基因毒性杂质的报道多为配体苯磺酸所引入的苯磺酸酯类杂质[4-5]。作者依据国家药品监督管理局药品审评中心“关于公开征求4个ICH指导原则中文翻译稿意见的通知”和“Q3C(R8):杂质:残留溶剂的指导原则”,对该品种的起始物料、中间体、副反应及降解产物进行系统研究,筛选出2个分别具有氮杂环氮氧和酰化芳香氨警示结构[6-8]的非苯磺酸酯类潜在基因毒性杂质:氨氯地平氮氧化物和4-(2-(1,3-二氢 -二氧代异吲哚啉-2-基)乙氧基)-3-氧代丁酸乙酯(以下简称杂质A和B,结构见图1),并依据化合物的极性和结构特点,结合所需控制的杂质限度,开发灵敏度高、专属性强的LC/MS方法[9-11]对其含量进行测定,为苯磺酸氨氯地平胶囊的质量控制提供参考依据。
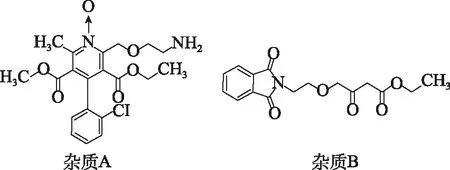
图1 苯磺酸氨氯地平中潜在基因毒性杂质结构 Fig.1 Potential genotoxic impurities in amlodipine besylate
1 仪器与试药
1.1仪器 Triple Quad 5500液相色谱-三重四级杆串联质谱仪(美国 AB Sciex公司);SQP电子分析天平(美国赛多利斯科学仪器公司);KH-500E超声波清洗器(昆山禾创超声仪器);H1850离心机(湖南湘仪仪器实验室开发公司)。
1.2试药 氨氯地平氮氧化合物(Standardpharm公司,批号:1919336A-SL-01)、4-(2-(1,3-二氢 -二氧代异吲哚啉-2-基)乙氧基)-3-氧代丁酸乙酯(Standardpharm公司,批号:1819345A-SL-01),苯磺酸氨氯地平胶囊(丽珠集团丽珠制药厂,批号:V180901、V180902、V180903),参比制剂苯磺酸氨氯地平胶囊(Pfizer SA公司,批号:B217802B)。
2 方法与结果
2.1色谱条件 色谱柱为Agilent poroshell 120 EC-C18(4.6 mm×150 mm,2.7 μm);流速为 0.5 mL·min-1;柱温为40 ℃;自动进样器温度5 ℃;进样体积为2 μL;流动相A为5 mmol·L-1乙酸铵的0.1%甲酸溶液,流动相B为0.1%甲酸乙腈溶液,按以下条件(表1)进行梯度洗脱。

表1 梯度洗脱条件 Tab.1 Conditions of gradient elution
电喷雾离子源(ESI),正离子模式采集,多反应离子监测模式(MRM);杂质A和B的定量离子对分别为 423.0/334.0和320.1/174.0;干燥气离子源温度为 600 ℃;干燥气流速为 35.0 psi;雾化离子化电压为 5500 V;雾化气50 psi;辅助加热气50 psi;传输电压为 85 V;碎裂电压为 15 V;扫描范围为m/z100~500,质谱图见图2。
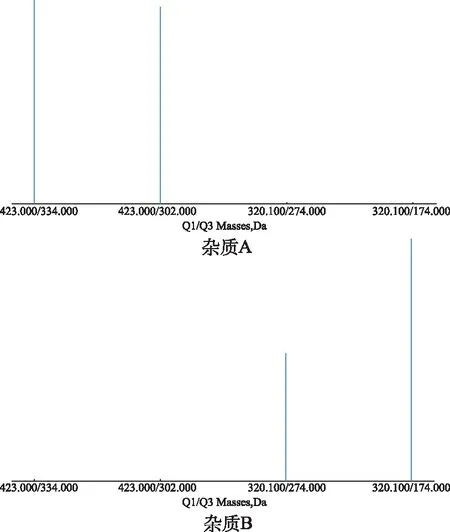
图2 杂质A和B的质谱图 Fig.2 Mass spectrum of impurity A and B
2.2溶液制备
2.2.1对照品溶液的制备 精密称取杂质A和B对照品适量,用乙腈稀释成每毫升含杂质A 22 ng·mL-1、杂质B 22 ng·mL-1的溶液,作为对照品溶液。
2.2.2供试品溶液的制备 精密称取苯磺酸氨氯地平胶囊内容物适量(相当于苯磺酸氨氯地平5.0 mg),置50 mL离心管中,精密加入溶剂乙腈25 mL,涡旋,超声5 min,10 000 r·min-1离心5 min,取上清液作为供试品溶液。
2.2.3空白溶液的制备 取乙腈滤过后即可。
2.3专属性考察 取各个杂质的对照品溶液、加标供试品溶液(100%浓度水平)及空白溶液,依法测定。得到的色谱图表明:各杂质对照品溶液及加标供试品溶液在同一位置显示目标分子量峰,空白溶液无干扰,本方法专属性良好,典型色谱图见图3。
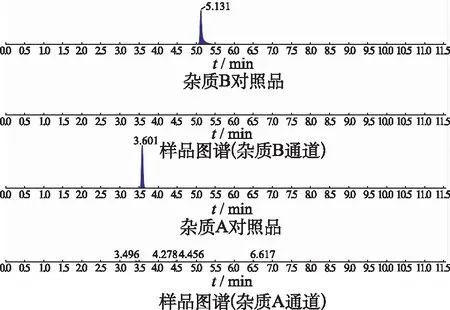
图3 杂质对照品及样品质谱图 Fig.3 Mass spectrum of impurities and sample
2.4定量限与检测限考察 精密称取各杂质对照品适量,加乙腈配制成每毫升含杂质A约4.5 ng·mL-1,杂质B约4.3 ng·mL-1的溶液,作为定量限溶液,依法检测6次。结果表明:各杂质6次测试结果信噪比约等于10;杂质A和B连续6针定量限溶液中目标峰峰面积的RSD分别为2.0%和0.8%,本方法定量限能满足需求。
精密量取定量限溶液2.5 mL,置于5 mL量瓶中,加乙腈定容,制成每毫升含杂质A约2.3 ng·mL-1,杂质B约2.2 ng·mL-1的溶液,作为检测限溶液,依法检测6次。结果表明:各杂质6次测试结果信噪比约等于3,本方法检测限能满足需求。
2.5线性关系考察 精密称取杂质A和B对照品各10.255和9.986 mg,分别置于100 mL量瓶,加乙腈溶解并定容至刻度。精密量取上述溶液各0.22 mL置于100 mL量瓶,加乙腈定容至刻度,制得含两杂质浓度分别为225.6和219.7 ng·mL-1的杂质对照品储备液(1000%限度浓度)。分别精密量取上述对照品储备液0.2,0.5,1,1.5和2,0 mL置于10 mL量瓶,加乙腈定容至刻度,制得含杂质A浓度为4.51,11.28,22.56,33.84,45.12 ng·mL-1;杂质B浓度为4.39,10.98,21.97,32.95,43.93 ng·mL-1各共5个浓度水平的线性溶液。将上述溶液依次依法测定,结果见表2。以浓度为横坐标,峰面积为纵坐标,进行线性回归,可得杂质A线性方程为Y=8.164×104X+70 146(r=0.990);杂质B线性方程为Y=2.362×105X+35 610(r=1.000)。结果表明:杂质A在4.51~45.12 ng·mL-1,杂质B在4.39~43.93 ng·mL-1浓度范围内,线性关系良好。

表2 线性考察实验结果 Tab.2 Linearity of two kinds of impurities
2.6精密度实验 取“2.5”项下各杂质100%浓度水平溶液(含杂质A和B的浓度分别为22.56和21.97 ng·mL-1),依法连续测定6次,分别计算杂质A和B含量的RSD值。结果表明:各杂质6次测定结果的RSD分别为0.6%和0.5%,本方法精密度良好。
2.7重复性实验 另由不同研究实验人员在不同时间重复“2.6”项下实验,重新配制各杂质100%浓度水平溶液(含杂质A和B的浓度分别为22.52 ng·mL-1和22.03 ng·mL-1),依法连续测定6次,分别计算杂质A和B含量的RSD值。结果表明:各杂质6次测定结果的RSD分别为0.6%和0.8%,二名研究实验人员共12次测定中,杂质A的RSD为1.6%,杂质B的RSD为2.2%。本方法中间精密度良好。
2.8稳定性实验 取“2.5”项下杂质对照品储备液(1000%限度浓度)10 mL置于100 mL容量瓶,加乙腈定容至刻度,作为对照品溶液。精密称取苯磺酸氨氯地平胶囊内容物适量,置50 mL离心管中,加入25 mL对照品溶液,涡旋,超声5 min,10 000 r·min-1离心5 min,取上清液作为加标供试品溶液。在0,12,25 h依法检测,并与初始测定结果进行对比。结果表明:对照品溶液和加标供试品溶液放置25 h后,各个杂质含量的变化均在80~120%之间,对照品溶液和供试品溶液在25 h内均稳定。
2.9加样回收率实验 配制“2.5”项下杂质对照品储备液,分别精密量取2.5,5和7.5 mL至50 mL容量瓶,加乙腈定容至刻度,制得50%,100%和150%浓度对照品溶液。精密称取苯磺酸氨氯地平胶囊内容物适量(相当于苯磺酸氨氯地平5.0 mg),分别置于3个50 mL离心管中,分别精密量取加入上述3个浓度对照品溶液25 mL,旋涡,超声5 min,10 000 r·min-1离心5 min,取上清液,作为50%、100%、150%浓度加标供试品溶液。各浓度加标供试品溶液平行配置3份。取上述溶液依法检测,计算各浓度平均回收率,并计算RSD值,结果见表3,4。
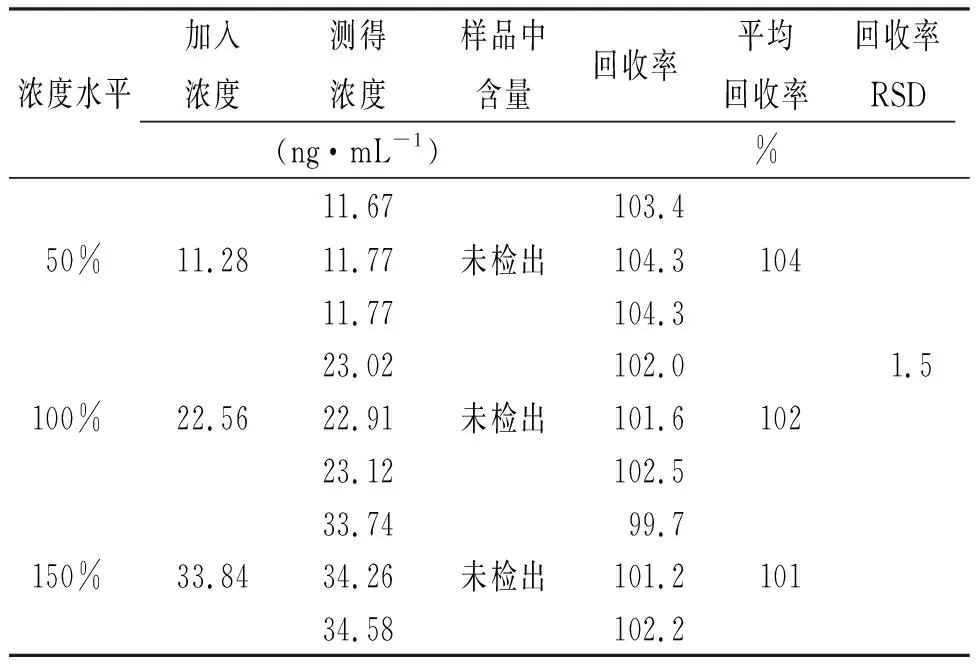
表3 杂质A加样回收率的测定结果 Tab.3 Recovery result of impurity A
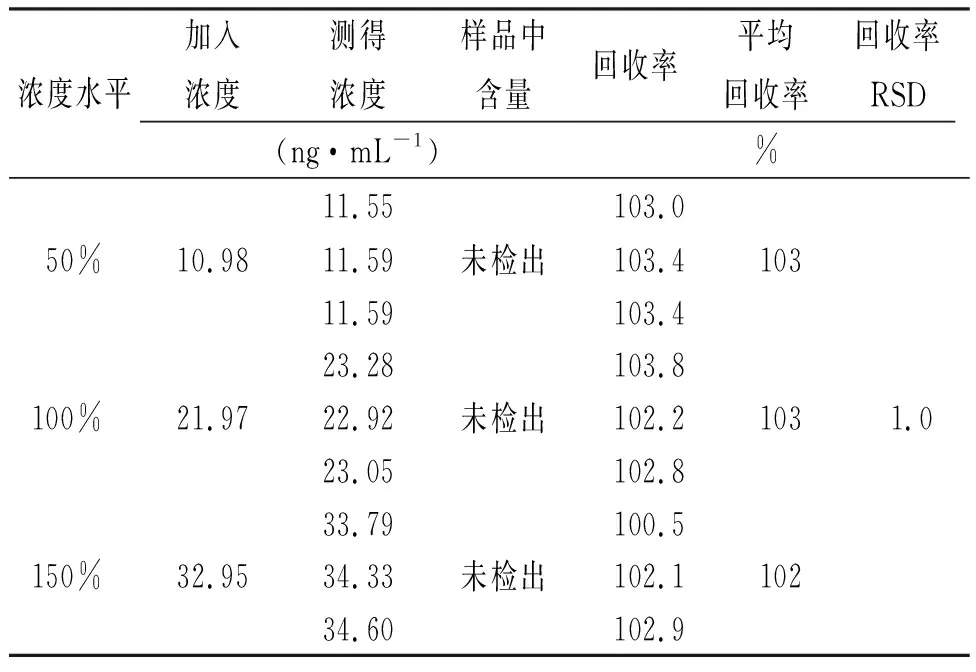
表4 杂质B加样回收率的测定结果 Tab.4 Recovery result of impurity B
结果表明:杂质A加样回收率范围为99.7%~104.3%,RSD为1.5%;杂质B加样回收率范围为100.5%~103.8%,RSD为1.0%。本方法准确度良好。
2.10样品含量测定 取丽珠集团丽珠制药厂不同批号的样品3批(批号:V180901,V180902,V180903),Pfizer SA参比制剂1批(批号:B217802B),按“2.2.2”项下方法制备供试品溶液,依“2.1”项下方法测定,计算出不同样品中杂质A和B的含量。结果上述4批样品中均未检测出杂质A和B。
3 讨论
依据ICH M7和《中华人民共和国药典》2020年版“遗传毒性杂质控制指导原则”[12],结合苯磺酸氨氯地平胶囊的最大日用剂量,使用毒理学关注阈值(TTC)计算出苯磺酸氨氯地平胶囊中两种潜在基因毒性杂质的可接限度为110×10-6。由于基因毒性杂质在极低的浓度水平时也可能导致DNA突变,其测定分析有较强的挑战。待测定的潜在基因毒性杂质从结构上看均含有苯环基团,有一定的紫外吸收强度,但预实验结果表明,HPLC紫外检测器灵敏度无法满足杂质控制的需求,故选用灵敏度高、专属性强的LC-MS/MS方法,对其含量进行测定。
实验中考察了不同类型的色谱柱,结果表明Agilent poroshell 120 EC-C18(4.6 mm×150 mm,2.7 μm)上的分离度和峰型最佳。由于该色谱柱填料粒度较细,为2.7 μm,为避免压力过大,优选流速为0.5 mL·min-1;流动相A和B中均加入0.1%甲酸,用以提高待测定组分在质谱中的离子化效率,改善其峰型。
从两个潜在基因毒性杂质的来源上来看,杂质B为氨氯地平合成过程中的中间体,为非降解杂质,仅有较低的残留风险,建议在原料药质量标准中进行控制;杂质A为氨氯地平的潜在氧化降解杂质,应结合多批次稳定性数据评估风险。
从检测结果来看,国产与原研进口的苯磺酸氨氯地平胶囊均未检出上述潜在基因毒性杂质,质量趋向一致。本研究首次开发LC-MS/MS法对苯磺酸氨氯地平胶囊中的非磺酸酯类潜在基因毒性杂质进行含量测定,所开发的方法也可供苯磺酸氨氯地平原料药及其他剂型参考,为进一步规范强化本类药物的质量提供技术支持。
