高原睡眠障碍发生机制及其防治药物*
2022-12-09王椿清焦文成杜丽娜
王椿清,焦文成,杜丽娜
(1.山东中医药大学药学院,济南 250355;2.军事科学院军事医学研究院辐射医学研究所, 北京 100850)
人类生命约1/3时间是在睡眠中度过的。睡眠有利于体力、脑力恢复,而睡眠障碍则可引起感知功能障碍、日间作业能力减退,导致焦虑症、抑郁症等不良影响[1-2]。高原具有低氧、低温、干燥、强紫外线照射等特殊地理环境和气候因素,尤其是低氧恶劣环境对睡眠产生严重影响[3],具体表现为睡眠节律紊乱、浅睡眠增多、深睡眠减少[4]。
对于急进高原人群而言,睡眠障碍会加剧高原反应,进而影响工作。对长时间生存于中高海拔区域的人群而言,长时间睡眠质量低下可导致感知功能、记忆、学习、警觉能力减退,从而产生精神恍惚,工作效率降低,判断力、指挥、决策等能力下降,自杀等严重后果,甚至还会出现共病风险[5]。目前,除了采用针灸和颅微脉冲等物理方法外,寻找有效的高原睡眠障碍干预措施意义重大。
本文概括了高原睡眠障碍发生机制、预防与治疗药物,希望为建立高原睡眠障碍有效防治措施提供参考。
1 睡眠障碍分类
按照国际分类标准,睡眠障碍可分为失眠、睡眠相关呼吸障碍、嗜睡性中枢性障碍等不同种类。对于高原环境而言,睡眠障碍主要指失眠、生理节律睡眠-觉醒紊乱、异态睡眠(表1)[6]。

表1 睡眠障碍国际分类标准 Tab.1 International classification criteria for sleep disorders
2 高原睡眠障碍发生机制
低氧环境是引起高原睡眠障碍最主要、最直接的因素之一[7]。高原环境氧分压降低,导致肺泡内氧分压和血管内氧分压下降。动、静脉血缺氧,血红蛋白代偿性升高。低氧环境触发外周和中枢化学感受器,促使通气增加肺泡氧分压升高,随后二氧化碳分压(partial pressure of carbon dioxide,PaCO2)下降。CO2是一种强大的呼吸兴奋剂,这会抑制通风呼吸频率降低和呼吸深度减弱,某些情况下还会导致呼吸暂停进而产生睡眠障碍、食欲下降等一系列高原反应[8-9]。
一氧化氮 (nitric oxide,NO) 是一种内源性生物活性物质,在机体睡眠觉醒机制中发挥重要调节作用。当睡眠觉醒过程发生紊乱时,脑内NO水平明显改变[10]。当出现睡眠剥夺时,诱导型一氧化氮合酶(inducible nitric oxides ynthase,iNOS)被激活,引起γ-氨基丁酸增多,抑制中枢神经系统兴奋,进而引起睡眠行为的改变[11]。若敲除iNOS,则会引起睡眠时间缩短;急性低氧时,一氧化氮合酶(nitric oxide synthase,NOS)活性降低,使NO分泌减少,可引发睡眠障碍;低氧习服后,NO水平及NOS活力可明显改善[12]。
大脑神经递质是睡眠的重要影响因素,是睡眠-觉醒的关键调节因子,如抑制性神经递质γ-氨基丁酸支配促睡眠核团,具有促眠作用[13];腹侧被盖区的多巴胺能神经元促进睡眠向觉醒转换,是脑内重要的促觉醒系统[14]。在高原低压低氧条件下,肾上腺素、多巴胺水平明显升高;蓝斑中酪氨酸羟化酶水平显著升高,而侧位被盖和足跖被盖中的胆碱乙酰转移酶和谷氨酸脱羧酶水平显著降低,睡眠稳态被打乱[15-16]。
食欲素(orexin)是一种兴奋性神经肽,其主要功能是调节睡眠-觉醒周期和多种其他关键身体功能的调节,如进食行为、能量平衡、压力反应、奖赏处理、情绪和认知等[17]。当呼吸暂停引起的间歇性缺氧和高碳酸血症时可以激活食欲素神经元导致觉醒和睡眠片段。但长时间间歇性缺氧可能会损伤食欲素神经元,造成食欲素神经元的不可逆损伤[18]。
腺苷也称为腺嘌呤核苷,是人体的一种内源性核苷物质,它不仅是能量代谢的中间产物,还是一种重要的神经调制。在体内可发挥扩张血管,调节脑内能量平衡,减少肾素分泌,降低肺动脉高压和肺血管阻力等作用[19]。腺苷有4种亚型(A1、A2A、A2B和A3),其中A1、A2a具有促眠作用。
脑电图检测发现,慢波睡眠中的慢波活动是睡眠稳态的最佳指标。而慢波活动是由细胞外腺苷的积累和衰变引起的,细胞外腺苷作用于神经元腺苷A1受体,以促进慢波活动,并由胶质细胞中发现的腺苷激酶代谢[20]。
昼夜节律控制睡眠-觉醒周期,昼夜节律由一系列生物钟基因控制,暴露在缺氧条件下可以改变昼夜节律基因表达和相关的生物过程,但具体机制尚不清楚[21]。皮质醇是一种具有昼夜节律的激素,参与血压调节、免疫反应和新陈代谢。睡眠中断会影响下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal axis,HPA)的活动,并增加皮质醇的分泌[22]。褪黑素(melatonin,MT)是松果体分泌的一种时间生物学激素,内源性褪黑素的合成维持着机体的昼夜节律稳定[23],可改善睡眠的开始、持续时间和质量。在体内发挥抗氧化、昼夜节律维持、睡眠调节和神经元存活等作用[24]。但高原低压低氧环境是否会对皮质醇及褪黑素的分泌产生影响,还需进一步验证。
同时心理因素也是重要诱因。进入高原后,人们往往因为对高原的畏惧、紧张和压抑心理而导致睡眠质量降低,继而引发呼吸急促、心跳加速、心慌、头痛等高原反应症状,进一步加重焦虑和失眠[25-26](图1),互为因果,形成恶性循环。
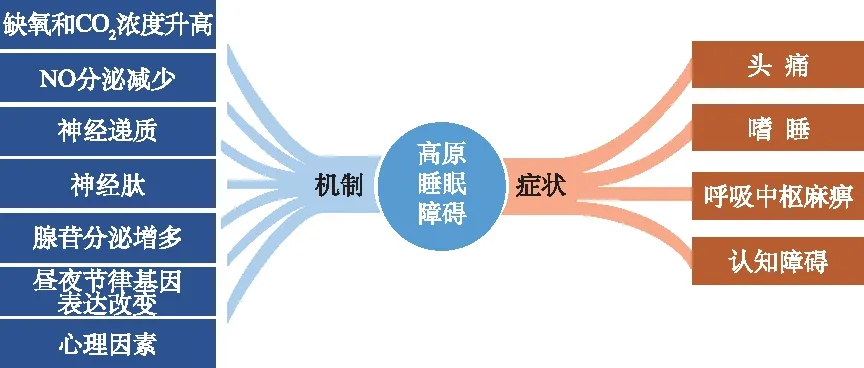
图1 高原睡眠障碍发生机制及主要影响 Fig.1 Mechanism and main effects of altitude sleep disorder
3 高原睡眠障碍的防治药物
3.1预防用药
3.1.1红景天苷 红景天苷具有抗氧化、抗辐射、抗缺氧、免疫调节、抗疲劳等药理作用[27]。红景天苷可明显降低海马DG区神经元凋亡,提高Ras同源分子家族成员A(rashomolog family member A)的蛋白表达,并升高细胞外信号调节激酶(extracellular signal-regulated kinases)、c-Jun氨基末端激酶(c-Jun N-terminal kinases)的磷酸化水平,防治低压低氧脑损伤[28]。红景天苷可进一步通过调节红细胞膜脂质成分,恢复红细胞膜正常功能并促进细胞新陈代谢,改善高原红细胞增多症的相关表现[29]。
3.1.2人参皂苷 人参皂苷具有抗氧化、抗炎等特性,可用于治疗多种神经退行性疾病和代谢性疾病[30],并能缓解学习记忆障碍、逆转应激和衰老引起的病理和生理变化[31]。
高原环境下,大脑首先发生炎症反应,继而损伤脑神经细胞,并过度释放兴奋性神经递质、产生自由基、减少蛋白质合成、导致基因异常表达、激活免疫反应等[32]。缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1α)是缺氧重要标志,只在缺氧状态下稳定表达。人参皂苷通过抑制HIF-1α而发挥抗缺氧保护作用,具有保护脑皮层神经元超微结构免受缺氧损伤的潜在作用。肺纤维化导致机体广泛缺氧,人参皂苷Rg3通过抑制HIF-1α核定位减缓肺纤维化进程[33]。人参皂苷Re定位于HIF-1a和Von Hippel-Lindau(VHL)蛋白之间的结合界面,能阻止VHL与HIF-1a结合,从而抑制HIF-1a泛素化,防治心肌细胞缺氧复氧损伤[34]。
3.1.3葛根素 葛根素是中药葛根中提取的异黄酮化合物,具有扩张血管、抗氧化、抗肿瘤、抗炎等作用[35],能潜在性地预防高原缺氧睡眠障碍。
缺氧环境严重损害脑神经,刺激细胞中microRNA-214(miR-214)大量增加而导致细胞缺氧性损伤[36]。葛根素能改善神经干细胞缺氧引起的损伤,其机制可能与miR-214有关[37-38]。缺氧还可引发炎性反应,葛根素通过抑制TNF-α释放和NF-κB、丝裂原活化蛋白激酶(mitogen-activated protein kinases)途径的磷酸化而防止水通道蛋白4升高,发挥预防缺氧损伤作用。因此,葛根素可用于急性高原病(acute mountain sickness,AMS)和高原红细胞增多症[39]。
3.1.4丹参酮ⅡA 丹参酮ⅡA是丹参中主要脂溶性有效成分,具有抗氧化、抑制血小板聚集、扩血管、抗感染、抗肿瘤等多种作用[40]。丹参酮ⅡA降低血浆中氧化低密度脂蛋白浓度,减少血管中超氧阴离子和丙二醛的产生,对动脉粥样硬化鼠模型具有较好疗效。且丹参酮ⅡA抑制氧化低密度脂蛋白的产生不依赖于血浆中脂类、钙离子和活性维生素D 的浓度[41]。丹参酮ⅡA对高原睡眠障碍的预防作用可能主要依赖于扩张血管和抗氧化。
3.1.5乙酰唑胺 乙酰唑胺作为碳酸酐酶抑制剂,通过提高副交感神经兴奋作用加快机体适应高原环境,可防治轻度AMS[42]。它通过抑制肾碳酸酐酶促进肾中碳酸氢盐释放,从而提高超临界CO2滞留量,有效对抗因通气增加所致的低碳酸血症,进而维持通气平衡,提高睡眠质量[43]。
3.2治疗药物
3.2.1硝苯地平 硝苯地平作为钙离子拮抗剂,通过竞争性与心肌细胞、平滑肌细胞表面钙离子通道受体结合,阻止钙离子进入心肌细胞及血管平滑肌细胞,阻断心肌细胞兴奋,扩张外周血管,通过抑制压力负荷和容量负荷起到双重降压效果[44],通过下调核因子κB(NF-κB)减轻炎症进展,治疗高原肺水肿[45]。其用于高原睡眠障碍可能主要基于其扩张血管提高供氧量。
3.2.2苯二氮类镇静催眠药 苯二氮类药物可通过减少觉醒次数降低周期性呼吸。睡眠期间呼吸暂停可能伴随着严重缺氧;缺氧和呼吸暂停引发的睡眠障碍相互影响,进一步加剧临床症状。但大多数苯二氮类药物仅适用于低海拔地区失眠症,但只有替马西泮适用于高原睡眠障碍[46](图2)。替马西泮能减少高海拔地区睡眠期间的周期性呼吸,对次日清醒或认知没有负面影响[47]。
3.2.3非苯二氮类镇静催眠药 非苯二氮类药物比苯二氮类和碳酸酐酶抑制剂更适用于治疗高原睡眠障碍,如唑吡坦和扎来普隆[48-49]。二者能改变睡眠结构,延长睡眠总时间,缩短入睡时间,减少唤醒次数,提高主观和客观睡眠质量,且不加重缺氧,不影响通气,对夜间呼吸参数无影响[50](图2)。
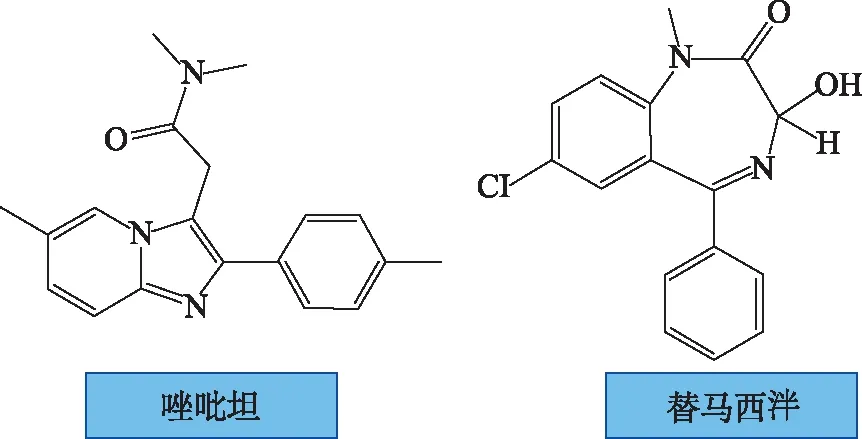
图2 主要镇静催眠药化学结构 Fig.2 The chemical structure of the main sedative hypnotic
3.2.4褪黑素 褪黑素是公认的镇静催眠药物。缺氧情况下,海马神经元中一氧化氮合酶、硝基酪氨酸和Caspase 3增加,给予褪黑素后,上述蛋白的表达明显受到抑制。因此,给予褪黑素可以有效预防和(或)治疗睡眠障碍[51]。
3.3辅助治疗药物
3.3.1地塞米松 地塞米松作为一种高效的合成糖皮质激素,具有很强的抗炎作用,是一个高效AMS防治用药。地塞米松可用于治疗高原肺水肿[52],能改善高原肺水肿患者的肺部炎症和缺氧状态下离子转运功能[53]。对无法承受或有乙酰唑胺使用禁忌的人群,地塞米松可作为乙酰唑胺替代品。乙酰唑胺和地塞米松联用能更有效防治AMS和高原急性脑水肿。
3.3.2纳洛酮 纳洛酮可抑制内源性β-内啡呔合成,加快外周循环血中β-内啡呔分解,从而降低颅内β-内啡呔含量,减轻肺动脉压对中枢神经系统的影响[54]。纳洛酮能拮抗大量内源性阿片肽释放导致的效应,如改善微循环、稳定细胞膜、抑制花生四稀酸代谢、阻止脂质过氧化、提高 Na+-K+-ATP酶活性等。此外,纳洛酮通过保护组织细胞溶酶体膜的稳定性、抑制炎症反应、减少氧自由基释放而减轻高原脑水肿的严重程度,促进脑细胞正常功能恢复[55]。
此外,丁苯酞软胶囊缩短高原睡眠障碍患者的睡眠潜伏期,睡眠中平均血氧饱和度(SaO2)、觉醒时平均SaO2提高睡眠质量[56]。高原环境容易导致认知功能受损,丁苯酞提高线粒体自噬并降低Bax、Caspase-3等凋亡蛋白表达,提高机体抗氧化物酶的活性,改善低氧造成的认知[57-58]。
中药消痰解郁方可降低睡眠障碍患者的匹兹堡睡眠质量指数总分、提高睡眠质量、缩短入睡时间、延长睡眠时间,改善急进高原人群睡眠质量[59]。
3.4高原睡眠障碍常用给药方式 口服给药是防治高原睡眠障碍的最常用给药方式,如乙酰唑胺片、硝苯地平缓释片、硝苯地平控释片等。但不适用于口服生物利用度低、起效慢的药物,通过改变给药途径解决上述问题。如将纳洛酮制成鼻喷雾剂经鼻腔给药,增加其生物利用度,实现快速地全身吸收[60];将唑吡坦制成唑吡坦舌下制剂,提高了唑吡坦的睡眠诱导作用,且在睡眠维持或副作用方面与口服制剂没有区别[61]。也可通过新剂型实现快速、有效给药。如:制成鼻用原位凝胶,药物可通过嗅神经和三叉神经绕过血脑屏障直接进入脑内,实现鼻腔脑靶向;微针经皮给药后,所载药物可通过脑脊液进入脑内,通过扩张脑部血管等机制改善缺氧性睡眠障碍。纳米粒、脂质体等剂型通过注射、黏膜等给药方式,也可实现增加溶解度、增加药物生物利用度的目的。
4 结束语
高原缺氧是引发高原睡眠障碍的主要诱因,表现为失眠、睡眠-觉醒周期紊乱等,正引起广泛关注。今后研究可重点聚焦于以下方面:①充分利用我国中医药宝库,积极挖掘中医药资源,尤其是药食两用的食品,从复方、单味药、有效部位、有效成分、单体等多层次进行研究;②针对目前高原睡眠障碍防治用药多为口服固体制剂的现状,积极拓展给药途径,研发新剂型,从口服拓展到鼻腔、经皮、肺部给药等多种途径,从单一片剂过渡到纳米递送系统、微针、凝胶、液晶等新剂型,以适应不同场景、不同环境下应用。希望未来有更多安全、有效的药物制剂可用于防治高原睡眠障碍。
