BRAFV600E与分化型甲状腺癌术后131I治疗效果的相关性研究*
2022-11-30李长越杨佳宁包明聪修先阳吴晓杰赵志刚何桂元
彭 亮,李长越,杨佳宁,包明聪,廉 英,修先阳,吴晓杰,孟 丹,赵志刚,魏 晗,何桂元△
(1.联勤保障部队第967医院核医学科,辽宁大连 116000;2.大连市妇女儿童医疗中心生殖与遗传医学中心,辽宁大连 116000)
分化型甲状腺癌(differentiated thyroid carcinoma,DTC)是内分泌系统常见的肿瘤,从全球数据来看,DTC的发病率逐渐增高,但其总体死亡率较低,近30年来年龄标化死亡率(age-standardized mortality rate,ASMR)和伤残调整生命年(disability-adjusted life-years ,DALYs)都呈下降趋势,甲状腺癌相关死亡主要发生在65~79岁年龄[1]。数据显示我国2015年甲状腺癌的总体死亡率为0.48/10万,5年生存率为84.3%,与发达国家如美国(98.7%)仍存在较大的差距[2]。早期诊断、合理有效的治疗方案及对DTC预后的评估至关重要。细针抽吸(fine needle asprition,FNA)细胞学检查结合分子标志物的检测已用于DTC的术前诊断。乳头状甲状腺癌(papillary thyroid carcinoma,PTC)是其最常见的病理类型,PTC肿瘤基因图谱(the cancer genome atlas,TCGA)提示PTC中基因突变负荷较低,基因组相对静止,是PTC惰性生物学行为,预后较好的主要原因[3]。鼠类肉瘤滤过性毒菌致癌同源体基因BRAFV600E为PTC最常见基因突变,2015年美国甲状腺协会将BRAFV600E基因突变与肿瘤大小、腺外侵犯等特征相结合纳入术后复发风险评估体系[4]。2021年最新的放射性131碘(131I)治疗DTC指南(2021版)[5]中也提出BRAF基因突变诊断PTC具有很高的阳性预测值和特异性,并将其纳入复发风险度分层评估指标。研究显示BRAFV600E关联的PTC具有侵袭性临床病理特征,包括淋巴结转移、甲状腺外浸润、放射性碘亲和力丧失和疾病复发[6]。PTC主要治疗手段包括外科手术治疗、131I治疗、分子靶向治疗、放疗、甲状腺素抑制治疗等,其中131I治疗是PTC术后进一步治疗的可靠方案。关于BRAFV600E突变是否会影响131I治疗的有效率目前尚无一致共识,需要更多的临床资料以提供判断依据。本研究回顾性收集PTC患者的BRAFV600E的检测结果及术后131I治疗随访资料,分析BRAFV600E与131I治疗效果的相关性。
1 材料与方法
1.1 一般资料
回顾性分析2016年1月至2020年6月就诊于联勤保障部队第967医院行131I治疗的PTC患者,所有患者已行双侧甲状腺叶切除术+双侧颈淋巴结清除术。患者纳入标准:病理类型为PTC;复发风险度分层评估为中、高风险;FNA或者术后组织行BRAF基因检测[实时荧光定量PCR(qRT-PCR)法]。排除标准:随访资料不全或失访。所有患者接受131I治疗前根据《131I治疗分化型甲状腺癌指南》[7]进行TMN分期和复发风险度分层。根据BRAF检测结果将患者分成BARF突变组和BARF野生型组,收集患者的一般资料和临床资料。
1.2 131I治疗
治疗前1个月开始低碘准备,使血清促甲状腺激素(thyroid stimulating hormone,TSH)>30 mU/L。完善治疗前常规检查和签署书面知情同意书后开始131I治疗,口服剂量为5.55 GBq(成都欣科医药有限公司),治疗1周左右后行全身显像(whole body scan,WBS),以明确有无转移灶。在治疗后3个月对患者情况进行评估,检测血清甲状腺球蛋白(thyroglobulin,Tg)及甲状腺球蛋白抗体(hyroglobulin antibody,TgAb)水平,颈部彩超。治疗后3个月随诊,如仍有残留功能性甲状腺组织,并影响Tg/TgAb的监测及疗效的判断,则进行再次治疗。131I治疗6个月左右行疗效评估,包括血清学指标及超声评估,评价结论包括:疗效满意(excellent response,ER)、疗效不确切(indeterminate response,IDR)、生化疗效不佳(biochemical incomplete response,BIR)、结构性疗效不佳 (structural incomplete response,SIR);如果判定为SIR则考虑再次131I治疗;ER、IDR、BIR按照共识定期随访,无复发及远处转移视为治愈。
1.3 检测指标
纳入患者的性别、年龄、BMI、BRAFV600E基因型、肿瘤最大径、包膜侵犯、临床分期、复发风险度分层、131I治疗次数、治疗效果评估、不良反应、复发转移情况。
1.4 统计学处理
2 结 果
2.1 患者一般情况及临床特征
符合纳入标准患者115例,其中男35例,女80例,年龄16~72岁,所有患者的临床分期位于T1~4N1M0范围。BRAF野生型组共31例(26.96%),BRAF突变组共84例(73.04%);随访12~52个月。2组患者年龄、性别比及BMI差异无统计学意义(P<0.05);2组患者肿瘤最大径及包膜侵犯差异无统计学意义(P<0.05),复发风险度分层包括中风险及高风险,2组患者各层患者比例差异无统计学意义(P<0.05)。
2.2 131I治疗效果
BRAFV600E突变组和BRAF野生型组各有52例(61.90%)和20例(64.52%)首次131I治疗经评估达到ER并在随访期内无肿瘤复发;再次进行131I治疗的患者中,2组各有21例和7例治疗后达到ER,在随访期内未发现肿瘤复发征象。2组间首次131I治疗ER率、2次131I治疗累积ER率比较差异无统计学意义(P>0.05)。余下病例经历3~5次131I治疗,其中10例在随访期提示肿瘤复发,二次手术后再次行131I治疗,5例发生远处转移,在随访期结束时,共有3例(BRAFV600E突变组2例,BRAF野生型组1例)远处转移患者未能达到ER,2组患者131I治疗累积ER率差异无统计学意义(P>0.05)。见表1。
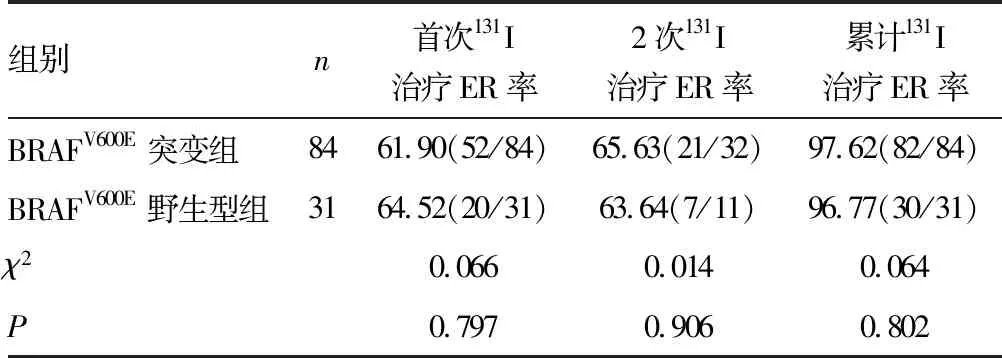
表1 2组患者131I治疗效果评价
为评估影响首次131I治疗效果(是否达到ER)的危险因素,多因素logistic回归结果显示BRAFV600E基因型不影响首次131I治疗效果,但更大的肿瘤最大径和高危复发风险分层不利于PTC患者的首次131I治疗后达到ER(P<0.05),见表2。根据随访结束时患者经历1次或者多次131I治疗后是否达到ER绘制Kaplan-Meier曲线,BRAFV600E组和BRAF野生型组患者达到ER的生存分析差异无统计学意义(P>0.05),见图1。
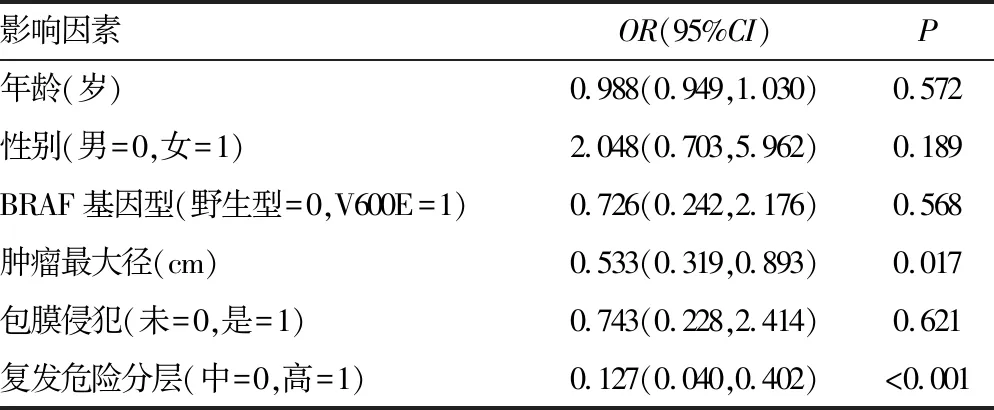
表2 首次131I治疗获得ER的多因素logistic回归分析
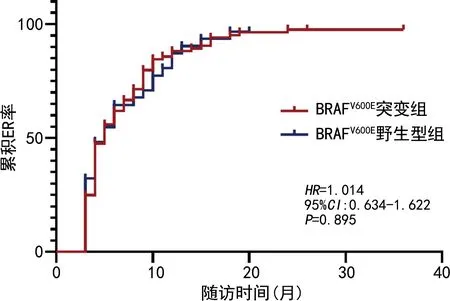
图1 2组患者Kaplan-Meier曲线
3 讨 论
随着大规模基因组学及转录组学的开展,甲状腺癌的发病机制逐渐被揭示,目前发现多种致癌驱动因素与PTC的发生发展及预后相关。PTC的主要遗传学病因为体细胞丝裂原激活蛋白激酶(MAPK)通路的过度激活[8],包括BRAF和RAS基因突变产生功能获得性改变(gain-of-function,GOF),以及蛋白激酶基因参与的基因融合如RET、NTRK1、NTRK3及BRAF等。1项来自中国人群的研究显示,88.7%的PTC具有至少1种候选致癌驱动基因改变[9];其中约72.4%的病例携带BRAF突变,2.8%的病例具有RAS突变,13.8%的病例具有框内基因融合的特征;同时基因改变和临床病理特征的综合分析表明,在年轻、癌灶较大和伴随淋巴结转移的PTC患者中激酶基因融合的检出率显著升高。甲状腺癌的发生发展伴随着多种分子遗传学改变,对甲状腺癌的深入了解可以为具有此类驱动基因的患者提供个体化诊断、治疗和预后评估的精准医疗。
BRAF最早在2003年被提出可用于PTC诊断[10],通过FNA和BRAF突变的联合应用,使得甲状腺结节的良恶性诊断具有更高的灵敏度和特异度,但BRAF同样对PTC的预后具有较好的预测价值。BRAF基因突变可导致MAPK信号通路过度活化[11],磷酸化激活X连锁凋亡抑制蛋白,从而抑制肿瘤细胞凋亡;通过其下游的ETS转录因子与端粒酶反转录酶(telomerase reverse transcriptase,TERT)启动子突变位点结合,上调TERT基因的表达,参与甲状腺癌的发生发展。1项纳入32项研究6 372例PTC患者的meta分析发现[12],BRAF基因突变与PTC临床分期、淋巴结转移、原发肿瘤大小、甲状腺外侵犯、肿瘤多灶、患者性别、高细胞型PTC、经典PTC、包膜侵犯相关。LIU等[13]发表的纳入63项研究共20 764 例患者的meta分析显示,与野生型 BRAF患者比较,BRAFV600E突变与侵袭性临床病理因素相关,包括甲状腺外浸润、较高的 TNM 分期、淋巴结转移和复发,并与较低的总生存率相关。近期的1项全球多中心回顾性研究[14],分析了2 638例PTC患者(男623 例、女2 015 例 )后发现在BRAFV600E突变型患者淋巴结转移与无淋巴结转移患者的死亡率分别为7/515(1.4%)和28/363(7.7%),2组比较差异有统计学意义(P<0.001);而在BRAF野生型患者组,淋巴结转移与无淋巴结转移患者的死亡率分别为2/659(0.3%)和4/321(1.2%),2组比较差异无统计学意义(P=0.094),提示淋巴结转移相关的死亡风险与BRAF 状态密切相关。在本研究共纳入115例患者,2组患者的年龄、BMI及性别比差异无统计学意义(P>0.05);BRAF突变组与野生型组相比肿瘤最大径、包膜侵犯及复发风险分层方面差异也无统计学意义(P>0.05),可能跟样本量较少及仅以接受131I治疗的人群为研究对象造成的偏倚有关。
BRAF突变已被报道可能导致钠/碘转运体(sodium/iodide symporter,NIS)抑制,并且推测可能为131I难治性DTC(radioiodine refractory-differentiated thyroid cancer,RAIR-DTC)的发生机制[15]。在野生型BRAF患者中,NIS主要定位于甲状腺滤泡膜上,BRAF突变导致的MAPK通路过度激活可能导致NIS表达下调,并影响NIS的细胞膜定位,进而影响131I代谢过程[16]。BARF突变同时也与甲状腺癌131I抵抗相关,可能机制为下调131I代谢相关基因表达,如甲状腺激素受体 (TSHR)、NIS、甲状腺球蛋白 (Tg)、甲状腺过氧化物酶 (TPO) 等[17]。在体外研究中,诱导BRAF基因突变能够下调TSHR、NIS、Tg、TPO等基因的表达,而抑制BRAF突变则可以恢复这些基因的表达[18]。但也有不支持这一推论的证据,ANEKPURITANANG等[19]分析RAIR-DTC和131I亲和性患者的癌灶组织发现,2组患者BRAFV600E突变发生比例差异无统计学意义(86.7%vs. 73.3%,P=0.3)。宋娟娟等[20]也认为,同对照组比较,对于治疗前刺激性Tg(preablative stimulated Tg,ps-Tg)水平较高、肿瘤较大、淋巴结分期较晚的BRAFV600E突变的PTC患者,131I辅助治疗(3.7~5.5 GBq)仍旧可以起到改善预后的作用。在本项研究中,BRAF突变和野生型患者,复发风险度分层相似,经过131I治疗可以获得相似的ER率,笔者认为无论BRAF基因突变状况,131I治疗都是改善PTC患者预后的有效手段。
PTC的发生发展是多个基因突变效应积累、表观遗传学改变及环境因素的综合作用,故以单个基因的突变来判断疾病的预后具有一定的局限性,目前已经有较多的分子检测组合用于PTC的诊断、治疗及预后评估。基因突变共存可能导致产生协同作用,共存的BRAFV600E+TERT基因共突变可预测不良的组织病理学预后,包括疾病进展、侵袭和转移。本项研究纳入的病例数较少且只涉及BRAF单个点突变对131I治疗的效果评估,具有一定的局限性,对于131I治疗效果及PTC预后判断还需要更多的临床和基础研究来寻找可靠的预测因素。
