自组装短肽Sciobio-Ⅱ通过Notch信号通路保护ox-LDL诱导的脐静脉内皮细胞凋亡*
2022-11-30龚心琰朱凌波郑娟庆龚剑萍
龚心琰,朱凌波,郑娟庆,龚剑萍
(浙江省义乌市中心医院心内一科 322000)
心脑血管疾病是目前中老年群体的常见病及多发病,多基于动脉粥样硬化(atherosclerosis,AS)发生,机制较为复杂[1]。在AS形成的过程中,氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)可以损伤血管内皮细胞,使脂质及炎性细胞等在损伤区浸润,形成粥样斑块[2-3]。因此,目前研究认为减轻ox-LDL 引起的血管内皮细胞损伤是干预AS的有效靶点之一[4]。本研究选用的自组装短肽(self-assembling peptide,SAP)Sciobio-Ⅱ,是由16个氨基酸残基构成的一种可以仿细胞外基质(extracellular ma-trix,ECM)功能的生物支架纳米材料,能够模仿ECM与细胞因子、生长因子之间的相互作用,进一步影响细胞的增殖与分化[5]。目前,Sciobio-Ⅱ对ox-LDL诱导的血管内皮细胞损伤是否具有保护作用,以及其可能的相互作用机制未见相关文献报道。因此,本研究采用脐静脉内皮细胞( human umbilical vein endothelial cells,HUVEC) 作为实验对象,通过体外实验,验证和探究Sciobio-Ⅱ 对ox-LDL 诱导HUVEC损伤的实验效应及其相关分子机制。
1 材料与方法
1.1 主要试剂与材料
自组装短肽Sciobio-Ⅱ(序列:RLEVKADARLEVKADA-NH2)由成都赛恩贝生物科技有限公司赠送;ox-LDL(Cat号:20605ES05)、TUNEL细胞凋亡检测试剂盒(Alexa Fluor 640,Cat号:40308ES20)、Annexin V/碘化丙啶(PI)细胞凋亡检测试剂盒(Cat号:40305ES20)、鼠抗二抗抗体(批号:33201ES60)均购自上海翊圣生物科技有限公司;细胞活力检测试剂盒(cell counting kit-8,CCK-8)购自上海碧云天生物技术有限公司(Cat号:C0043);HUVEC购自中国科学院典型培养物保藏委员会细胞库;血管内皮生长因子(vascular endothelial growth factor,VEGF)/Notch 信号通路抑制剂 LY450139(Cat号:425386-60-3)购自美国MCE 公司。PBS(Cat号: SH30256.01)购自美国HyClone公司;DMEM高糖培养基(REF:12430047)购自美国Gibco 公司;RNA提取试剂(Cat号:79306)购自上海凯杰公司;血管内皮生长因子受体 2 (vascular endothelial growth factor receptor 2,VEGFR-2,批号:ab237634)、Notch1(批号:ab52627)、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2,批号:ab32124)、Bax(批号:ab32503)一抗抗体购自英国 Abcam公司;β-肌动蛋白(β-actin)一抗抗体(批 号:A5441)购自美国 Sigma 公司;Bax、Bcl-2、VEGF-2、Notch1引物由上海生工生物公司合成,引物序列见表 1;qPCR(SYBR®Premix Ex TaqTMⅡ)试剂盒(Cat号:RR820A)、PrimeScriptTM反转录试剂盒(Cat号:RR047A)购自日本TaKaRa公司;PCR扩增仪(型号Life ECO)购自杭州博日公司;荧光定量PCR仪(型号ABI7500)购自美国ABI公司;Western blot电泳系统购自美国 Bio-Rad 公司;凝胶成像系统(型号:e-Blot 100)购自德国易勃特生物科技有限公司。见表1。

表1 各基因引物序列
1.2 方法
1.2.1细胞培养及分组
HUVEC用含有10% 胎牛血清的DMEM高糖培养基贴壁培养(CO2浓度为5%),待细胞融合度为90%时(细胞计数约为2×107个),移除培养基,传代后继续培养扩增,得到足够数量的细胞后(本实验传至第3代)接种在不同规格的培养板内并进行相应的分组处理。设置不同浓度(0、10、20、50、100、150、200、250、300 mg/L)的Sciobio-Ⅱ,分组处理细胞,筛选出最佳浓度进一步行后续实验,经预实验结果显示,Sciobio-Ⅱ浓度为150 mg/L时各组表型均较为显著。再根据给予含不同试剂的DMEM 完全培养基将细胞分5组:control组(PBS)、ox-LDL组(200 mg/L ox-LDL)、Sciobio-Ⅱ组(150 mg/L Sciobio-Ⅱ)、ALL组(200 mg/L ox-LDL+150 mg/L Sciobio-Ⅱ)、LY组(200 mg/L ox-LDL+150 mg/L Sciobio-Ⅱ+25 μmol/L VEGF/Notch信号通路抑制剂 LY450139)。
1.2.2刚果红染色
用PBS配制150 mg/L Sciobio-Ⅱ溶液,在25 ℃适宜条件下自组装24 h,分别于0、8、12、24 h时取5~10 μL前述溶液,滴于载玻片上,用配好的刚果红染液染色30 s,置于光镜下观察,分别拍照留存。
1.2.3细胞增殖能力的检测
HUVEC接种在96 孔培养板内(最外侧36个孔加入空白培养基),每孔约3 000个细胞,每组6孔,8 h后镜下观察细胞贴壁情况,确认贴壁良好后,加入ox-LDL、Sciobio-Ⅱ等试剂,分别在0、24、48、72 h时加入CCK-8试剂盒的检测液,10微升/孔,按照CCK-8试剂盒说明书操作,继续培养4 h,使用多功能酶标仪于450 nm波长测定吸光度(A450)值,绘制曲线图。
1.2.4细胞凋亡的检测
1.2.4.1末端DNA转移酶dUTP缺口末端标记(TUNEL)法检测
HUVEC培养后接种在24孔培养板上,每孔3×104个细胞,8 h后镜下确认细胞贴壁,加入ox-LDL、Sciobio-Ⅱ、LY450139等试剂,处理48 h后,弃去细胞培养基并用PBS洗涤2次,加入TUNEL 试剂盒中的固定液(4%多聚甲醛),固定20 min,加入PI,每孔50 μL,置于CO2培养箱中避光孵育60 min,PBS洗涤3次后封片,使用共聚焦荧光显微镜进行观察(激发波长为550 nm,发射波长为570 nm),分别拍照留存,计算凋亡率。
1.2.4.2Annexin V/PI双染法检测
HUVEC培养后接种在6孔培养板上,每孔4×105个细胞,8 h后镜下确认细胞贴壁良好,加入ox-LDL、Sciobio-Ⅱ、LY450139等试剂,干预48 h后,移除细胞培养基,PBS洗涤2次,加入250 μL 0.25%无乙二胺四乙酸(EDTA)的胰酶消化细胞(37 ℃ 5% CO2培养箱孵育3 min),离心(1 000×g,5 min)后弃上清液,加入195 μL Annexin V/PI结合液,轻轻重悬细胞,再加入5 μL Annexin V/PI结合液和10 μL PI,混合均匀,在室温下避光孵育15 min,使用流式细胞仪进行检测(Annexin V-FITC为绿色荧光,PI为红色荧光),分析数据,计算凋亡率。
1.2.5蛋白免疫印迹(Western blot)试验
HUVEC接种、贴壁且融合度为 60%后,加入ox-LDL、Sciobio-Ⅱ、LY450139等试剂处理 48 h;加入 250 mL 含 1 mmol/L 苯甲基磺酰氟的蛋白裂解液,使用 BCA 试剂盒进行蛋白定量[稀释 10 倍,使用酶标仪测定562 nm处吸光度(A562 nm)值];采用 70~120 V 的恒压进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),待目的条带电泳至分离胶中间。300 mA 恒电流进行聚偏氟乙烯(PVDF)膜转印,转印结束后做好标记;加入Bcl-2、Bax、VEGFR-2、Notch1、β-actin一抗4 ℃孵育过夜;次日回收一抗,加入各自对应的二抗;回收二抗,洗膜后每张膜加入配好的化学发光液,在凝胶成像仪中曝光得到蛋白条带(压片式)。使用 Image-J 软件扫描各条带灰度值,根据灰度值计算蛋白表达水平。
1.2.6实时荧光定量PCR(qRT-PCR)
HUVEC培养后接种在6 孔培养板,每孔4×105个细胞,8 h镜下确认细胞贴壁后,加入ox-LDL、Sciobio-Ⅱ、LY450139等试剂处理48 h,PBS洗涤2遍,提取总RNA(具体按试剂盒说明操作),琼脂糖电泳检测RNA完整性,并确认各标本RNA合格后,取1 μg总RNA进行反转录PCR,制备cDNA,再进行RT-qPCR检测(SYBR法),检测基因包括Bcl-2、Bax、VEGFR-2、Notch1,以 β-actin 为内参,使用2-ΔΔct法计算各基因的表达水平。
1.3 统计学处理
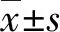
2 结 果
2.1 自组装短肽形成结果
刚果红染色结果观察到Sciobio-Ⅱ动态的宏观自组装过程,开始自组装2 h时,镜下可见短肽形成多层疏松薄膜(图1A);自组装 4 h后,层片状的薄膜形成片状松散状(图1B);自组装12 h 后,片状薄膜的厚度较前增加,同时薄膜之间开始相互连接(图1C);自组装24 h 后,较为致密的单层膜状结构已经形成(图1D)。
2.2 细胞增殖情况的比较
与control组比较,ox-LDL 组的A450值明显下降(P<0.05);与ox-LDL组比较,Sciobio-Ⅱ组、ALL组的A450值升高,Sciobio-Ⅱ组明显高于ALL组(P<0.05)。见图2。
A:疏松薄膜(自组装2 h);B:片状松散薄膜(自组装4 h);C:薄膜相互连接(自组装12 h);D:单层膜(自组装24 h)。
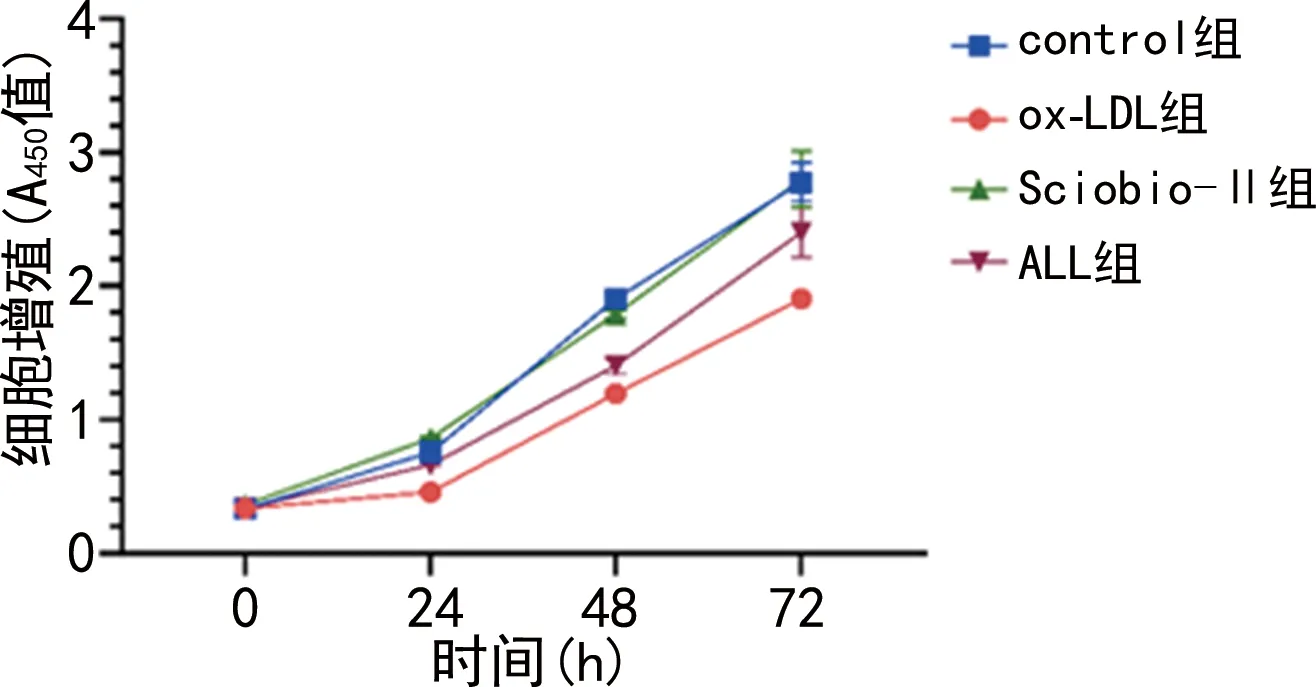
图2 各实验组细胞增殖情况
2.3 细胞凋亡率的比较
TUNEL法与Annexin V/PI双染法均发现,与control组比较,ox-LDL组的细胞凋亡率明显增加(P<0.05);与ox-LDL组比较,Sciobio-Ⅱ组和ALL组的细胞凋亡率明显下降(P<0.05),Sciobio-Ⅱ组明显低于ALL组(P<0.05)。见图3。
2.4 各组Bcl-2、VEGFR-2、Bax、Notch1基因水平的表达
与control组比较,ox-LDL组细胞中Bax、Notch1的基因表达水平升高,Bcl-2、VEGFR-2的基因表达水平降低(P<0.05);与ox-LDL组比较,ALL组细胞中Bax、Notch1的基因表达水平降低,Bcl-2、VEGFR-2的基因表达水平升高(P<0.05);与ALL组比较,LY组Bax、Notch1的基因表达水平升高,Bcl-2、VEGFR-2的基因表达水平降低(P<0.05)。见图4。
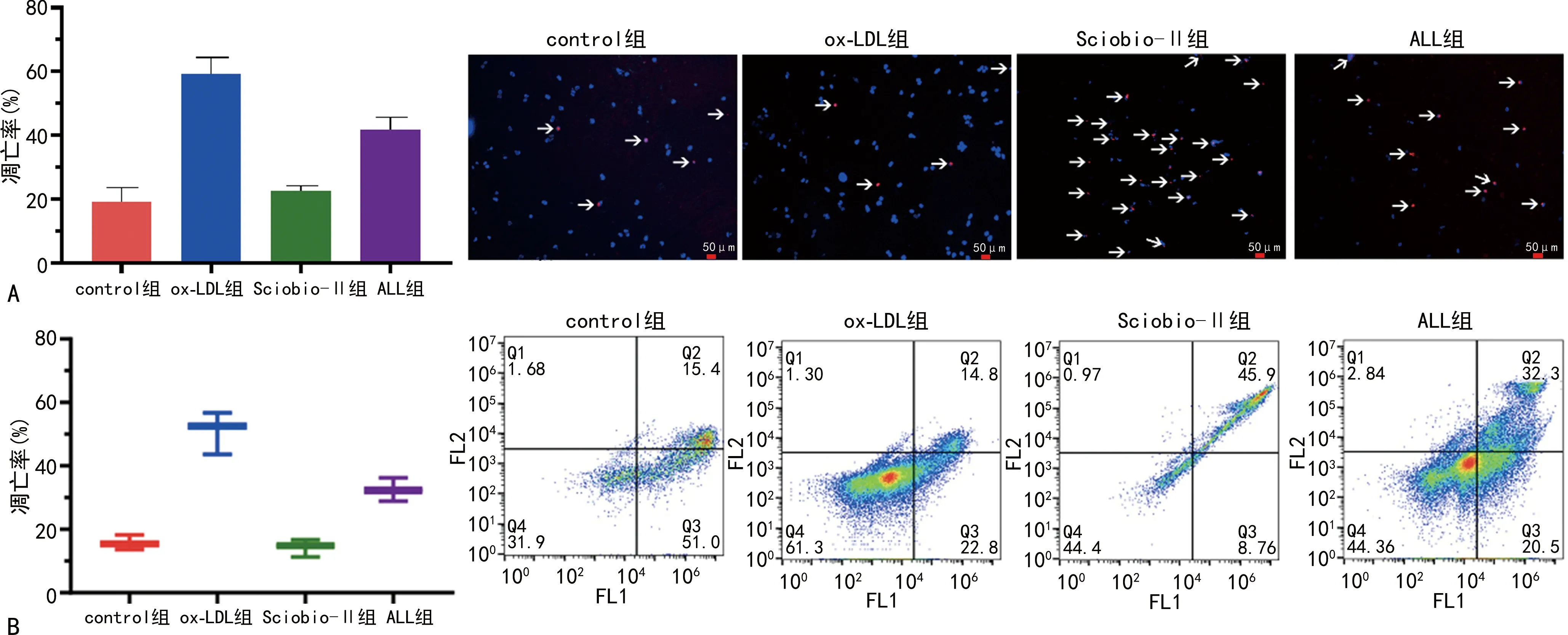
A:TUNEL实验及定量分析(箭头所示为凋亡细胞);B:Annexin V/PI双染流式细胞实验及定量分析。
2.5 各组Bcl-2、VEGFR-2、Bax、Notch1蛋白表达水平的比较
与control组比较,ox-LDL组细胞中Bax、Notch1的蛋白表达水平升高,Bcl-2、VEGFR-2的蛋白表达水平降低(P<0.05);与ox-LDL组比较,ALL组细胞Bax、Notch1的蛋白表达水平降低,Bcl-2、VEGFR-2的蛋白表达水平升高(P<0.05);与ALL组比较,LY组Bax、Notch1的蛋白表达水平升高,Bcl-2、VEGFR-2的蛋白表达水平降低(P<0.05)。见图5。
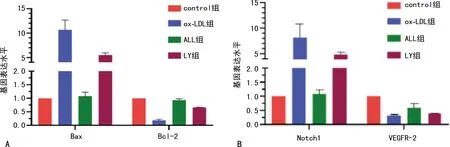
A:Bax、Bcl-2;B:Notch1、VEGFR-2。
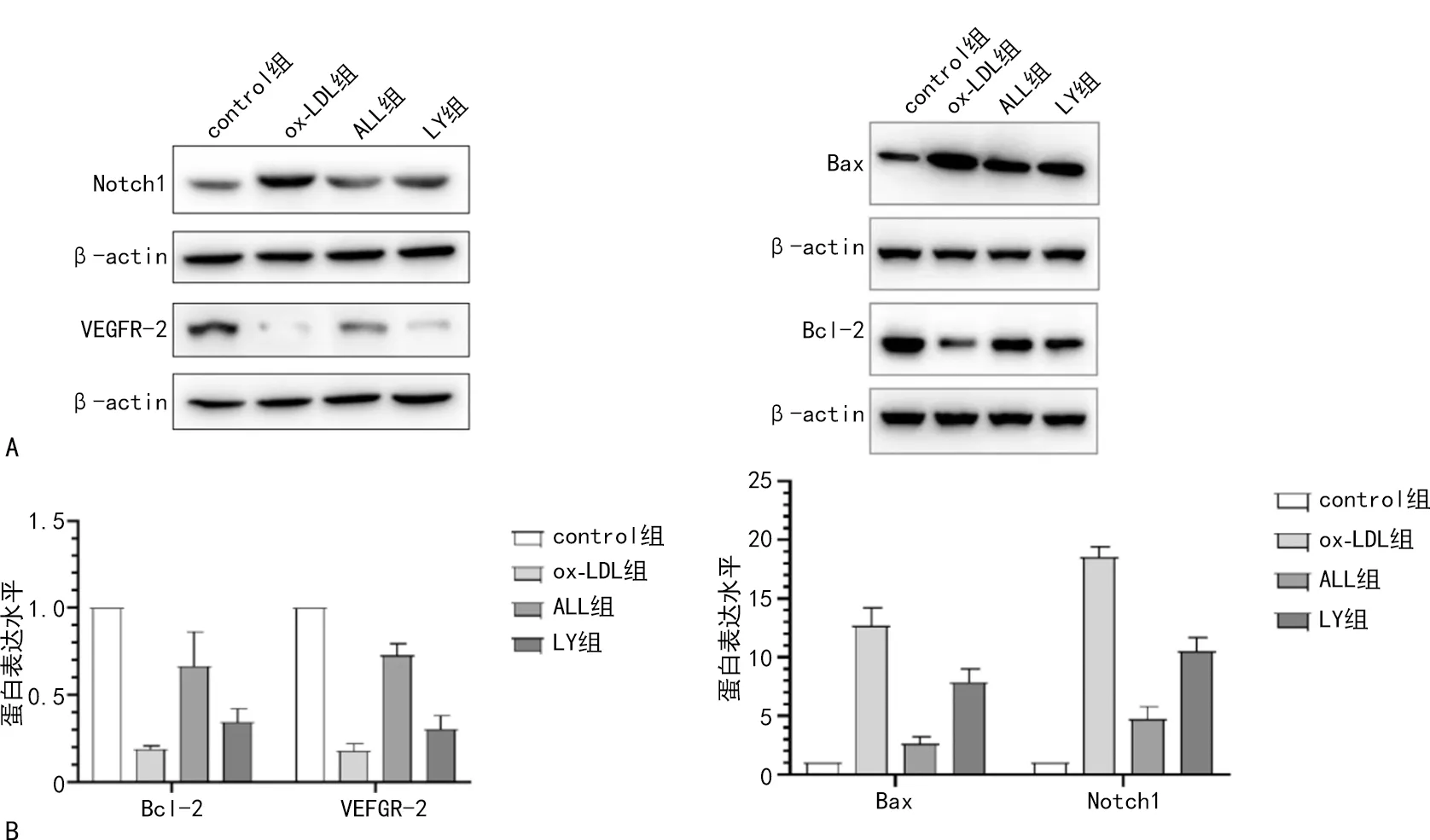
A:Western blot;B:Western blot定量分析。
3 讨 论
自组装短肽是近年新兴的一种多功能生物材料,其形成的纳米纤维支架可以模仿体内细胞生长的微环境,控制释放生长因子,从组织、细胞到信号因子,蛋白表达促进细胞和组织的原位修复和再生,具有高生物活性与高生物相容性,因而被广泛应用[5-7]。HUVEC已证实可通过多种途径在炎性细胞的黏附和迁移,以及新生血管的形成等病理生理过程中发挥作用,且结构和功能与动脉内皮细胞相似[8-9]。而ox-LDL可以增加血管内皮细胞对某些生长因子、细胞因子的表达和分泌,促进泡沫细胞的形成,抑制内皮依赖性血管松弛,诱导细胞凋亡和坏死,是内皮功能损伤的危险因素[10-11]。低密度脂蛋白(low-density lipoprotein,LDL)通过氧化应激作用形成ox-LDL,ox-LDL可以与内皮细胞表面受体(LOX-1)特异性结合,引起内皮功能失调、损伤,是促进斑块形成的重要机制[2,12]。
为了明确Sciobio-Ⅱ 在ox-LDL 诱导血管内皮损伤中的作用,本实验以ox-LDL 刺激HUVEC 作为体外细胞模型,通过检测细胞增殖情况及细胞凋亡,可观察到ox-LDL刺激后HUVEC的增殖明显下降、细胞凋亡率则明显增加,说明ox-LDL 能够诱导HUVEC 发生损伤。在ox-LDL 刺激的基础上引入Sciobio-Ⅱ 后发现细胞增殖较ox-LDL组能明显恢复,细胞凋亡率下降,说明Sciobio-Ⅱ能够改善ox-LDL引起的HUVEC损伤,结合本实验研究结果表明其具体作用机制可能与Bax/Bcl-2通路有关。结合本课题组现有的研究结果,筛选探索Bax/Bcl-2相关信号通路,认为这一恢复作用的分子介导机制可能与VEGF/Notch信号通路相关。VEGF是已证实的能够在血管损伤及再生过程中发挥作用的一种生长因子,可以介导Notch信号通路,刺激信号通路中的Bax、Bcl-2基因,使Bcl-2基因表达水平增多,Bax基因表达水平减少,从而促进血管内皮细胞迁移、黏附及微血管网络的生成,抑制血管内皮细胞凋亡[13-15]。本实验结果显示在引入VEGF/Notch信号通路抑制剂后,Bax和Notch1的蛋白及基因表达水平升高,Bcl-2和VEGFR-2的蛋白及基因表达水平降低,说明Sciobio-Ⅱ是可以通过被激活的VEGF/Notch信号通路来减轻ox-LDL引起的HUVEC凋亡。
综上所述,自组装短肽Sciobio-Ⅱ通过激活 VEGF/Notch信号通路减轻 ox-LDL 诱导的血管内皮细胞损伤,这也可能是Sciobio-Ⅱ发挥细胞保护作用的机制与作用途径,今后可进一步开展体内实验来验证,并进一步研究其对动脉粥样硬化的预防或延缓作用,为临床治疗提供新的思路。
