截短型神经连接蛋白-1原核表达载体的构建、表达、纯化及其对阿尔茨海默症的初步治疗效果
2022-11-27苏晓男毕鹏翔李超黄青于欣洋吴丹郭艳芹
苏晓男,毕鹏翔,李超,黄青,于欣洋,吴丹,3,郭艳芹,
1.牡丹江医学院,黑龙江 牡丹江 157011;2.牡丹江医学院附属红旗医院,黑龙江 牡丹江 157011;3.牡丹江医学院医药研究中心,黑龙江 牡丹江 157011
阿尔兹海默症(Alzheimer disease,AD)是一种常见的以记忆障碍、行为损害为主要特征的中枢神经系统退行性疾病,为老年痴呆最常见类型。当今世界随着人口老龄化加重,AD发病率逐年增加,由于缺乏有效的治疗手段,AD死亡率一直居高不下,研究该病发病机制成为急需解决的问题。AD组织病理学上的典型改变为β淀粉样蛋白(β-amyloid protein,Aβ)沉积形成的老年斑、神经原纤维缠结、突触丢失和胶质增生以及氧化应激等[1-2]。近年来的研究表明,AD早期病理学的表现为突触的丢失及结构改变。Aβ沉积在大脑中的数量与AD严重程度无关,但突触丢失与AD严重程度有关。神经连接蛋白-1(neuroligin-1,NL-1)为神经细胞黏附分子家族一员,最早作为突触连接蛋白(neurexin,NRX)的配体被发现,主要位于兴奋性突触后膜,对突触的发育、功能及可塑性至关重要,NL-1功能的改变导致的突触结构和功能障碍与AD发病密切相关[3-4],并参与多种疾病发生,如自闭症谱系障碍、多动症、双向情感障碍等。进一步的研究发现,Aβ寡聚体可直接与NL-1 N-末端可溶性细胞外片段[胆碱酯酶样结构域(cholinesterase-like domain,CLD)]发生相互作用,破坏突触间神经突触黏附对(NRX-NL)突触组织复合物的结构及平衡,引发突触丢失及功能障碍,为AD的发生奠定了病理基础[5-8]。
前期的相关研究证实,NL-1细胞外区域能与Aβ发生相互作用,并可与野生型NL-1(wtNL-1)竞争结合过量表达的Aβ,减弱wtNL-1与Aβ肽的相互作用,维持突触间结构、功能稳定,但其在体内试验中表达不佳[9]。本实验对NL-1细胞外区域进行生物信息学分析,发现其存在不同功能位点,预测不同功能区域,因此设计5个截短NL-1(tNeuroligin-1,tNL-1)]片段,构建NL-1细胞外可溶性片段截短克隆体及其原核表达载体,表达重组GST-tNL-1融合蛋白,纯化后作用于SHSY-5Y细胞模型,探究其对Aβ诱导的神经细胞毒性的保护作用。后续会将重组表达载体应用于海马神经元细胞、SD大鼠进行体内外试验,为AD的治疗提供新的思路。
1 材料与方法
1.1 细胞、菌株及载体 人神经母细胞瘤细胞(SHSY-5Y)购自武汉普诺赛生命科技有限公司;大肠埃希菌感受态细胞C43、DH5α、表达载体pGEx-6p1、NL-1细胞外片段1-691质粒均由牡丹江医学院医药研究中心保存。
1.2 主要试剂及仪器T4 DNA连接酶、限制性内切酶XhoⅠ、BamHⅠ购自美国Thermo Scientific公司;质粒小提试剂盒、DNA回收试剂盒购自北京康为世纪生物科技有限公司;IPTG购自德国Biofroxx公司;酵母提取物、蛋白胨购自英国Oxoid公司;GST标签纯化树脂、1,1,1,3,3,3-六氟-2-丙醇(1,1,1,3,3,3-Hexafluoro-2-propanol,HFIP)购自美国Sigma公司;GSH(抗氧化剂)、GST标签蛋白纯化试剂盒购自碧云天生物技术有限公司;Aβ1-42淀粉样蛋白单体购自大连美仑生物技术有限公司;兔抗GST单克隆抗体、兔抗Aβ1-42单克隆抗体、羊抗兔多克隆抗体购自美国Abcam公司;ECL发光底物试剂盒购自美国Biosharp Life Science公司;PCR仪、超灵敏多功能成像仪购自德国Eppendorf公司。
1.3 生物信息学分析 利用在线工具Protparam、SMART、STRING数据库、PTMcode预测蛋白质基本理化性质、NL-1细胞外区域、重复基序和特征、蛋白质相互作用、预测功能伙伴、蛋白质翻译后修饰位点等。
1.4 重组表达载体pGEx-6P1-tNL-1的构建
1.4.1 截短片段引物设计及合成 已知NL-1细胞外片段长691个氨基酸,2 073 bp。设计的截短片段(tNL-1①~⑤)分别为:①NL283-666、②NL109-691、③NL323-691、④NL260-510、⑤NL180-510。利用Primer 5.0根据NL-1蛋白基因序列(NM_001365923.2)设计引物,上下游分别插入XhoⅠ和BamHⅠ酶切位点,见表1。引物由金唯智生物科技有限公司合成。
1.4.2 重组表达载体的构建 以NL-1细胞外片段1-691质粒为模板,PCR扩增目的片段。反应条件为:94℃预变性2 min;94℃变性30 s,58℃复性30 s,72℃延伸1 min,共30个循环;72℃延伸2 min。胶回收PCR产物,经XhoⅠ、BamHⅠ双酶切回收目的基因片段,与表达载体pGEx-6p1 4℃连接12 h;转化大肠埃希菌C43感受态细胞,收集菌液涂布含100 mg/mL氨苄青霉素的LB平板上,37℃培养过夜;挑取平板上菌落进行菌液PCR鉴定,挑取阳性克隆,提取质粒进行双酶切及PCR鉴定,鉴定正确的质粒送生工生物工程(上海)股份有限公司测序。测序正确的质粒命名为pGEx-6P1-tNL-1。利用SnapGene软件绘制质粒图谱。
1.5 重组蛋白的诱导表达 挑取pGEx-6P1-tNL-1①~⑤阳性单菌落至1 mL LB液体培养基中,37℃恒温摇床培养过夜,作为初始菌液。分别进行诱导表达时机、诱导表达温度、IPTG诱导浓度的优化。tNL-1诱导表达时机的优化:挑取阳性克隆至5 mL氨苄抗性(1 mmol/L)LB培养基中,37℃活化过夜;按1∶200比例接菌至1 000 mL氨苄抗性(1 mmol/L)培养基中,37℃分别水平摇床振荡2、3、4 h后降温至25℃;加入0.5 mmol/L IPTG诱导16 h。tNL-1诱导表达温度的优化:挑取阳性克隆至5 mL氨苄抗性(1 mmol/L)LB培养基中,37℃活化过夜;按1∶200比例接菌至1 000 mL氨苄抗性(1 mmol/L)培养基中,37℃水平摇床振荡3 h;分别降温至16、25、37℃后,加入0.5 mmol/L IPTG诱导16 h。tNL-1 IPTG诱 导浓 度的优化:挑取阳性克隆至5 mL氨苄抗性(1 mmol/L)LB培养基中,37℃活化过夜;按1∶200比例接菌至1 000 mL氨苄抗性(1 mmol/L)培养基中,37℃水平摇床振荡3 h;降温至25℃后,分别加入0.1、0.3、0.5 mmol/L IPTG诱导16 h。分别离心收集菌体,沉淀中加10 mL PBS重悬,漩涡振荡,超声破碎(超声5 s,停10 s,重复50次),4℃,20 817×g离心40 min;将上清与GST标签纯化树脂4℃过柱结合(时间>1 h),加入2 mL清洗液(PBS,1 mmol DTT)洗涤杂蛋白,重复2次。分别取超声破碎后全菌3µL、离心后上清15µL、过柱流穿液15µL、GST标签纯化树脂15µL,进行12%SDS-PAGE分析。
1.6 重组蛋白的纯化 接菌后按以上最佳诱导条件进行诱导,收集菌体,按蛋白纯化试剂盒说明书纯化蛋白后,进行12%SDS-PAGE分析。用GSH洗脱缓冲液(250 mmol/L Tris HCl,150 mmol/L HCl,15 mmol/L GSH,pH 8.0)进行蛋白洗脱,5 min吹打1次,每次30 min,取流穿液,共4次(总时长2 h),得到带GST标签的目的蛋白。

表1 tNL-1①~⑤片段的引物设计Tab.1 Design of primers for tNL-1①~⑤
1.7 重组蛋白的抗原特异性检测 采用Western blot法。将纯化的重组蛋白经12% SDS-PAGE分离(80 V恒定电压30 min,后转为120 V)后,切胶烤染蛋白转至PVDF膜上(150 mA恒定电流90 min),脱脂奶粉室温封闭1 h;1×TBST洗膜3次,每次10 min,加入兔抗GST单克隆抗体(1∶1 000稀释),4℃过夜;TBST洗膜3次,每次10 min,加入羊抗兔多克隆抗体(1∶10 000稀释),室温孵育1 h;TBST洗膜3次,利用化学发光试剂盒进行重组蛋白显色,成像仪成像。
1.8 Aβ寡聚体的体外制备 将HFIP置冰上预冷,避光条件下,向1 mg Aβ单体粉末中加入222µL HFIP至终浓度为1 mmol/L,轻轻吹打液体,使Aβ单体粉末充分溶解,室温孵育60 min;置冰上静置10 min,转移至1.5 mL EP管中,管盖打开,通风橱过夜,使HFIP挥发完全后,干燥的肽膜-80℃保存,用时取出。每管加入DMSO溶液至终浓度为5 mmol/L,加入不含酚红的F12培养基稀释至原体积5倍(不要超过100µmmol/L,试验使用浓度为50µmmol/L),4℃孵育24 h;4℃,20 817×g离心10 min,取上清,即为寡聚体,按1.7项方法进行Western blot分析。
1.9 tNL-1②对Aβ诱导的SHSY-5Y细胞保护作用的检测 采用MTT法。当SHSY-5Y细胞密度生长至培养瓶80%左右时,按5×103个/孔接种96孔板,每组设4个复孔,终体积200µL。周围孔中加入250µL PBS缓冲液,左上角标记。37℃,5% CO2培养过夜。将细胞分为对照组、模型组、实验组:对照组不作任何处理;模型组用40µg/mL Aβ单独处理24 h;实验组为与模型组相同的Aβ浓度+20、40、60µg/mL tNL-1②共处理24 h。到达作用时间后,避光条件下加入MTT溶液,20µL/孔,继续培养4 h;加入DMSO,150µL/孔,上酶标仪,于490 nm波长处测定各孔A值。根据A值按下式计算细胞存活率。用Grapdh-Pad软件绘制柱状图。

1.10 统计学分析 用GraphPad Prism 5.0软件对全部实验数据进行统计学分析,用软件Graphpad Prism 6.0绘图,计量资料结果采用均数±标准差(x±s)表示,在统计过程中多组间比较应用One-way ANOVA进行统计,以P<0.05为差异有统计学意义。
2 结果
2.1 生物信息学分析
2.1.1 蛋白质基本理化性质Protparam预测结果显示,NL-1细胞外区域含2 073个氨基酸,相对分子质量为76 877 190,分子式为C3468H5302N912O1021S24,等电点为5.30。体外半衰期(哺乳动物网织红细胞)为30 h,酵母菌(体内)为20 h,大肠埃希菌(体内)为10 h。Cys、Thr和Gly在NL-1氨基酸组成中占比相对较高。不稳定指数为44.15,归类为不稳定氨基酸。脂肪族指数为28.75。平均亲水性(grand average of hydropathicity,GRAVY)为0.756,定义为疏水性氨基酸,可推断tNL-1为疏水性蛋白质,在维持蛋白质三级结构稳定中起重要作用。
2.1.2 NL-1细胞外区域、重复基序和特征SMART软件分析结果显示,其包含了1个共酯酶(胆碱酯酶-羧酸酯酶)结构域(51-606);1个水解酶结构域(176-282)和1个跨膜区(677-699)。见图1和表2。
2.1.3 蛋白质相互作用及预测功能伙伴STRING数据库分结果显示,NL-1可与NRXs、SHANKs、DLG4、突触后密度95蛋白(postsynaptic density protein-95,PSD-95)相互作用。见图2。

图1 SMART软件预测NL-1细胞外区域、重复基序和特征Fig.1 Prediction of extracellular region,repeated motif and feature of NL-1 by SMART software

表2 NL-1细胞外区域、重复基序和特征的预测Tab.2 Prediction of extracellular region,repeated motif and feature of NL-1

图2 STRING数据库分析预测NL-1功能伙伴Fig.2 Analysis and prediction of NL-1 functional partners by STRING database
2.1.4 蛋白质翻译后修饰位点PTMcode分析结果显示,NL-1中有12个蛋白修饰位点(磷酸化位点4个、N-糖基化位点4个、O-GalNAc糖基化位点2个、O-联糖基化位点2个),见图3。预测其中有8个修饰位点两两相关联,见表3。据此关联设计截短体。

表3 tNL-1翻译后修饰功能位点关联Tab.3 Association of functional sites of tNL-1 post-translational modification

图3 PTMcode软件预测蛋白质翻译后修饰功能区域Fig.3 Prediction of functional regions of post-translational modification of protein by PTMcode software
2.2 重组表达质粒pGEx-6P1-tNL-1的鉴定
2.2.1 质粒图谱绘制SnapGene软件绘制的质粒图谱见图4,分别包含tNL-1①~⑤5种截短体。
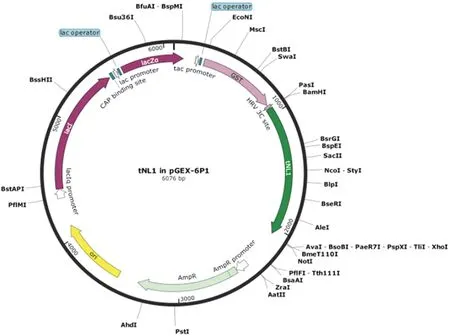
图4 质粒pGEx-6P1-tNL-1目的片段、载体、酶切位点结构示意图Fig.4 Schematic diagram of structure of target fragment,vector and restriction site in plasmid pGEx-6P1-tNL-1
2.2.2 扩增产物鉴定 目的基因扩增产物经1.0%琼脂糖凝胶电泳分析,分别可见与目的片段大小相等的DNA条带,见图5。经BamHⅠ和XhoⅠ双酶切目的片段,可见与预期大小一致的带有黏性末端的目的条带,见图6。
2.2.3 菌液PCR鉴定tNL-1①~⑤菌液PCR结果显示,产物大小与目的片段大小一致,见图7。
2.2.4 质粒的鉴定 质粒的PCR及双酶切(BamHⅠ/XhoⅠ)产物经1.0%琼脂糖凝胶电泳分析,均可见与预期大小一致的目的片段,见图8和图9。测序结果显示质粒pGEx-6P1-tNL-1①~⑤构建正确。
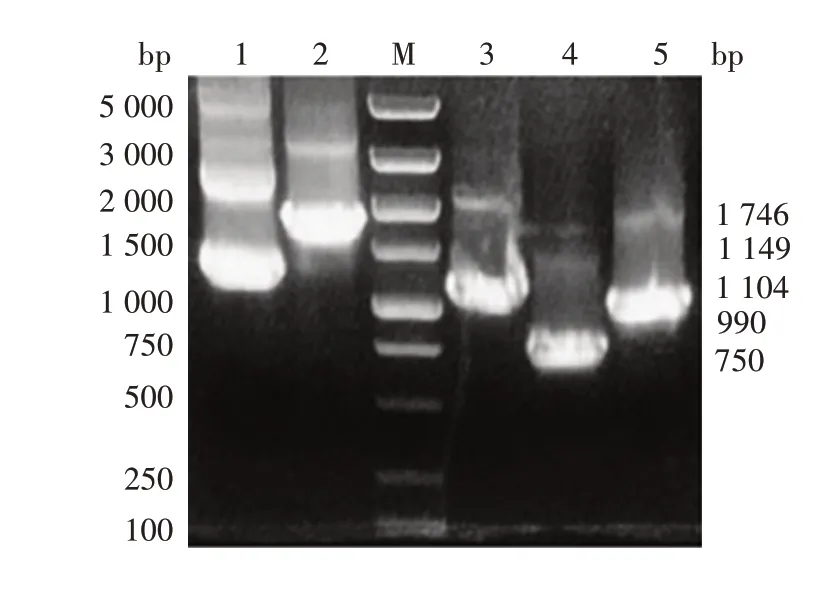
图5 5种tNL-1片段扩增产物电泳图Fig.5 Electrophoretic profile of PCR products of 5 kinds of tNL-1 fragments

图6 5种tNL-1片段的双酶切(BamHⅠ/XhoⅠ)鉴定Fig.6 Restriction map of 5 kinds of tNL-1 fragments(BamHⅠ/XhoⅠ)
2.3 表达及纯化的tNL-1蛋白的鉴定
2.3.1 表达的tNL-1蛋白的鉴定 表达的重组tNL-1①~⑤蛋白相对分子质量分别约68 000、90 000、66 000、53 000和62 000,全菌表达较高,上清中可溶性表达较低,推测5种蛋白大部分呈包涵体表达,见图10。
2.3.2 优化后的tNL-1蛋白诱导表达条件 当诱导温度一定时,通过不断改变接菌时间、诱导浓度,得到大小与预期一致的tNL-1蛋白,见图11。确定最佳诱导条件为:37℃培养2 h,A600为0.8时降温至16℃,加入0.1 mmol/L IPTG诱导12 h。
2.3.3 洗脱的重组tNL-1蛋白的鉴定12% SDSPAGE分析显示,经GST纯化获得的重组tNL-1蛋白相对分子质量分别为68 000、90 000、66 000、53 000和62 000,见图12。

图7 5种tNL-1片段菌液PCR鉴定Fig.7 Identification of 5 truncated kinds of tNL-1 fragments by microbial PCR

图8 重组质粒pGEx-6P1-tNL-1①~⑤的PCR鉴定Fig.8 Identification of recombinant plasmids pGEx-6P1-tNL-1①~⑤by PCR

图9 重组质粒pGEx-6P1-tNL-1①~⑤的双酶切鉴定Fig.9 Restriction map of recombinant plasmids pGEx-6P1-tNL-1①~⑤

图10 重组tNL-1①~⑤蛋白诱导表达产物的SDS-PAGE分析Fig.10 SDS-PAGE profile of expressed recombinant proteins tNL-1①~⑤

图11 tNL-1重组蛋白诱导表达优化后的SDS-PAGE分析Fig.11 SDS-PAGE profile of recombinant tNL-1 protein expressed under optimized condition

图12 洗脱的重组tNL-1①~⑤蛋白的SDS-PAGE分析Fig.12 SDS-PAGE profile of eluted recombinant proteins tNL-1①~⑤
2.3.4 纯化的重组tNL-1蛋白的鉴定Western blot分析显示,纯化的重组tNL-1①~⑤蛋白可被抗体特异性识别,相对分子质量分别为68 000、90 000、66 000、53 000和62 000,大小与目的蛋白一致,见图13,表明原核表达载体构建成功。

图13 纯化的重组tNL-1①~⑤蛋白的Western blot分析Fig.13 Western blotting of purified recombinant proteins tNL-1①~⑤
2.4 Aβ1-42寡聚体的鉴定Western blot分析显示,50 nmmol/L Aβ寡聚体在相对分子质量约4 000和12 000处条带明显,其余条带则不明显,见图14,表明制备的寡聚体主要以单体和三倍体形式存在。

图14 Aβ1-42寡聚体的Western blot鉴定Fig.14 Western blotting of Aβ1-42 oligomer
2.5 tNL-1②对Aβ诱导的SHSY-5Y细胞的保护作用MTT检测结果显示,与对照组相比,模型组细胞生存率显著降低,细胞形态改变(P=0.000 1);3个实验组(Aβ+20、40、60µg/mL tNL-1②)较模型组细胞生存率显著升高(P分别为0.006、0.000 6和0.000 5)。见表4。表明Aβ对SHSY-5Y细胞存在毒性作用,tNL-1能缓解Aβ对SH-SY5Y细胞模型的的增殖抑制。

表4 SHSY-5Y细胞不同处理组对细胞增殖的影响(%)Tab.4 Proliferations of SHSY-5Y cells in various groups(%)
3 讨 论
研究显示,AD的早期认知能力下降与突触丢失有关[10-11]。虽然Aβ1-42寡聚体的致病机理目前在分子水平上尚不清楚,但NL-1可能为Aβ1-42寡聚体的靶向蛋白。NL-1最初被关注是因其细胞外结构域与乙酰胆碱酯酶同源[6,11-12],但缺乏1个关键残基,现被证明也是NRX-NL中重要的一员[13]。NRX-NL复合物是研究最多的突触组织复合物之一,该复合物的突变是易患自闭症和精神分裂症等认知障碍的遗传决定因素。NL属于一类含有CLD的分子家族,与胆碱酯酶不同的是,NL在位于CLD内的催化三联体中缺少1个残基,这使得其在酶学上无活性。
当Aβ释放至突触间隙时,会与兴奋性突触后膜上的NL-1结合,引起更多的寡聚体局部聚集,并破坏突触后区域,导致AD发生[14-15]。本研究成功构建并表达了重组tNL-1①~⑤蛋白,在最初的蛋白纯化过程中,tNL-1①~⑤呈包涵体表达,由于包涵体纯化工艺复杂,变性、复性较难掌握,在试验中应尽量降低包涵体生成。本研究低温诱导后,通过不断改进诱导时机、诱导温度、IPTG诱导浓度,筛选出最佳诱导条件,成功表达并纯化出高纯度的重组tNL-1蛋白。
本课题使用GST融合蛋白,释放出天然结构的tNL-1,保留了琼脂糖极好的亲水性及大网架结构,与生物活性大分子有较好的相容性,具有载量高、非特异性吸附少,流速快等特点。本研究通过构建Aβ处理的SHSY-5Y细胞模型,稳定模拟了AD病理表现,可作为研究AD治疗方法的体外模型。结果显示,Aβ作用后的对照组细胞增殖受到抑制,具有明显的细胞毒性,经不同浓度(20、40和60µg/mL)重组蛋白处理后,细胞增殖活力增强,在Aβ+60µg/mL tNL-1②组作用最显著(P<0.001)。Aβ在AD患者脑内沉积,影响神经突触活动,导致不可逆性认知功能、记忆障碍。突触前NRXN2α和突触后黏附蛋白NLGN1在AD早期受影响区域的定位,以及在海马和皮质这些兴奋性突触中跨突触相互作用,也确保了结构的稳定性和突触功能的增强。同时通过结合Aβ寡聚体,影响突触细微结构内突触蛋白平衡[16]。Aβ寡聚体、NL-1目前参与突触衰竭疾病的致病机理尚不清楚,但大量文献表明,NL-1为Aβ寡聚体靶向蛋白,NL-1结构受损是AD的发病机制之一[3-10]。Aβ寡聚体会导致NL-1水平下降及齿状回神经元数量明显减少,并加剧空间学习记忆的损伤。NL-1通过其胞外区CLD靶向定位Aβ于兴奋性突触的突触后区域[17]。许多蛋白被描述为兴奋性突触突触后区域的Aβ特定受体[12,18-19],包括谷氨酸能受体(NMDA和mGluR5受体)[12,18]、卷曲受体[19]、细胞朊蛋白(PrPc)[20]等。除神经蛋白外,还有哪些蛋白质通过与细胞外序列结合来调节其功能,以及NL-1与其他神经蛋白的结合信号是如何转导为细胞内效应信号的,这些问题目前仍缺乏与突触相关的分子信息,也是未来需更加关注的话题[21]。
