陆地棉GhWDR基因的克隆和功能初步解析
2022-11-21马丽梅阎媛媛
马丽梅,阎媛媛
(河北农业大学 农学院/华北作物改良与调控国家重点实验室/河北省作物种质资源重点实验室,河北 保定 071000)
棉花是我国产业链最长的经济作物,植棉区域已扩展到北纬46 度[1]。棉花在生长过程中,纤维产量和品质易受到自然灾害的影响,而早熟棉的栽培不仅有利于躲避不良气候,还能有效降低苗期病虫害,有效减少农药用量和田间管理[2]。因此早熟性成为现代棉花育种的基本目标之一。但是,我国早熟棉种质资源匮乏,制约着早熟棉高产、优质、高抗的协同改良。挖掘棉花开花调控基因,创制优异种质资源是棉花品种改良的重要基础。
WD40 转录因子家族是1 个存在于所有真核生物中的超家族,参与多个蛋白复合物的组装和结合[3],调节生长发育和非生物胁迫[4-7]。WD40 蛋白,也被称为WD-repeat 蛋白,由1 个高度保守的特定WD40 基序定义。WD40 蛋白通常包含4 ~16个串联重复WD 基序,多个结构域连接组成类似口袋的结构,构成WD40 蛋白的中心[8]。WD40 基序的序列、数目的差异和基序外的其它结构域的不同,使其功能产生差异。
MYB-bHLH-WD40 (MBW)复合物通过调控、催化植物花青素和原花青素(PAs)的生物合成酶[9],在植物花青素代谢途径的转录调控中发挥重要作用[10-11]。此外,TTG1-bHLH- MYB 复合物通过调控激活子或者抑制子来参与拟南芥叶表面毛状体结构的调控[12]。在拟南芥中,GIGANTUS1 通过蛋白-蛋白相互作用控制种子萌发,生长和物质积累[13]。小麦TaWD40D在拟南芥中的异源过表达大大增加了种子萌发过程中对ABA,盐胁迫和渗透胁迫的耐受性[14]。Salih 在陆地棉中鉴定到579 个WD40基因[15],已知陆地棉TTG1同源基因通过形成WD40-bHLH-MYB 蛋白复合物调控棉纤维发育的起始和伸长[16]。而大量棉花WD40 基因的功能尚不清楚。
本实验室GWAS 关联分析鉴定了1 个与棉花开花时间相关的WD40 基因[17],并进一步克隆了该基因,将其命名为GhWDR,本研究对其进行功能的初步解析,为棉花分子育种提供基因资源和理论依据。
1 材料与方法
1.1 基因克隆及序列分析
以TM-1 叶片cDNA 为模板扩增GhWDR的全长CDS 序列,引物如表1。扩增条件如下:95 ℃3 min;95 ℃ 10 s、58 ℃ 30 s、72 ℃ 30 s,34 个循环;72 ℃ 5 min。获得的目的片段经双酶切后连接到载体35S:pGreen-GFP 上,并测序获得基因序列。

表1 本研究中所用引物序列Table 1 Primer sequences used in this study
克隆获得的序列在Cottongen 在线Blast,分析其与参考基因组序列差异,并获得基因编码区和非编码区序列信息。GSDS(http://gsds.gao-lab.org/)在线分析外显子-内含子结构;在NCBI 通过Blastp 获得其他物种的同源基因;DNAMAN 软件对同源基因氨基酸序列进行比对;MEGA 7.0 软件用于构建系统进化树(临近法,Bootstrap 设置为1000);利用Cell-PLoc 2.0(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)进行亚细胞定位预测;在线网站CD Search(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)用于保守结构域分析。在线 网 站Plant CARE[18](http://bioinformatics.psb.ugent.be/webtools/plantcare/html/) 用于启动子顺式作用元件分析。在线网站STRING (https://cn.stringdb.org/)用于互作蛋白预测。
1.2 基因表达特征分析
8 个组织(根、茎、叶、雌蕊、雄蕊、花萼、花瓣和花托)和胚珠、纤维不同发育时期的转录组数据,以及冷、热、盐和PEG 胁迫的转录组数据(PRJNA 248163)下载于NCBI SRA (Sequence Read Archive)数据库。对不同组织的转录组数据进行标准化处理[17],并分析基因的特异性表达情况。对4 种非生物胁迫不同时间相对未处理时表达差异倍数(Fold change, FC)进行处理,分析基因对非生物胁迫的响应情况。正值表示上调表达,负值表示下调表达。利用TBtools[19]进行热图的绘制。
棉花系TM-1 培养于28 ℃不同光周期(长日照16 h 光照/8 h 黑暗和短日照8 h 光照/16 黑暗),及长日照不同温度(18、28、35 ℃),并于3 叶期和5 叶期取整株幼苗叶片于液氮速冻,用于检测基因对环境的响应。
1.3 转基因植物构建及培养方法
拟南芥野生型(Col)和转基因株系培养于23℃,长日照(16 h 光照/8 h 黑暗)的温室中。通过农杆菌介导的遗传转化进行拟南芥转化,利用1∶1 000 basta 进行阳性植株的筛选。提取拟南芥基因组DNA,利用跨载体特异性引物35spro 和GFP-R 进行PCR 检测进一步筛选阳性植株。对于每个野生型或转基因拟南芥株系,抽薹长度2 cm 时进行轮座叶数目统计。提取野生型和转基因拟南芥叶片总RNA,用于检测AtSOC1和AtFT的表达量,引物序列见表1。
1.4 RT-PCR 检测
使用RNA prep Pure Plant Kit(天根,北京,中国)提取棉花和拟南芥总RNA;使用PrimeScriptTM1st strand cDNA Synthesis kit(索莱宝,美国)反转录试剂盒进行cDNA 的合成。用1 μg 总RNA 进行反转录。将cDNA 稀释4 倍用于定量检测。操作方法参照说明书。RT-PCR 反应体系为10 μL,其中包括:前引物(0.5 μL)、后引物(0.5 μL)、模板cDNA(1 μL)、2×AugeGreen qPCR Master Mix(US Everbright)(5 μL)、ddH2O(2.9 μL)、ROX(0.1 μL)。反应条件:95 ℃ 2 min;95 ℃ 5 s,60 ℃ 5 s,40 个循环;72 ℃ 50 s。棉花以GhHIS 基因为内参,拟南芥以AtTUB2基因为内参,采用2-ΔCT法[20]计算相对表达量。每个样品进行3 个生物学重复和3 个技术重复。
2 结果与分析
2.1 陆地棉GhWDR基因序列分析
从陆地棉TM-1 叶片中克隆得到GhWDR全长CDS 序列,与参考基因组序列相似度达100%(图1a),表明获得目的基因片段。该基因全长1 053 bp,编码350 个氨基酸(图1a),含有4个连续重复的WD40 repeat 基序(图1b)。利用GSDS 分析基因结构,结果显示GhWDR基因含有7 个外显子和6 个内含子,与拟南芥同源基因AT3G15610高度保守,仅内含子长度存在较大差异(图1c)。蛋白3D 结构预测显示4 个串联重复的WD40repeat 与结构域其它序列构成了类似于口袋的结构(图1d),符合WD40 蛋白的一般特征。GhWDR 蛋白分子量为38.04 kD,等电点为5.919, 预测定位于细胞核内,这与其转录因子的功能相符。

图1 棉花GhWDR基因序列分析Fig. 1 Sequence analysis ofGhWDRinGossypium hirsutum
系统进化树分析结果显示陆地棉GhWDR 与其它四倍体和二倍体棉WD40 蛋白聚类在一簇,且与雷蒙德氏棉D 基因组同源性最近(图2a),表明该WD40 序列在棉属中进化保守。并且棉属WD40 同源基因与锦葵目木槿、榴莲、可可聚为一簇,在葡萄、莲花等古老物种中同样存在同源基因,且这些同源序列的相似性较高,GhWDR 与拟南芥AT3G15610相似性达81.43%,进一步表明其进化的保守性,预示其功能的保守性。WD40 蛋白往往通过与不同蛋白的互作,以复合物的形式参与植物的多种生理活动。利用STRING 对GhWDR 进行互作蛋白预测,检测到2 个可以与GhWDR 发生互作的蛋白,分别是Gh_D08G2652.1 和Gh_A05G4000.1,且Gh_D08G2652.1 和Gh_A05G4000.1 二者之间也存在互作关系。Gh_D08G2652.1 是小核核糖核蛋白E,含有Sm_E 结构域;Gh_A05G4000.1 是小核核糖核蛋白F,含有Sm_F 结构域,参与各种基因的替代剪接。Gh_D08G2652.1 与 拟 南 芥AT4G30330.1 为 同源基因,AT4G30330.1 参与环境温度的响应,随着环境温度的升高而上调[21]。复合物GhWDR-Gh_D08G2652.1-Gh_A05G4000.1 可 能 是GhWDR 发 挥功能的一种形式,在高温环境下调控植物生长发育。
顺式作用元件是转录因子的结合位点。我们预测了GhWDR上游2 kb 序列包含的顺式作用元件,结果显示GhWDR启动子除了含有TATA-box 和CAAT-box 核心启动子元件外,还检测到了光响应相关的元件TCCC-motif、GATA-motif、chs-CMA1a、GT1-motif、G-box、GA-motif、TCT-motif, 脱 落酸响应元件ABRE 和茉莉酸响应元件TGACG-motif(图2b),预示GhWDR可能受ABA 和茉莉酸调控参与胁迫反应。

图2 陆地棉GhWDR生物信息学分析Fig. 2 Bioinformatics analysis of GhWDR inGossypium hirsutum
2.2 陆地棉GhWDR基因表达特性分析
分析陆地棉以不同组织的转录组数据为基础,进行分析,结果显示GhWDR基因在各个组织中广泛表达,在雄蕊中的表达量最高(图3a, 3b)。此外,在快速伸长的纤维中呈持续的高转录水平,随着纤维的发育,在次生壁加厚期表达量呈现下降趋势(图3c),预示其参与纤维伸长发育的调控。
对GhWDR基因在干旱、盐、冷、热4 种非生物胁迫下的表达变化分析表明,干旱和热胁迫不影响GhWDR的转录,盐胁迫下GhWDR转录水平降低,但变化不明显,而冷胁迫持续诱导GhWDR转录水平降低,在12 h 时转录水平降低57%以上,表明GhWDR受冷胁迫抑制(图3d),可能参与植物抵御寒冷的过程。

图3 陆地棉GhWDR基因表达特性Fig. 3 Expression characteristics ofGhWDRinGossypium hirsutum
2.3 超表达GhWDR促进拟南芥开花
为探究GhWDR的功能构建了35S:GhWDR-GFP载体(pGreen)(图4a),利用沾花法转化拟南芥,对阳性植株基因组进行PCR 检测,得到1 条符合基因大小的条带,说明外源基因成功整合到基因组中(图4b)。在长日照条件下,超表达GhWDR拟南芥表现出早开花的现象,野生型拟南芥抽薹时轮作叶数为13 片,转基因株系的轮作叶为10 片(图4c)。进一步检测表型明显的L1 和L2 超表达拟南芥株系中GhWDR的转录水平,GhWDR的表达量远高于野生型植株(图4d),表明GhWDR具有促进开花的功能。
FT 和SOC1 是重要的开花整合子,汇总各开花调控路径的信号上调表达,进而激活花序分生组织决定子的转录,开启生殖生长。为了进一步明确GhWDR促进开花的功能,对比了野生型植株和超表达GhWDR植株中AtSOC1和AtFT的表达量,发现转基因植株中AtSOC1和AtFT的表达量显著高于野生型拟南芥(图4e)。以上结果表明GhWDR通过促进开花整合子SOC1和FT的表达调控植物开花时间,行使开花促进子的功能。
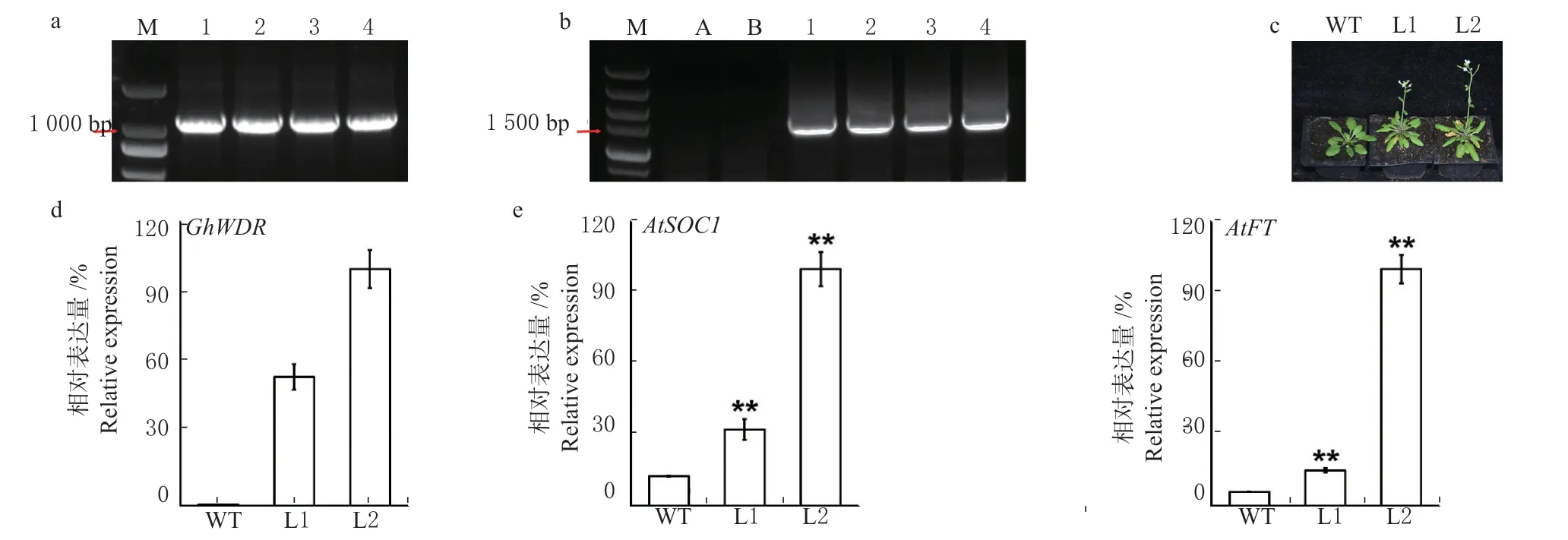
图4GhWDR促进开花Fig. 4GhWDRpromotes flowering
2.4GhWDR对环境温度和光周期的响应
根据上述试验结果,GhWDR在棉花各组织器官中广泛表达,并响应冷胁迫,表明GhWDR可能受环境因子变化的影响,转录水平发生波动,进而调控植物生长发育。因此,进一步试验检测了光周期和温度变化对生长发育关键期,成花诱导过程中GhWDR 转录水平的影响。一般认为,棉苗营养生长阶段,新叶首先观察到一个叶尖,而棉苗进入生殖生长后,新叶首先观察到多个叶尖。根据棉花生长特点,发现3 片真叶展平(3TLS)时,TM-1 植株仍进行营养生长,而第5 片真叶展平(5TLS)时,进入了生殖生长。故分别收取3 叶期和5 叶期不同日照长度和温度条件下生长的棉苗叶片,检测GhWDR转录水平。结果显示,GhWDR在长日照和短日照条件下表达量没有明显差异,仅5 片真叶期转录水平略微升高,表明GhWDR不参与光周期调控过程。与正常生长温度相比,低温下GhWDR的表达量在生殖生长阶段略有降低,而高温下GhWDR的表达量显著高于正常温度(图5)。综上,高温促进GhWDR的转录,进而促进棉花提前进入生殖生长阶段,而低温环境或低温胁迫下,GhWDR转录水平降低,不再促进发育。

图5GhWDR对环境温度和光周期的响应Fig. 5 Response ofGhWDRto ambient temperature and photoperiod
3 讨论
棉花原产于高温、干旱、短日照的热带和亚热带地区。在驯化的过程中发生了诸多改变,比如种子不再休眠、纤维变长变白变多、光周期敏感性丢失等[22]。大量重测序数据解析了人工驯化对于棉花性状改良的贡献,鉴定出了影响包括开花期在内的多个农艺性状位点[23]。WD40 蛋白是一类非常重要的蛋白家族,其成员在植物生长和抗逆过程发挥重要作用。GhWDR含有4 个WD40 基序,属于WD40-repeat 蛋白家族成员,与拟南芥中AT3G15610 同源。拟南芥AT3G15610 可能加强CUL4-DDB1-DCAF1复合体的形成,影响植物发育[24],其功能未知。此外,进化树中与GhWDR 相似性较高的WD40 基因功能均未见报导。而本研究首次明确了该WD40 基因在开花时间调控中的作用。
在拟南芥中,一些含有WD40 基序的蛋白参与光形态建成,如COP1 和SPA1[25]。CUL4-DDB1-COP1-SPA E3 连接酶复合物可以介导光形态建成和开花时间调控[26]。在GhWDR上游2 kb 的启动子中发现了大量的光响应元件,而GhWDR不响应光周期,这可能是由于棉花在进化过程中对光周期的敏感性降低。拟南芥AtFY含有7 个WD 重复序列,参与花芽分化起始的诱导,调控开花时间[27]。AtSOC1和AtFT作为开花整合因子,汇集多个开花调控通路信号,正向调控植物开花[28]。本研究发现超表达GhWDR植株表现出早花的现象,AtSOC1和AtFT的表达量在转基因株系中被显著上调,GhWDR具有开花促进子的功能。GhWDR对低温不敏感,而在高温下显著上调,这与预测的互作蛋白Gh_D08G2652.1 对高温的响应效应一致[21]。我们 猜 测,GhWDR 通 过 与Gh_D08G2652.1 和Gh_A05G4000.1 形成多聚体,参与高温途径,作为开花促进子调控植物花芽分化起始,保障植物对环境温度变化的适应。然而GhWDR在开花调控过程中的具体分子机制还有待进一步的研究。
基因的表达模式与功能密切相关。在棉花的生长发育过程中,GhWDR在各个组织中均持续高表达,说明在棉花的生长发育过程中起重要作用。GhWDR在雄蕊中的高表达,并结合其对环境高温的响应,猜测其可能参与雄蕊的发育过程,保障温度升高时花药成功散出。纤维的起始、伸长和次生细胞壁合成阶段对纤维的数量、长度和细度有很大的影响,这些是决定纤维产量的主要因素[29]。GhWDR在快速伸长的纤维中高转录,表明其可能参与了纤维伸长的促进。此外,棉花GhWDR响应冷胁迫显著下调表达,但延缓生长的环境低温并不影响其转录,表明GhWDR仅在植物受到低温胁迫时表达量降低。超表达银杏树WD40 基因GbLWD1-like,增强了对盐胁迫的耐受性[7]。在拟南芥中,过表达石斛DNMSI1基因导致对盐的耐受性降低[30]。目前尚未见WD40 参与植物低温耐受性的报道,本研究进一步丰富了WD40 蛋白在非生物胁迫中的功能。植物内源ABA 受冷胁迫积累增多,外施ABA 处理能诱导植物对冷胁迫的耐受性,并且ABA 信号通路相关基因受冷胁迫诱导,这些证据表明ABA 在植物抵御冷胁迫过程发挥重要作用[31]。大量冷胁迫诱导表达的基因启动子均包含ABRE 作用元件[32],GhWDR启动子大约-1 000 bp 处也检测到该ABA响应元件ABRE。因此推测GhWDR在冷胁迫下受ABA 调控,这与其转录水平在冷胁迫处理后逐渐下降,在12 h 时表达量下降57%以上的变化趋势相符,GhWDR不参与植物对冷胁迫的快速应答。
4 结论
本研究首次对棉花WD40 基因GhWDR功能进行了初步研究,发现其受环境高温诱导转录丰度上升,进而促进植物生长发育,提前开花,适应环境的变暖;而植物受到低温胁迫时,其转录受ABA 抑制,促进生长发育的功能被抑制,进而减缓棉花的生殖生长进程,平衡抗寒与生长发育间的关系,保障植物度过寒冷,在条件适宜时获得生殖生长的成功。本研究结果丰富了棉花适应环境的分子机制,为揭示棉花GhWDR基因响应环境温度促进开花的分子机理奠定基础。
