梅GRF基因家族生物信息学和表达分析
2022-11-21王蕊高峰KennethOmondiOuma倪照君侍婷高志红
王蕊,高峰,Kenneth Omondi Ouma,倪照君,侍婷,高志红
(南京农业大学果树生物技术实验室/园艺学院,江苏 南京 210095)
梅(Prunusmume)原产于中国,其果实具有较高的营养价值,经济栽培主要分布在东亚和东南亚的亚热带地区,中国是目前梅种植面积最大的国家[1]。植物芽休眠对多年生落叶果树抵抗冬季不利生长环境,并在次年春季正常萌芽和开花具有特别重要的意义[2]。而梅需冷量范围较广,对于研究果树季节性休眠机制具有独特优势[3]。
生长调控因子(growth regulating factors,GRF)编码的蛋白是植物特有的,2000年在水稻中被首次发现,并命名为OsGRF1[4]。2003年,Kim等[5]进一步研究发现GRF基因在调控植物生长和发育中发挥着至关重要的作用。在拟南芥中异位过表达白菜BrGRF8,可使植株子叶增大[6],过表达AtGRF1和AtGRF2则使叶片显著增大[5]。在拟南芥中超表达AtGRF7和AtGRF9会影响雌蕊的发育[7],过表达AtGRF1和AtGRF2 则导致晚花现象[5]。在油菜中超表达BnGRF2可提高种籽粒质量和油脂含量[8]。菊花GRF参与开花和周期调控以及对盐和低温等胁迫响应过程[9]。以上研究表明,植物GRF基因在生长、品质形成和胁迫响应方面都发挥了重要作用,是植物特有的一个重要调控因子。落叶果树休眠及开花机制一直都是研究热点,但目前PmGRF基因家族在功能相关方面的研究还存在空缺。本研究利用生物信息学手段对PmGRF家族进行分析,主要包括基因结构和保守基序分析、共线性分析以及在休眠4个时期的表达模式等,以期进一步了解PmGRF基因家族的功能。
1 材料与方法
1.1 材料
供试材料为梅品种‘桃形梅’,采自位于南京的国家果梅种质资源圃。从2020年9月27日至2021年1月31日,每隔7 d采集一年生枝条上的花芽,用液氮速冻后立刻带回实验室置于-80 ℃冰箱保存,并按照当年物候以及芽的发育状况将样品按照抑制性休眠、生理休眠、生态休眠和休眠解除4个阶段归类。其中,2020年9月27日至2020年11月1日为抑制性休眠阶段,2020年11月2日至2020年12月1日为生理休眠阶段,2020年12月2日至2021年1月3日为生态休眠阶段,2020年1月4日至2021年1月31日为生态休眠阶段。
1.2 PmGRF 家族基因的确定
从NCBI网站(http://www.ncbi.nlm.nih.gov)下载梅GRF蛋白序列,从Pfam网站(http://pfam.xfam.org/)下载WRC(PF08879)和QLQ(PF08880)保守域的隐马尔可夫模型(HMM)。利用Hmmer 3.0 软件检索梅蛋白组数据库,去除登录号相同的冗余序列,得到候选蛋白序列,利用SMATR网站(http://smart.embl.de/smart/batch.pl)验证候选蛋白是否存在WRC和QLQ结构域,若存在则属于梅GRF 蛋白家族。
1.3 PmGRF 基因家族的生物信息学鉴定
用ProtParam在线网站(https://web.expasy.org/protparam/)分析梅GRF基因家族成员的蛋白质特性,例如相对分子质量、等电点(pI)和疏水性(GRAVY)等。运用BUSCA在线网站(http://busca.biocomp.unibo.it/)预测梅GRF基因家族成员蛋白的亚细胞定位。从NCBI数据库(http://www.ncbi.nlm.nih.gov)下载PmGRF基因家族成员的内含子、外显子信息、梅8条染色体的长度以及每个PmGRF基因的染色体位置,利用在线软件GSDS 2.0(http://gsds.gao-lab.org/index.php)绘制基因结构示意图,并使用MG2C在线网站(http://mg2c.iask.in/mg2c_v2.1/)在每条染色体上绘制精确的基因分布位置。利用MEME网站(http://meme-suite.org/tools/meme)分析PmGRF基因家族蛋白的保守基序,保守基序的最大检索值设置为15。基因间以及物种间的共线性图谱绘制和Ka/Ks计算由MCScanX软件(http://chibba.pgml.uga.edu/mcscan2)和KaKs计算器(http://code.google.com/p/kaks-calculator/wiki/KaKs_Calculator)完成。从NCBI数据库中检索每个PmGRF基因的启动子序列后利用PlantCARE网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行启动子顺式作用元件分析。
使用ClustalW比对所有GRF序列,参数设置为默认,再用MEGA X构建拟南芥、梅、杏、扁桃和桃GRF基因家族的综合系统发育树。从NCBI SRA数据库下载RNA-seq数据后用TBtools绘制热图[10],分析PmGRF基因在茎、叶、根、芽和果实中的表达谱。
1.4 PmGRF基因荧光定量表达分析
采用多糖多酚植物RNA提取试剂盒(成都福际生物技术有限公司)提取RNA,使用SYBR PreMixExTaqTM(TaKaRa)进行反转录得到4个休眠阶段的cDNA,然后对15个PmGRF进行RT-qPCR试验,并用公式2-ΔΔCT计算各个基因的相对表达量。用于RT-qPCR的引物如表1所示。

表1 用于检测PmGRF 基因表达的RT-qPCR 引物序列Table 1 Primer sequences for detection of the PmGRF genes expression with RT-qPCR
2 结果与分析
2.1 梅GRF基因家族成员的鉴定与基因、蛋白理化性质分析
根据GRF基因中的QLQ(PF08880)和WRC(PF08879)保守结构域,从梅基因组中检索并去除冗余序列后最终共鉴定出15个梅GRF基因,命名为PmGRF01—PmGRF15。由表 2可知:GRF蛋白在理论等电点、相对分子质量等方面均存在差异,其中PmGRF01编码的氨基酸序列中含有连续的未知氨基酸,所以其理论等电点以及相对分子质量无法确定。PmGRF基因编码的氨基酸数为283(PmGRF06)~2 254(PmGRF15),相对分子质量为31 560.8(PmGRF06)~252 420.6(PmGRF15),蛋白质理论等电点(pI)为5.75(PmGRF02)~9.50(PmGRF05)。87%的PmGRF基因家族编码蛋白的pI大于7,因此,说明梅GRF基因家族编码的多数蛋白富含碱性氨基酸。蛋白质疏水性(GRAVY)介于-1.064(PmGRF06)~-0.607(PmGRF09),疏水性负值越大表示越亲水,正值越大表示越疏水,疏水值介于-0.5~0.5的为两性氨基酸[11]。所有PmGRF编码的蛋白GRAVY值小于0,表明其都是亲水蛋白。亚细胞定位的结果显示,全部的基因都位于细胞核中,所以PmGRF属于典型的核蛋白。

表2 梅GRF基因及其编码蛋白的基本信息和理化性质Table 2 Basic information and physicochemical properties of GRF gene and coding proteins in Prunus mume
2.2 PmGRF基因家族的基因结构和保守基序分析
由图1可见:PmGRF基因的内含子数差异较大,为2~15个,其中PmGRF15的内含子数最多(15个)。有5个基因(PmGRF04、PmGRF05、PmGRF06、PmGRF08、PmGRF14)包含2个内含子,有5个基因(PmGRF09、PmGRF10、PmGRF11、PmGRF12、PmGRF13)包含3个内含子。
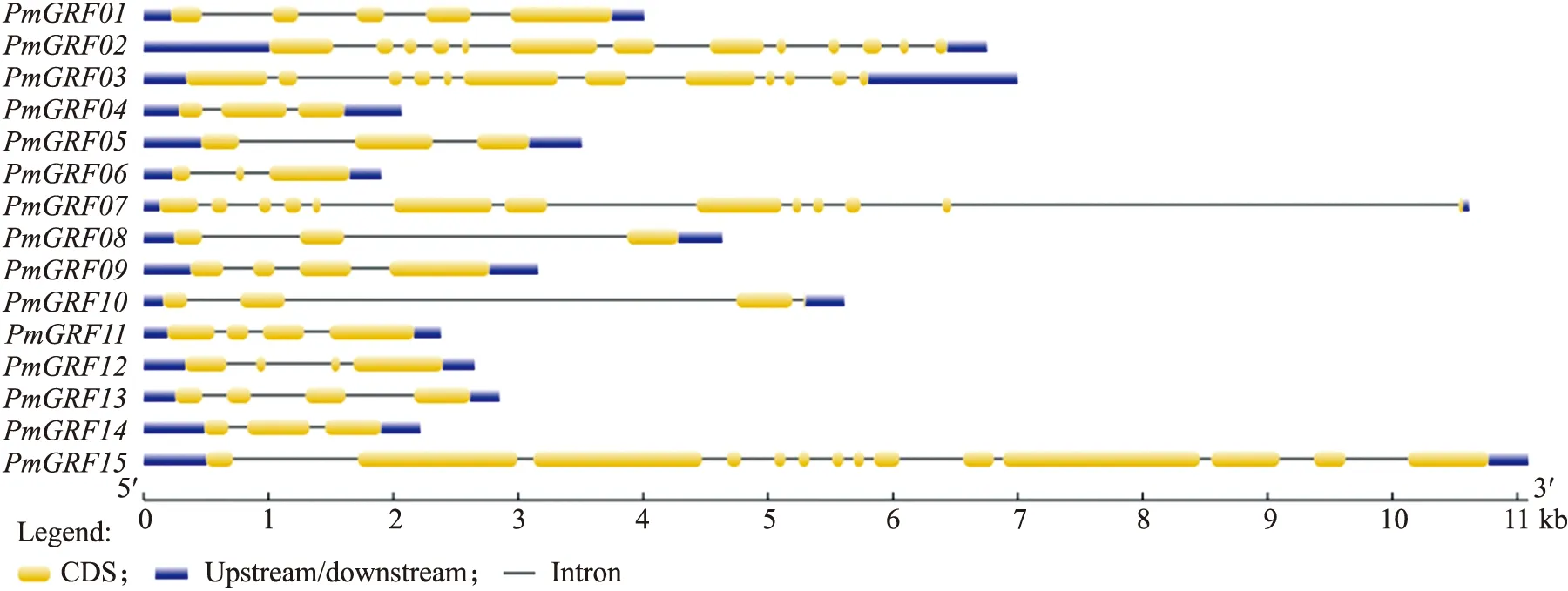
图1 梅PmGRF基因结构分析Fig.1 Structure analysis of the PmGRF genes in P.mume
如图2所示:除PmGRF06、PmGRF12外,其余PmGRF都具有motif 2,除PmGRF15外,其余PmGRF都具有motif 1,说明PmGRF家族的成员具有相似的基序类型。利用Pfam网站对motif 1和motif 2进行注释,发现motif 1属于WRC结构域,motif 2属于QLQ结构域。在Ⅶ亚家族中,PmGRF家族成员的保守基序近似,基因结构也相似,这进一步支持了系统发育树的准确性。

图2 梅PmGRF基因编码的蛋白motif分析Fig.2 The motif analysis of the proteins encoded by PmGRF genes in P.mume
2.3 PmGRF基因家族的染色体定位
由图3可见:PmGRF01、PmGRF02分布在第1条染色体上,PmGRF03位于第3条染色体,PmGRF04位于第4条染色体,第5条染色体上分布的最多,有6个,即PmGRF05、PmGRF06、PmGRF07、PmGRF08、PmGRF09、PmGRF15。第7条染色体上分布着PmGRF10、PmGRF11,而PmGRF12、PmGRF13、PmGRF14位于第8条染色体上。
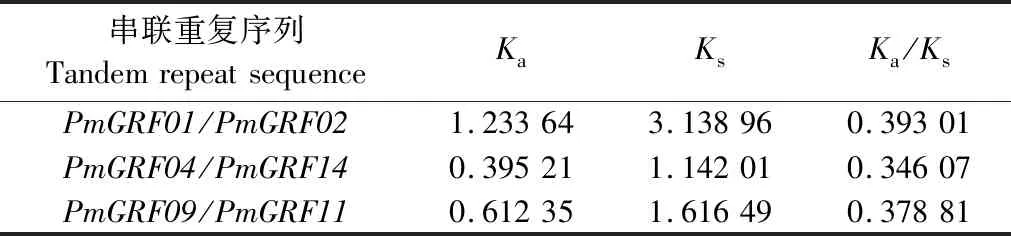
表3 PmGRF基因串联重复序列的Ka/Ks值Table 3 The Ka/Ks values of tandemly repeated sequences of PmGRF gene
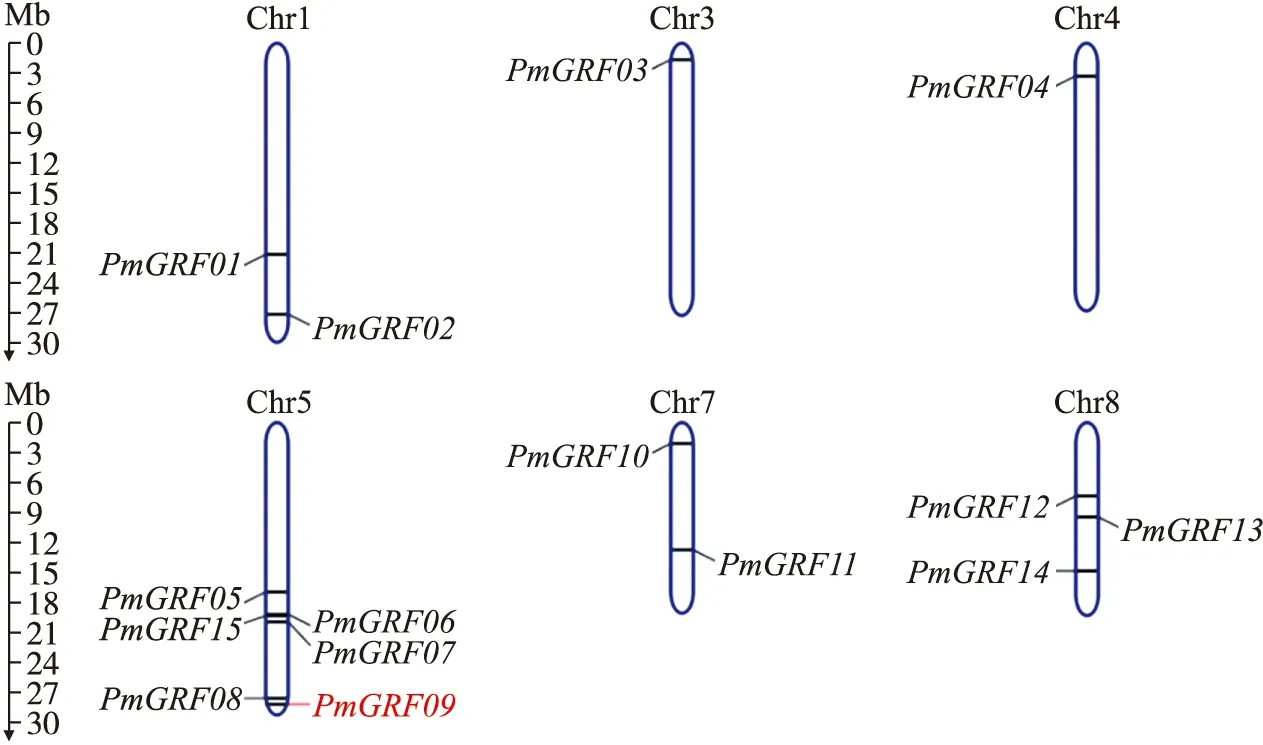
图3 梅PmGRF基因在梅6条染色体的定位分布Fig.3 Location and distribution of PmGRF genes on 6 chromosomes of P.mume蓝线代表梅的染色体。染色体编号位于每个染色体的顶部。左侧的比例尺展示染色体长度。The blue line represents the chromosome of P.mume. The chromosome number is at the top of each chromosome. The scale bar on the left shows the chromosome length.
2.4 PmGRF基因家族的共线性分析
共线性分析结果(图4)表明,3对基因(PmGRF01和PmGRF02,PmGRF09和PmGRF11,PmGRF04和PmGRF14)存在节段性重复,为了进一步分析AtGRF和PmGRF的进化关系,绘制了拟南芥和梅的基因组共线性图谱。图谱结果表明,AtGRF04和PmGRF13以及AtGRF05和PmGRF04之间存在线性关系,表示们之间具有同源性,推断可能有相似的功能。
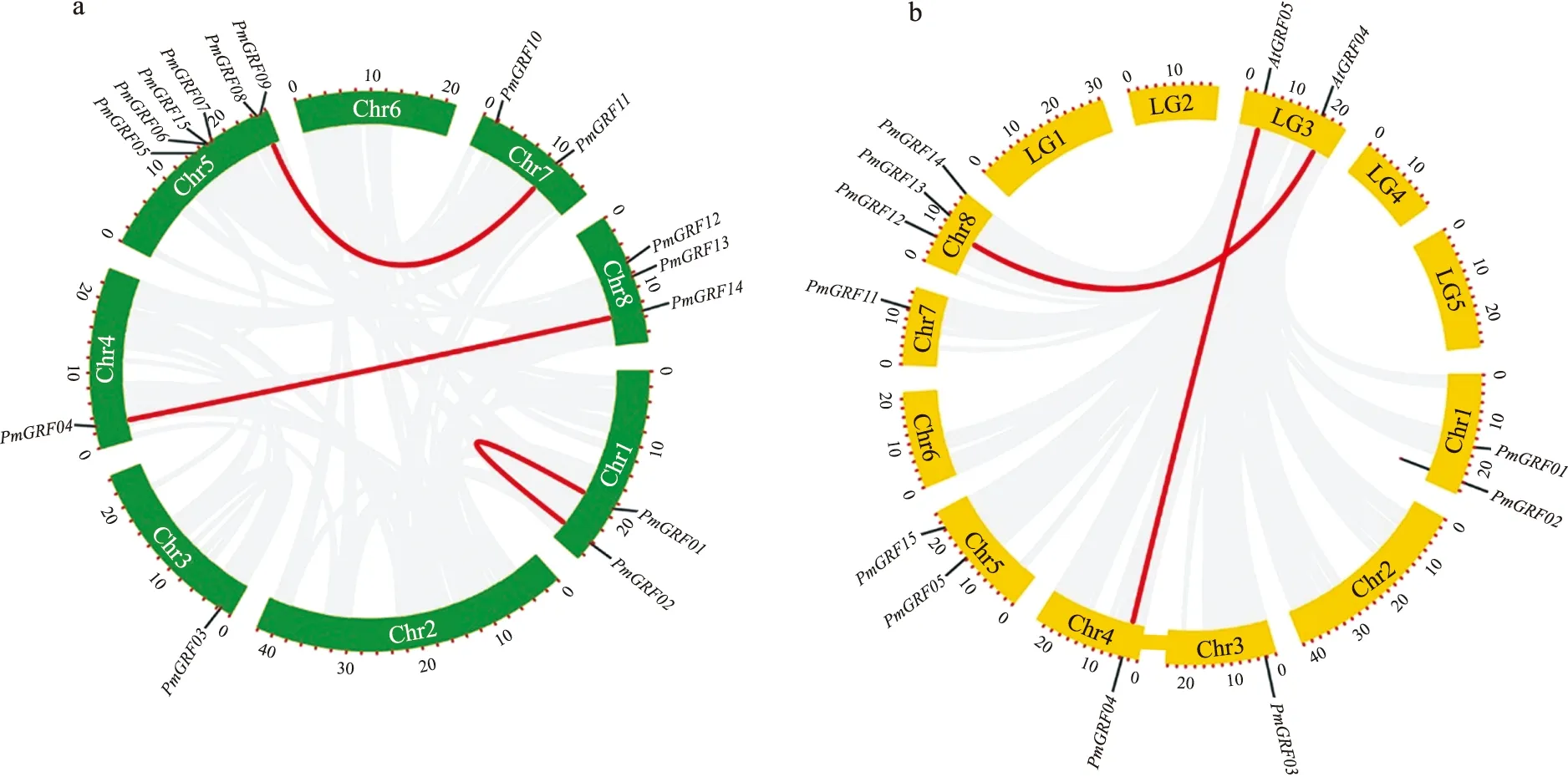
图4 PmGRF基因间共线性分析(a)以及梅和拟南芥GRF间共线性关系(b)Fig.4 The collinearity analysis between PmGRF genes(a)and collinearity between GRF genes of P.mume and Arabidopsis thaliana(b)
通过计算,结果(表3)发现所有PmGRF基因重复序列的Ka值都小于Ks值,Ka/Ks值都远小于1,说明进化过程中,基因受纯化选择,来降低碱基非同义替换带来的氨基酸变化,从而减少蛋白质构象和功能的改变。当Ka/Ks>1时,说明该基因近期正在快速进化,因此PmGRF基因进化缓慢。
2.5 PmGRF家族基因启动子的顺式作用元件分析
如图5所示:PmGRF的启动子顺式作用元件主要包括4类:生长发育相关作用元件、低温干旱等胁迫相关作用元件、光响应相关作用元件和参与激素反应的顺式调控元件。其中生长发育相关作用元件最多,光响应相关作用元件和参与激素反应的顺式调控元件次之,低温干旱等胁迫相关作用元件最少。不同基因含有不同类型的作用元件,如PmGRF03含有生长发育、脱落酸、茉莉酸甲酯、光响应、干旱等胁迫相关作用元件,PmGRF09含有光响应、生长素、水杨酸、茉莉酸甲酯、赤霉素、干旱胁迫等相关作用元件,说明PmGRF对不同的激素或环境因素起作用。
2.6 GRF家族成员进化树分析
图6为4个蔷薇科植物梅、杏、桃、扁桃和拟南芥GRF家族的系统发育分析,参照拟南芥的GRF家族分组方式,这些蛋白被分为7个亚家族(Ⅰ—Ⅶ)。其中Ⅶ亚家族包含的PmGRF的成员最多,有4个。所选的4种蔷薇科植物GRF家族中,梅与杏有较高的同源性,例如PmGRF13与PaCAB4287233.1、PmGRF09 与PaCAB4271658.1、PmGRF01与PaCAB4264059.1。而PmGRF与AtGRF家族同源性不高。其余蔷薇科植物的GRF家族同源性都较高,如杏家族与扁桃家族、扁桃家族与桃家族,说明蔷薇科植物的GRF具有高度保守的结构。
2.7 PmGRF在梅不同组织和休眠时期的表达谱分析
如图7所示:PmGRF12、PmGRF06和PmGRF09在芽中的表达丰度最高,可能与芽休眠有关,而PmGRF11在果实中表达丰度最高,可能与果实生长发育相关。转录组数据表明,PmGRF09、PmGRF07、PmGRF10、PmGRF15、PmGRF05、PmGRF14、PmGRF03和PmGRF11在生理休眠时期的转录水平达到峰值,然后表达开始下调,而PmGRF02在抑制性休眠时期的表达丰度就已达到峰值,但总体来说PmGRF家族基因在不同的休眠时期都有不同的表达谱,这说明PmGRF家族可能在休眠调控过程中发挥作用。
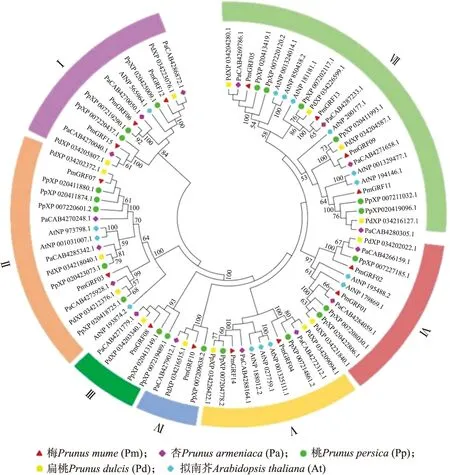
图6 梅PmGRF与其他物种GRF的系统进化树Fig.6 Integrated phylogenetic tree of GRF of P.mume and other species
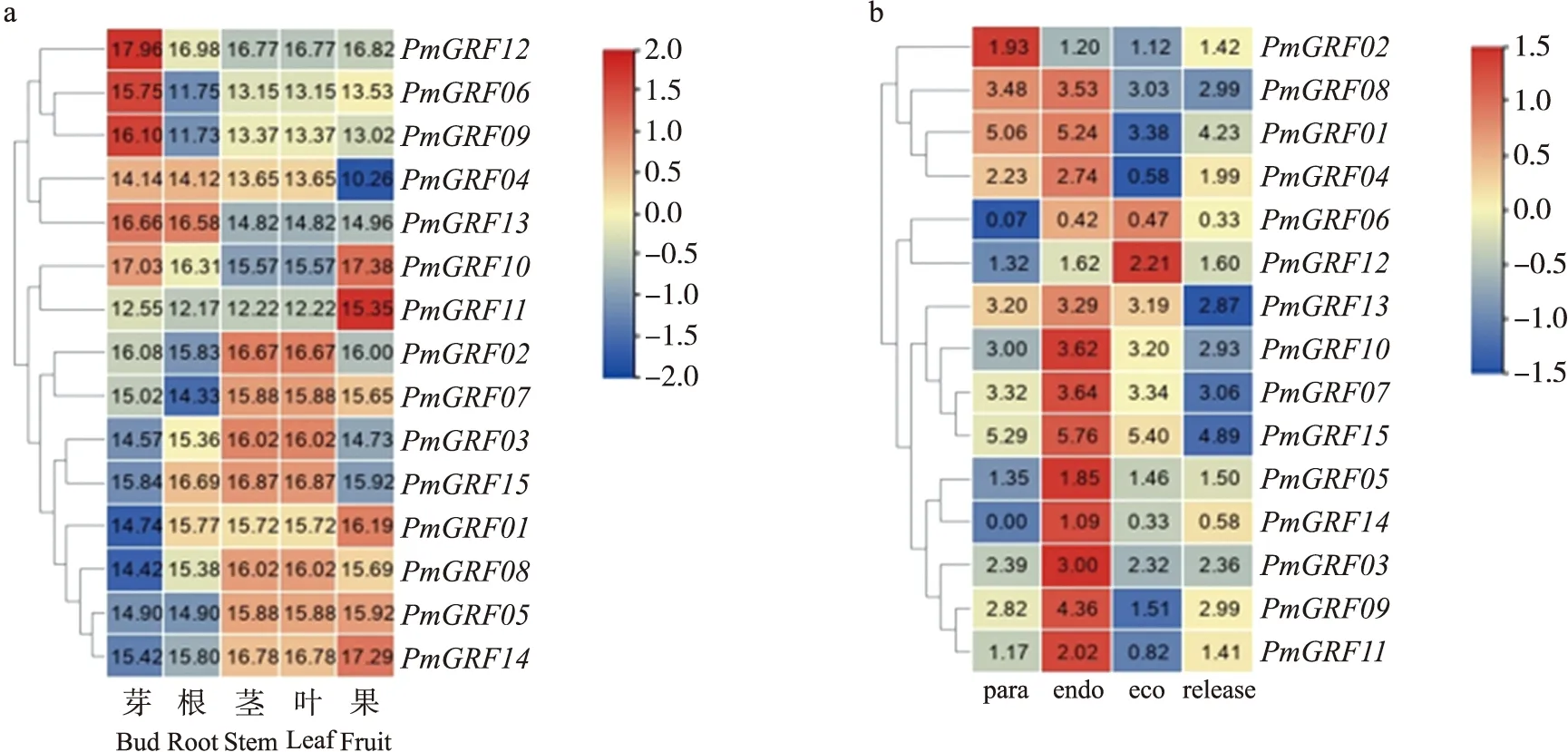
图7 PmGRF在不同组织(a)和不同休眠阶段(b)中的表达水平Fig.7 Expression levels of PmGRF in different tissues(a)and different dormancy stages(b)para.抑制性休眠Paradormancy;endo.生理休眠Endodormancy;eco.生态休眠Ecodormancy;release.休眠解除Dormancy release. 下同。The same as follows.红色代表高表达,蓝色代表低表达。Red represents higher expression,blue represents lower expression.

图8 PmGRF在4个休眠阶段的RT-qPCR表达分析Fig.8 Expression analysis of PmGRF in four dormancy stages不同字母表示在0.05水平(Tukey检验)时显著性差异。Different letters above the bars represent significant differences at 0.05 level by Tukey’s test.
2.8 PmGRF基因在不同休眠时期的表达模式分析
采用RT-qPCR分析15个PmGRF基因在不同休眠时期的表达量,结果(图8)表明,RT-qPCR分析结果和转录组数据分析结果基本一致。PmGRF的表达随着休眠时期的推进而呈现出不同的表达趋势,分为3个趋势,并且在不同的休眠时期出现峰值,趋势与转录组数据基本吻合。大多数PmGRF基因都呈先升高后下降趋势,其中,PmGRF03、PmGRF04、PmGRF05、PmGRF07、PmGRF08、PmGRF09、PmGRF10、PmGRF11、PmGRF13、PmGRF14和PmGRF15在生理休眠表达水平达到峰值而后逐渐下降,而PmGRF12在生态休眠时期达到峰值。PmGRF06在整个休眠阶段都呈上升趋势,而PmGRF01和PmGRF02呈一直下降趋势。值得注意的,大部分PmGRF基因的表达水平都在某个休眠阶段有急剧上调的趋势,这暗示PmGRF在梅休眠的整个过程中都可能起到非常重要的调节作用。
3 讨论
植物特有的GRF基因具有多方面的生理功能,涉及植物开花、叶和根的发育以及逆境胁迫下的转录调控等[12-14],但是关于梅GRF基因家族的报道还很缺乏。本研究中,从梅基因组中鉴定到15个PmGRF基因,其数量高于葡萄(8个)[15]、番茄(13个)[16]、茶树(11个)[17]、水稻(11个)[18]等植物,这可能是由于梅基因组出现广泛复制。蛋白分析发现,梅GRF基因编码的氨基酸基本都是碱性氨基酸,且多数GRF蛋白均是亲水蛋白。PmGRF 蛋白符合GRF的基本特征,即含有2个典型的结构域(WRC和QLQ),且 2个结构域均位于GRF的N端。QLQ含有大量芳香族/疏水性氨基酸,这对于QLQ作为蛋白质—蛋白质相互作用域发挥作用可能很重要[4]。而WRC结构域可能包括NLS和锌指结构域,因此它可能结合DNA而发挥作用[19]。Ka/Ks=1 时基因进化模式表现为中性选择,当Ka/Ks>1 时表现为正向选择,当Ka/Ks<1 时基因受纯化选择[20]。本研究中,所有PmGRF基因重复序列的Ka/Ks值均远小于1,说明进化过程中PmGRF受纯化选择。本研究中,亲缘关系较近的4种蔷薇科果树中,桃GRF家族成员较多(22个),其他物种的家族成员数量接近(15~16 个)。4 种蔷薇科植物GRF家族进化分析结果显示梅与杏的GRF同源性较高,表明二者在进化过程中亲缘关系较近。
本研究中,启动子区域顺式元件分析表明生长发育相关元件最多,说明PmGRF与植物生长发育密切相关。另外PmGRF基因家族还含有激素响应元件,包括脱落酸和赤霉素响应元件,说明PmGRF的表达水平可能一定程度上受ABA和GA的诱导,而GA/ABA比值与休眠解除和开花过程有密切关系[5]。在梨中,油菜素内酯(BR)可能是通过平衡ABA与GA之间的含量来促进破眠[21],因此这表明PmGRF可能与GA和ABA相关转录因子结合进而在休眠和开花过程中发挥作用。在拟南芥中,AtGRF1 和AtGRF2 也控制开花时间[5]。最近的研究表明,AtGRF1 和AtGRF3 主要作用为调节植物生长发育、防御反应以及相关的激素水平,从而帮助植物适应胁迫条件[22]。Wu等[23]在茶树转录组中鉴定得到6个GRF基因,发现其中3个成员在 ABA处理后表达水平升高,5个成员在 MeJA 处理后表达水平降低,1个成员被GA诱导显著上调,因此这进一步表明PmGRF可能响应ABA和GA进而参与休眠的调控过程。在水稻中,GRF基因在芽、未成熟叶和花芽中高表达并通过调节生长组织中的细胞增殖参与植物生长和发育[18]。而CsGRF基因家族则被推测在茶树生长组织尤其是芽叶中起重要作用[17]。本研究组织特异性表达谱分析表明PmGRF12、PmGRF06和PmGRF09在芽中的表达丰度最高,这从另一个角度说明PmGRF与芽休眠密切相关。另外,PmGRF04、PmGRF07、PmGRF08、PmGRF01、PmGRF14含有低温响应元件,预示着PmGRF有可能通过响应低温信号参与休眠过程。本研究中,PmGRF的表达随着休眠时期的推进而呈现出的表达趋势不同,例如PmGRF04、PmGRF05、PmGRF10、PmGRF11、PmGRF13、PmGRF14、PmGRF15在生理休眠时期表达水平显著增加,而当休眠解除时逐渐下降,PmGRF12在生态休眠时期时达到峰值后逐渐下降,推测它们与维持休眠有关。而PmGRF06在整个休眠阶段都呈上升的趋势,推测其与解除休眠有关。每个PmGRF基因的表达水平在某个休眠阶段都有急剧变化的趋势,这暗示PmGRF在梅休眠的整个过程中可能起到非常重要的调节作用。本研究利用生物信息学对PmGRF基因家族进行了系统鉴定,并结合表达差异推测其在梅休眠过程中起作用。后续将继续深入验证部分基因的功能,为完善梅休眠机制提供参考。
