七味铁屑方对非酒精性脂肪肝病大鼠血脂及氧化应激的影响
2022-11-19尹可欣索朗平措刘宝清
李 乔 尹可欣 孟 莹 赵 聪 陈 静 索朗平措 刘宝清
(1 北京中医药大学东方医院,北京,100078; 2 北京中医药大学,北京,100029; 3 西藏藏医药大学附属医院,拉萨,850000)
非酒精性脂肪肝病(Non-Alcoholic Fatty Liver Disease,NAFLD)是以肝小叶为病变主体,以肝细胞脂肪变性、损伤及炎症细胞浸润为主要病理特征,且无过量饮酒史的临床综合征[1]。目前针对NAFLD的治疗主要包括改善生活方式,改善代谢综合征,修复肝损伤,减肥手术,肝移植等[2-4]。减肥和运动疗法属于基础治疗,药物治疗仍然是主要治疗方式。然而,目前仍缺乏特效药物,治疗措施包括降脂、降糖、改善糖耐量、护肝、减肥药物等为主[5-6],临床上仍缺乏相关证据验证其疗效,且不良反应多[7-9]。中医药已广泛用于NAFLD、肝纤维化的治疗,与中药复方具有多环节、多靶点减轻肝脏脂质沉积、抗炎和抗纤维化的作用相关[10]。
七味铁屑(Qiwei Tiexie,QWTX)属于传统藏药,初始载于《集药利乐库》中,长期用于治疗各种急慢性肝病,表现出较好疗效。目前针对QWTX治疗NAFLD的研究提出[11],其主要是通过阻止内质网应激-脂质代谢紊乱-凋亡及炎症通路发挥作用,进而减轻肝脏脂肪变性,改善肝脏炎症程度。但对于治疗NAFLD的具体机制及相关调控因子尚未完全明确。本实验通过SD大鼠NAFLD模型,运用藏药QWTX对其进行干预,观察血脂4项及超氧化物歧化酶(Superoxide Dismutase,SOD)、丙二醛(Malondialdehyde,MDA)等指标的影响,探索其对SD大鼠NAFLD脂质代谢的作用机制。
1 材料与方法
1.1 材料
1.1.1 动物 选取SD大鼠90只,雌性,体质量200~250 g,4周龄,购自维通利华公司,动物许可证号:SCXK(京)2012-0011,无特定病原体(Specific Pathogen Free,SPF)级动物房分笼饲养,饲养SPF级动物饲料,自由饮用无菌饮用水,环境温度(20±2)℃,相对湿度45%~70%。动物实验经北京中医药大学东方医院实验动物伦理委员会审批通过(伦理审批号:201627)。
1.1.2 药物 七位铁屑胶囊(西藏金哈达药业有限公司,国药准字Z20090301),由铁屑(诃子制)、北寒水石、藏木香、木香、甘青青蓝、红花、五灵脂膏等7味药物组成,规格:0.5 g/粒。易善复胶囊(北方安万制药有限公司,国药准字H20059010),主要成分为多烯磷脂酰胆碱,规格:228 mg/粒。羧甲基纤维素钠(Sodium Carboxymethyl Cellulose,CMC-Na)(上海三浦化工有限公司,批号:20160911)。
1.1.3 试剂与仪器 SOD测试盒(南京建成生物工程研究所,批号:20180712),游离脂肪酸测试盒(南京建成生物工程研究所,批号:20180726),MDA测试盒(南京建成生物工程研究所,批号:20180706),一氧化氮检测试剂盒(南京建成生物工程研究所,批号:20180608);苏木精-伊红(Hematoxylin-eosin Staining,HE)染色剂(北京索莱宝科技有限公司,批号:20171205);倒置显微镜(Olympus公司,日本,型号:IX71);超薄切片机(Leica仪器有限公司,奥地利,型号:UC6);台式高速低温离心机(Heraeus公司,德国,型号:5427R)。
1.2 方法
1.2.1 分组与模型制备 90只SD雌性大鼠,适应性喂养1周后,按体质量层次随机选取15只作为正常组,予以普通饲料喂养,余下75只以88%普通饲料+10%猪油+2%胆固醇的高脂饲料喂养诱导造模,并将其分为模型组,西药组,QWTX高剂量组,QWTX中剂量组,QWTX低剂量组,每组15只。实验期间各组大鼠自由饮水和进食,喂养持续9周。
1.2.2 给药方法 喂养3周后,各观察组给予相应药物,用药剂量按标准体质量动物剂量折算表算出:QWTX高剂量组、QWTX中剂量组、QWTX低剂量组分别按180 mg/(kg·d)、90 mg/(kg·d)、30 mg/(kg·d)灌胃,易善复为123 mg/(kg·d)进行灌胃,正常组和模型组予以CMC-Na进行干预,每次灌胃量10 mL,持续6周,每周称量体质量2次,调整相应灌胃剂量。
1.2.3 检测指标与方法 第9周末,动物禁食水12 h后,腹腔内注射10%的水合氯醛0.30 mL/100 g予以麻醉,麻醉成功后开腹,进行下腔静脉采血,取3 mL全血室温静置15 min,3 000 r/min,离心半径10 cm,离心30 min分离血清,检测总胆固醇(Total Cholesterol,TC)、三酰甘油(Triglyceride,TG);低密度脂蛋白(Low-density Lipoprotein,LDL),高密度脂蛋白(High-density Lipoprotein,HDL);游离脂肪酸(Free Fatty Acid,FFA)、一氧化氮(Nitric Oxide,NO)。迅速取出肝脏并称重,取左叶距边缘5 mm处取1.0 cm×1.0 cm×0.5 cm组织,置于40 g/L甲醛固定3 h后,梯度乙醇逐级脱水,石蜡包埋,冷冻,切片厚5 μm,苏木精-伊红(Hematoxylin Eosin,HE)染色观察肝细胞脂肪变程度和范围,对肝脏脂肪变性程度及炎症反应程度进行分级、评分,NAFLD的病理组织学诊断参考2010年中国肝脏病学分会脂肪肝和酒精性肝病学组修订的《非酒精性脂肪性肝病诊疗指南》。再取肝右叶,4 ℃条件下用生理盐水制成100 g/L的肝组织匀浆,2 000 r/min,离心半径13 cm,离心10 min后取上清液,分别采用相关试剂盒检测SOD、MDA。
2 结果
2.1 9周各组大鼠肝脏外观及组织病理学改变比较 正常组大鼠肝脏表面光滑,色泽鲜红,边缘锐利。模型组肝脏较正常组明显肿大,成黄色,边缘变钝,切面油腻感;西药组与QWTX高剂量组、QWTX中剂量组、QWTX低剂量组大鼠肝脏色泽浅黄,质地、体积均介于正常组与模型组之间,肉眼观察差别不明显。HE染色正常组大鼠肝细胞形态正常,无脂肪变形及炎症细胞浸润,模型组大鼠肝脏的病理形态学表现为肝细胞体积增大,胞质内可见以大泡型为主的混合型脂滴,同时肝组织可见散在炎症细胞浸润,未见明显纤维结缔组织增生。西药组和QWTX高剂量组、QWTX中剂量组、QWTX低剂量组大鼠肝组织病变较模型组有不同程度的改善,肝细胞内脂滴减少,肝细胞脂肪变程度及炎症细胞浸润减轻。见图1。
2.2 各组9周时SD大鼠血清脂类指标的变化 9周时,与模型组比较,西药组、QWTX高剂量组、QWTX中剂量组、QWTX低剂量组血清TC、TG、HDL、LDL的差异有统计学意义(P<0.05),指标变化与QWTX高剂量组、QWTX中剂量组、QWTX低剂量组剂量存在相关性。见表1。
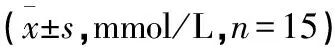
表1 9周各组大鼠血脂指标的变化
2.3 各组9周时SD大鼠SOD、MDA、NO、FFA比较 9周时,西药组和QWTX高剂量组、QWTX中剂量组、QWTX低剂量组与模型组比较,差异有统计学意义(P<0.05)。MDA、SOD指标变化与QWTX高剂量组、QWTX中剂量组、QWTX低剂量组存在剂量相关性。见表2。
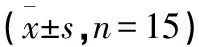
表2 9周各组SD大鼠SOD、MDA(肝脏),NO、FFA(血清)
3 讨论
中医认为脂肪肝归属于“胁痛”“痰浊”“肝癖”等病症范畴,而藏医将脂肪肝即“脂肪过盛病”归属于“本位木布病”范畴,由于过食肥甘厚味或饮酒过度,体内三因失衡,“培根”和“赤巴”功能紊乱,其中以“培根”为主导。治疗应以养血平肝、活血化瘀、清血化毒、调和三因为主。QWTX是根据传统藏医药防治理论“培根捏及、赤巴觉及、龙酶年姆”而研制的藏药复方制剂,其中铁屑(诃子制,占97%)解肝毒、消浮肿,而诃子有降脂功效[12];红花活血止痛[13];甘青青蓝、北寒水石(奶制)解肝胃热[14];木香、五灵脂膏行气止痛,又配伍具有健脾和胃、调气解郁、止痛的藏木香,达到行气活血止痛的效果等功效。QWTX在防治脂肪肝方面有较为显著的疗效,其中包括NAFLD,但机制及其相关调控因子尚不明确。
随着肥胖症和糖尿病发病率的增加,NAFLD的发病率和患病率在全球范围内呈上升趋势[2],为普通人群的24%[15]。NAFLD的临床表现和组织学呈多样性,包含单纯性脂肪肝、非酒精性脂肪性肝炎(Non-Alcoholic Steatohepalitis,NASH)、NASH肝纤维化和NASH肝硬化和NASH相关性肝细胞癌[16],其中NASH相关性死亡率更高,成为肝移植的最主要原因[17]。NAFLD的发病机制未完全明确。目前多认为胰岛素抵抗(Insulin Resistance,IR)引起FFA产生增多,导致肝细胞脂质过度累积,脂肪酸β氧化超载,活性氧(Reactive Oxygen Species,ROS)大量产生,诱发氧化应激以及氧反应产物的发生,引起肝脏脂毒性;同时,脂肪变性也促进IR的发生,形成恶性循环,加重肝损伤,促进纤维化的生成[18]。
经过9周造模后观察到大鼠肝脏外观形态、病理组织学、血脂、FFA等指标证明大鼠NAFLD已形成。尤其模型组病理观察到典型的脂肪变性和炎症细胞,未见明显纤维结缔组织增生,表明该模型属于NASH。QWTX可降低肝脏组织脂肪含量,抑制NAFLD大鼠肝脏脂质沉积,并且随着药物剂量的提高,作用越明显;大鼠血清血脂较模型组有不同程度改善,差异有统计学意义(P<0.05)。通过对组方药物的药理研究,其中诃子的主要有效药物成分是三萜类化合物、酚酸类[19];藏木香、木香为黄酮类、木香内酯[20-21];甘青青蓝为黄酮类、三萜类化合物[22]。QWTX有效成分的药理作用是以抗氧化、清除自由基、抑制脂质氧化应激、降脂及抗炎为主,其中三萜类化合物对阻止氧化应激发生发挥主要作用[23]。
FFA的增加被认为是NAFLD重要起始因子,过量的FFA通过诱导ROS释放导致脂肪毒性,发生氧化应激、炎症、细胞凋亡和肝损伤,促进肝纤维化形成[24-26]。本实验模型组大鼠TG、TC、LDL-C和FFA含量均显著增高,而HDL-C显著降低,表明脂质代谢紊乱存在。QWTX能降低TG、TC、LDL-C和FFA含量,升高血清HDL-C,提示有调整脂质代谢紊乱的治疗作用。MDA是脂质过氧化最重要的产物之一,其数值高低可反映脂质过氧化反应的程度[27],可以间接地反映肝脏自由基损伤的程度。SOD是人体重要的抗氧化酶,是机体内天然存在的超氧自由基清除因子,可以抑制NAFLD发病过程中的过氧化反应[28]。本实验模型组大鼠肝脏SOD活性降低,而MDA含量增加,说明在NAFLD大鼠中抗氧化及对自由基清除能力下降,导致脂质过氧化损伤增强。QWTX可升高肝脏SOD活性,降低MDA含量,提示其通过调节自由基代谢平衡防护机体脂质过氧化。NO是在一氧化氮合酶(Nitric Oxide Synthase,NOS)的作用下形成,其在NAFLD的发病过程中的作用好坏与其浓度及肝脏的微环境关系密切[29]。短暂产生少量的NO有保护肝脏细胞免受氧化损伤及代谢炎症应激作用。长期产生大量的NO与氧自由基生成活性氮氧化合物(Reactive Nitrogen Oxide Species,RNOS),破坏线粒体结构,启动脂质过氧化[29-32],同时又可促进肿瘤坏死因子-α(Tumor Necrosis Factor,TNF-α)的产生,加重肝损伤。本实验模型组大鼠血清NO水平低于正常组,差异有统计学意义(P<0.01),提示NO可能抑制参与NAFLD早期发病机制的所有关键过程,脂肪乳剂可降低血清NO水平。QWTX与多烯磷脂酰胆碱一样能显著提高血清NO水平,进而与脂质过氧化物相结合,发挥抗氧化作用,减轻肝细胞的损伤和坏死程度,降低炎症介质的水平,并改善大多数肝功能指标[33]。
综上所述,QWTX作用于NAFLD大鼠,通过其有效药物成分发挥作用,增强肝脏SOD活性,减少肝脏MDA含量,提高大鼠血清NO含量,有效地抑制脂质过氧化反应,从而改善脂代谢水平降低FFA,进而减轻肝损伤,延缓肝脏纤维化进程,最终发挥治疗NAFLD的作用。
