水泡性口炎病毒通过基质金属蛋白调控结肠癌SW480细胞增殖、迁移和侵袭
2022-11-19姚梦玮李玉迁方小涵
李 戈 姚梦玮 李玉迁 李 胜 方小涵 魏 洪▲
1.贵州医科大学基础医学院 微生物学教研室 感染与免疫学实验室,贵州 贵阳 550000;
2.贵州医科大学临床医学院,贵州 贵阳 550000
结直肠癌(colorectal cancer,CRC)是最常见的消化系统肿瘤之一,全球肿瘤发病率位居第三位[1],多数结直肠癌患者确诊时已进入中晚期进而发生结直肠癌的转移和侵袭[2]。目前结直肠癌的治疗手段主要是手术切除、放疗和化疗[3],虽然不断有新的治疗方案[4],但其远期生存率仍较低。因此,迫切需要新的方式来治疗结直肠癌转移和侵袭。水泡性口炎病毒(vesicular stomatitis virus,VSV)能够选择性杀灭肿瘤细胞,但不影响正常细胞,是一种很有前途的治疗癌症的新型溶瘤病毒[5]。VSV 可治疗小鼠结直肠癌转移[6]和抑制卵巢癌细胞的侵袭和迁移[7]。国内外少有报道VSV 对结直肠癌细胞迁移和侵袭的影响及机制。因此,本研究探讨VSV 对结肠癌SW480 细胞增殖、迁移和侵袭的影响,并探究其可能作用机制。
1 材料与方法
1.1 材料与仪器
人结肠癌细胞株SW480、绿猴肾上皮细胞Vero、VSV(贵州医科大学基础医学院感染与免疫学教研室);抗MMP-2 抗体(Proteintech 公司);抗MMP-9 抗体(SAB 公司);抗GAPDH 抗体(Abcam公司);二抗(兔抗,普美生物公司);二甲基亚砜、胎牛血清(四季青公司);高糖DMEM、青霉素链霉素、胰蛋白酶EDTA(美国Gibco 公司);PCR 荧光定量试剂盒、逆转录试剂盒(北京康为世纪生物科技有限公司);CCK-8 试剂盒(同仁化学研究所);Tanswell 小室、Matrigel 基质胶(美国Corning 公司);4℃台式离心机(丹麦LaboGene 公司);酶标仪(美国BioTek 公司);倒置显微镜、Real time PCR 仪、多功能凝胶成像系统(美国Bio-Rad 公司)。
1.2 方法
1.2.1 细胞培养 细胞在含有10%胎牛血清、10×青链霉素的DMEM 培养基中,置于37℃,5%CO2培养箱中培养。
1.2.2 实验分组 细胞增殖实验按照VSV 浓度(MOI=0.01、0.1、1、10、100) 和 时 间(24、48 h)设置分组;其余实验分为3 组,即对照组、VSV(MOI=0.01、0.1)处理组。每组设置6 个复孔,所有实验重复3 次。
1.2.3 VSV 增殖、浓缩 培养Vero 细胞,感染VSV 1 周后收集病毒。采用聚乙二醇法浓缩病毒,离心后弃上清,以无血清的DMEM 重悬沉淀,分装后放入-80℃冰箱保存。滴度测定:按Reed-Muench 法计算TCID50。
1.2.4 CCK-8 法检测细胞增殖情况 采用CCK-8法检测VSV 对SW480 细胞的增殖抑制作用,SW480 细胞接种于96 孔板,待细胞贴壁后,VSV 处理组加入不同浓度的VSV,对照组加入等量的培养液。分别培养24、48 h,每孔加入10μl CCK-8 检测液,在培养箱中孵育2 h,在490 nm 处检测吸光度(A)值,每组6 个复孔计算平均值。
1.2.5 细胞划痕愈合实验 在6 孔板中接种2 ml SW480 细胞悬液(5×105个/孔),当细胞生长铺满孔底到90%,用枪头垂直与细胞板底部划线,PBS冲洗脱落细胞,用VSV 处理细胞,并设置阴性对照组,培养箱中培养,0、24、48 h 时在倒置显微镜下观察并拍照,用Image J 软件进行分析。
1.2.6 Transwell 实验 使用24 孔板和8μm 孔径的聚对苯二甲酸乙二醇酯过滤膜插入物来测定细胞的侵袭能力。小室预先涂有Matrix,5×104个细胞加入上室,20%胎牛血清的DMEM 充入下室。下室的入侵细胞培养24 h 后用甲醇固定20 min,0.1%结晶紫染色,倒置显微镜下计数。
1.2.7 实时荧光定量聚合酶反应(qPCR) 总RNA 从VSV 处 理 的SW480 细 胞 中 按 照RNA提取试剂盒提取。采用cDNA 合成试剂盒逆转 录,以GAPDH 为 内 参 对 照,采 用2-ΔΔCT计算相对mRNA 表达水平。MMP-2 引物序列上游5’-TTGACGGTAAGGACGGACTC-3’, 下 游5’-GGCGTTCCCATACTTCACAC-3’;MMP-9 引物序列上游5’-GCCACTACTGTGCCTTTGAGTC-3’,下游5’-CCCTCAGAGAATCGCCAGTACT-3’;GAPDH引物序列上游5’-ACCCAGAAGACTGTGGATGG-3’,下游5’-TCAGCTCAGGGATGACCTTG-3’。
1.2.8 Western blot 检 测 蛋 白 表 达 VSV 处 理SW480细胞,加入细胞裂解液混匀,在冰上裂解1 h,4℃、12 000 r/min 离心40 min,取上清,BCA 蛋白定量试剂盒检测蛋白浓度。取等量蛋白上样,进行聚丙烯酰胺凝胶电泳,转移至聚偏二氟乙烯(PVDE)膜,5%脱脂奶粉封闭目的条带PVDF 膜2 h,PBST洗膜3 次;加入一抗4℃孵育过夜,PBST 洗膜3 次;加二抗室温孵育1 h,PBST 洗膜3 次;ECL 试剂显色。以GAPDH 为内参蛋白,应用Image J 对灰度值进行统计分析。
1.3 统计学分析
采用SPSS 20.0 统计学软件进行数据处理,计量资料以均数±标准差(±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,以P< 0.05 为差异有统计学意义。
2 结果
2.1 VSV扩增及滴度测定
VSV 感染Vero 细胞后,出现细胞变圆、脱落现 象。病 毒TCID50 约 为1×107.386,PFUs 约 为1.7×107pfu/ml。
2.2 VSV对SW480细胞增殖能力的影响
不 同 浓 度(MOI=100、10、1、0.1、0.01)的VSV在24、48 h 作用SW480,24、48 h 细胞增殖率见表1、图1,VSV 处理组细胞增殖率低于对照组,差异有统计学意义(P< 0.05)。
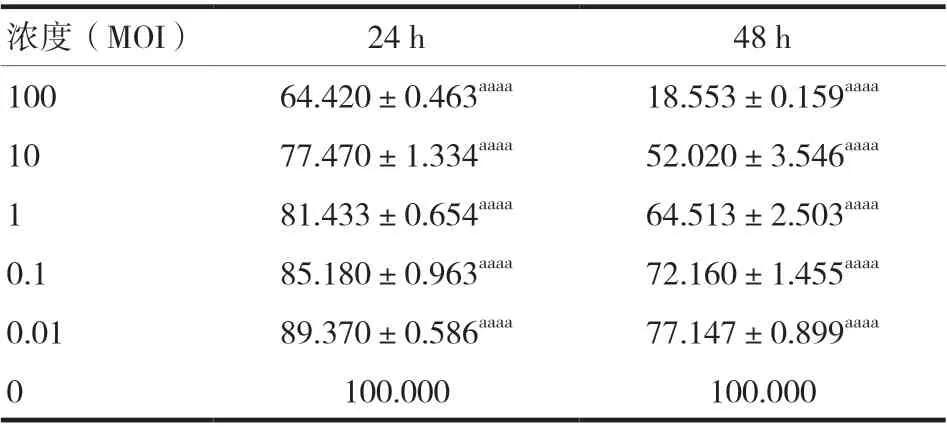
表1 结肠癌SW480细胞增殖率的检测(%,x ± s)
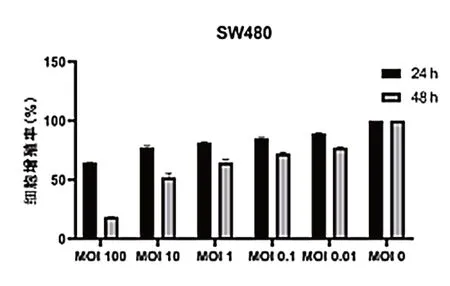
图1 VSV 对结肠癌SW480 细胞增殖能力的影响
2.3 VSV对SW480细胞迁移能力的影响
划痕实验显示,24 h SW480 细胞对照组迁移率为(15.813±0.368)%,MOI 为0.01 和0.1 的VSV处理SW480 细胞迁移率分别为(5.873±0.393)%和(2.530±0.345)%(t=7.912,P< 0.001);48 h对照组迁移率为(21.000±0.380)%,MOI=0.01、0.1 的VSV 处 理SW480 细 胞 迁 移 率 分 别 为(8.950±0.552)% 和(7.772±0.290)%(t=20.180,P< 0.001),VSV 处理组细胞迁移率低于对照组,差异有统计学意义(P< 0.05),见图2。Transwell 实验显示,对照组和VSV 处理组细胞迁移数分别为(375.000±13.233)和(61.560±2.520)个/HP,VSV处理组细胞迁移数低于对照组,差异有统计学意义(t=8.060,P=0.001),见图3。
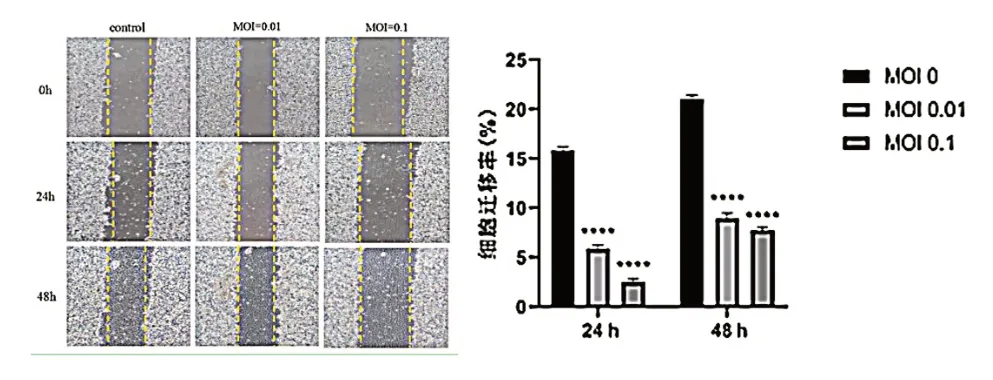
图2 VSV 对SW480 细胞迁移能力的影响(100×)
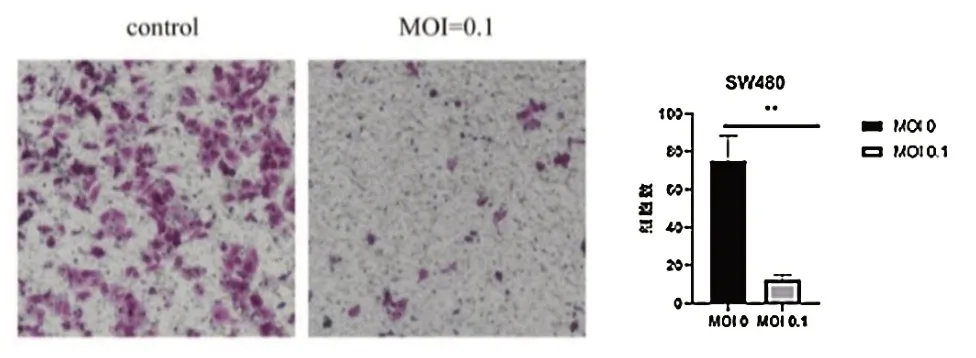
图3 VSV 对SW480 细胞迁移能力的影响(结晶紫染色200×)
2.4 VSV对SW480细胞侵袭能力的影响
Transwell 实验结果示,对照组和VSV 处理组(MOI=0.1)侵袭细胞数分别为(71.650±0.584)和(16.651±0.580)个/HP,VSV 处理组(MOI=0.1)细胞侵袭数低于对照组,差异有统计学意义(t=23.330,P< 0.0001),见图4。
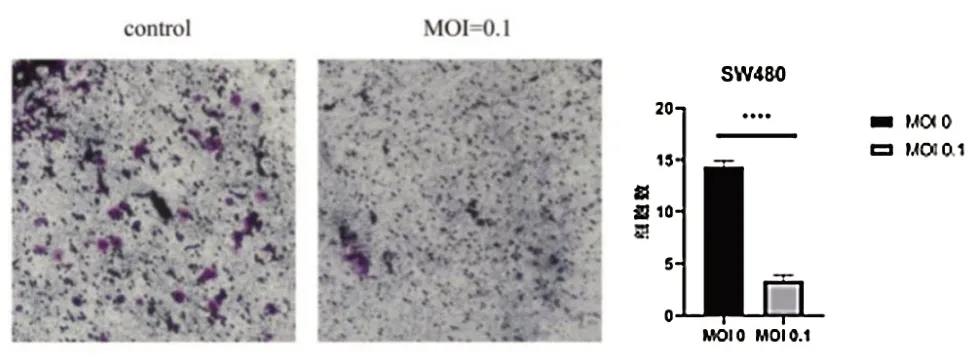
图4 VSV 对SW480 细胞侵袭能力的影响(结晶紫染色200×)
2.5 VSV对SW480细胞中MMP-9表达的影响
qPCR 结 果 显 示,SW480 细 胞 对 照 组MMP-2 mRNA 表达量为(1.000±0.090),MOI=0.01 的VSV 处理组细胞的MMP-2 mRNA 表达量为(1.055±0.119),与对照组相比差异无统计学意义(P> 0.05),MOI=0.1的VSV 处理组细胞的MMP-2 mRNA 表达量为(1.880±0.100),VSV处理组MMP-2表达量高于对照组,差异有统计学意义(P< 0.05);对照组MMP-9 mRNA 表达 量 为(1.020±0.154),MOI=0.01 的VSV 处 理 组细胞的MMP-9 mRNA 表达量为(0.832±0.153),与对照组相比差异无统计学意义(P> 0.05),MOI=0.1的VSV 处理组细胞的MMP-9 mRNA 表达量为(0.610±0.090),VSV 处理组MMP-9 表达量低于对照组,差异有统计学意义(P< 0.05),见图5。
Western blot 结 果 显 示,SW480 细 胞 对 照组MMP-2 蛋 白 表 达 水 平 为(0.847±0.022),MOI=0.01 的VSV 处理组MMP-2 蛋白表达水平为(0.980±0.025),MOI=0.1 的VSV 处理组MMP-2 蛋白表达水平为(1.338±0.034),VSV 处理组MMP-2表达量高于对照组,差异有统计学意义(P< 0.05),见图5;SW480 细胞对照组MMP-9 蛋白表达水平为(0.777±0.020),MOI=0.01 的VSV 处理组MMP-9蛋白表达水平为(0.473±0.012),MOI=0.1 的VSV处理组MMP-9 蛋白表达水平为(0.497±0.013),VSV 处理组MMP-9 表达量低于对照组,差异有统计学意义(P< 0.05),见图6。
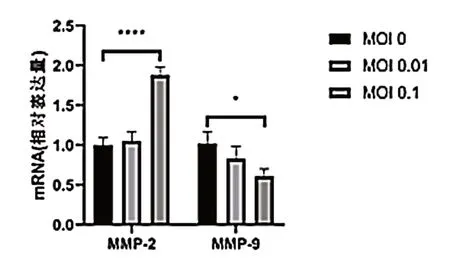
图5 VSV 对SW480 细胞中基质金属蛋白mRNA 表达的影响
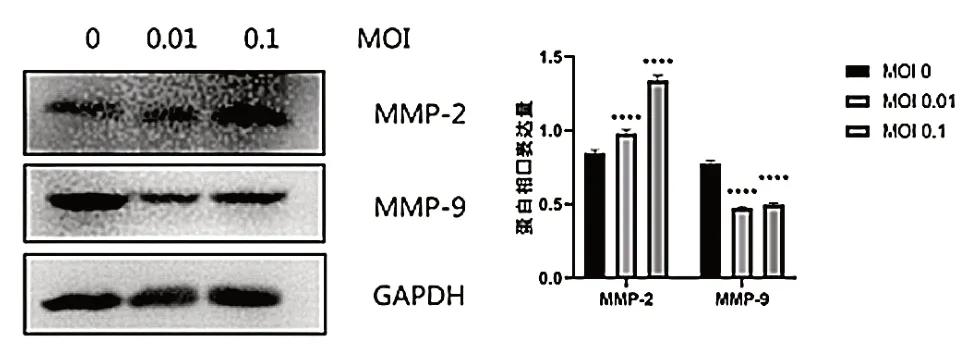
图6 VSV 对SW480 细胞中基质金属蛋白的蛋白表达的影响
3 讨论
CRC 是一种全球发病率较高的疾病,在癌症病死中排名第五[8-9]。随着肿瘤阶段的进展,转移的发生使CRC 的病死率增加[10]。一种新型的生物治疗方法溶瘤病毒现已进入临床研究[11-12]。已有研究表明VSV 可逆转卵巢癌VEGF-D 的过表达,抑制MMP-2 表达来抑制卵巢癌的转移[7],还可治疗小鼠肝结直肠癌转移[6]。rVSV-NDV/F(L289A)能够治疗多病灶的肝转移和肺转移CRC 的老鼠模型[13],但VSV 对结直肠癌迁移和侵袭影响的作用机制现在还不清楚。本研究对不同浓度VSV 的抗肿瘤作用进行了评价,结果表明VSV 具有抑制结肠癌SW480 细胞增殖、迁移和侵袭的作用。
基质金属蛋白是锌依赖的内肽酶家族,可以降解细胞外基质成分,破坏癌细胞侵袭的组织学屏障[14]。在目前发现的所有MMP 蛋白中,MMP-2和MMP-9 被认为是参与肿瘤迁移和侵袭的最重要成员[15]。MMP-2 和MMP-9 的高表达在结直肠癌中较为常见[16],预示着结直肠癌患者预后不良[17]。PI3K/Akt 信 号 通 路 是MMP-2 和MMP-9的重要上游调控因子[18]。激活PI3K/Akt 通过上调MMP-2 或MMP-9 表达促进CRC 侵袭转移[19]。研究证明NDV D90 通过抑制MMP-2 和MMP-9的表达和活性,显著抑制了口腔鳞状癌细胞的迁移和侵袭[20]。但研究VSV 作用结直肠癌细胞后MMP-2 和MMP-9 表达的报道较少。为评估VSV对结直肠癌细胞的抑制作用与MMP-2、MMP-9 的关系,本研究采用qPCR 和蛋白质印迹法检测VSV对SW480 细胞中MMP-2、MMP-9 表达的影响,结果显示VSV 上调SW480 细胞中MMP-2 的表达和下调MMP-9 的表达。已有研究报道VSV 的基质蛋白可逆转VEGF-D 增强卵巢癌细胞侵袭、迁移、淋巴结转移和淋巴管生成,抑制肿瘤生长,进而抑制MMP-2 的表达[7]。溶瘤病毒(VSV-M51R)结合MMP-3 抑制剂可治疗小鼠结肠癌[21]。本研究SW480 细胞中MMP-2 的表达,与文献报道的VSV 在卵巢癌细胞中结果相反[7],因此,VSV 可能通过上调MMP-2 和下调MMP-9 的表达,抑制结肠癌细胞的迁移,从而发挥抗肿瘤作用。
综上,VSV 能够抑制结肠癌SW480 细胞的迁移和侵袭,其内部分子机制可能是VSV 通过调控基质金属蛋白的表达和活性来抑制结直肠癌细胞的迁移和侵袭,猜想可能是通过PI3K/Akt 通路来下调MMP-9 的表达的,之后再进一步进行实验来研究其具体机制。VSV 可能是一种有前途的策略,为转移性结直肠癌的治疗提供了一个新的思路。
