IL-6/JAK2/STAT3信号通路对胃癌增殖能力的影响*
2022-11-18黄亚林牛世伟龚红霞曾元丁李菲菲
黄亚林 牛世伟 龚红霞 苏 韫 张 晗 曾元丁 李菲菲
(1.甘肃省靖远县人民医院,白银 730600)(2.甘肃中医药大学基础医学院,兰州 730000)(3. 甘肃省高校重大疾病分子医学与中医药防治研究省级重点实验室,兰州 730000)(4.甘肃中医药大学公共卫生学院,兰州 730000)
胃癌是消化道常见的恶性肿瘤之一,是造成我国癌症死亡的第二大原因[1]。胃癌的典型特征是无限的增殖和异常凋亡[2]。癌细胞的增殖同肿瘤的发生、发展以及临床治疗密切相关。大量研究表明,多条信号通路与胃癌的发生发展关系密切,如表皮生长因子受体(epidermal growth factor receptor,EGFR)通路[3]、IL-6/JAK/STAT通路[4]、PI3K/Akt/mTOR通路[5]、NF-κB/Bcl-2通路[6]和Shh通路[7]等。其中IL-6/JAK2(Janus proteintyrosine kinase 2)/STAT3(signal transducer and activator of transcription 3)信号通路在胃肠道肿瘤发生过程中高度特异性激活,从促炎、促增殖、促血管生成、抗凋亡、免疫调节等多个方面促进肿瘤发生发展。阻断该通路可能为胃癌的治疗提供新的思路。因此,本实验选用通路特异性阻断剂阻断该通路关键靶点,验证通路下游靶点蛋白的表达,探讨IL-6/JAK2/STAT3信号通路在胃癌发生发展中的作用。
1 材料和方法
1.1 动物及细胞
SPF级KM小鼠48只,雌雄各半,体质量(20.0±2.0)g,由甘肃中医药大学SPF级动物实验中心提供。动物合格证号【SCXK(甘)2020-0001】。本实验由甘肃中医药大学伦理委员会审查,伦理审批号:2020-283。MFC小鼠胃癌细胞株,批号为PNS-MC-20【武汉普诺赛生命科技有限公司】。
1.2 主要试剂
AG490和Stattic(Selleck生物科技有限公司);RPMI 1640 培养液(Gibco公司);胎牛血清(杭州四季青生物工程材料有限公司);Trizol(Ambion公司);RT-qPCR试剂盒(上海翊圣生物有限公司);免疫组化(IHC)试剂盒(北京中杉金桥生物技术有限公司);兔抗鼠IL-6(GenTex公司);p-JAK2、p-STAT3、c-Myc和Cyclin D1抗体(Immunoway公司)。所用引物由生工生物工程(上海)股份有限公司合成。
1.3 方法
1.3.1细胞培养及胃癌荷瘤小鼠模型的建立:小鼠MFC胃癌细胞用含10%胎牛血清的RPMI 1640完全培养基,常规培养于37 ℃,5%CO2孵育箱中。将MFC细胞培养至对数生长期并将浓度调整为1×107个/mL,小鼠右侧腋下常规消毒后,接种细胞悬浮液0.2 mL/只,建立胃癌荷瘤小鼠模型。接种5~7 d可触及结节,结节直径长至大于5 mm时表示造模成功。
1.3.2动物分组及给药:根据随机数字表法将造模成功的胃癌荷瘤小鼠随机分为模型组、AG490阻断剂组和Stattic阻断剂组,每组10只。根据小鼠和人体表面面积比值0.002 6计算小鼠给药剂量,每天AG490为8 mg/kg,Stattic为5 mg/kg。另选12只健康小鼠作为空白组,小鼠的灌胃体积和腹腔注射体积为0.2 mL,给药周期为14 d,模型组和空白组给予等体积的0.9%氯化钠溶液。实验过程中,剔除肿瘤直径小于5 mm的小鼠4只,腹腔注射给药时意外死亡2只。
1.3.3测定瘤体质量及计算抑瘤率:末次给药24 h后,颈椎脱臼法牺牲小鼠,摘除瘤体组织称重并记录。抑瘤率=(模型组平均瘤质量-药物组平均瘤质量)/模型组平均瘤质量×100%。
1.3.4ELISA检测IL-6含量:小鼠眼球取血,分离血清,-80 ℃冰箱保存。实验过程按照ELISA试剂盒说明书检测血清中IL-6的含量。
1.3.5免疫组化染色观察各组小鼠瘤体组织中蛋白表达情况:取甲醛固定的组织,石蜡包埋,切片后二甲苯中脱蜡,梯度乙醇脱去二甲苯,3% H2O2甲醇消除内源性过氧化氢酶,然后用柠檬酸钠修复液对其进行高温修复,加入相应一抗工作液于4 ℃,冰箱保存,PBS清洗后加入二抗,37 ℃孵育2 h。DAB显色后用苏木精染液复染,乙醇二甲苯脱水后透明,最后封片于显微镜下观察拍片。Image J软件进行图像分析。
1.3.6RT-qPCR定量检测瘤体组织中各基因的表达:取瘤体组织100 mg,Trizol法提取总RNA;经反转录试剂盒将mRNA反转录为cDNA,在-80 ℃冰箱中保存。采用SYBR法在CFX96荧光定量PCR仪中检测各mRNA表达,20 μL反应体系,反应条件为95 ℃、5 min,95 ℃、10 s,55 ℃、20 s,72 ℃、20 s,40个循环。以GAPDH为内参,通过 2-△△Ct法计算目的基因的相对表达量。GAPDH的正向引物序列为5′-gTgCTgAgTATgTCgTggAgTC-3′;反向序列为5′-ACAgTCTTTCTgggTggCAgT-3′;IL-6的正向引物序列为5′-CATCCAgTTgCC TTCTTg-3′,反向序列为5′-TATCCAgTTTggTAg CATCC-3′;JAK2的正向引物序列为5′-ACAATgACAgAAATggAggC-3′,反向序列为5′-ACAggCgTAATACCACAAgC-3′;STAT3的正向引物序列为5′-TgTTggAgCAgCAtTCTTC-3′,反向序列为5′-ggTCACAgACTggTTgTTTC-3′;c-Myc的正向引物序列为5′-gAgATgATgACCgAgTTACTTg-3′,反向序列为5′-AACCgCTCCACATACAgTC-3′;Cyclin D1的正向引物序列为5′-ggATgAgAA CAAgCAgAC-3′,反向序列为5′-TAgCAggAgAggAAg TTg-3′。
1.3.7蛋白免疫印迹法(Western blot)检测组织IL-6、p-JAK2、p-STAT3、c-Myc和CyclinD1蛋白表达:取适量瘤体组织提取蛋白,按照BCA法检测蛋白浓度,煮沸变性,-20 ℃冰箱保存备用。配制SDS-PAGE胶,电泳,将蛋白转移至PVDF膜后5%脱脂奶粉封闭2 h,于一抗稀释液中4 ℃冰箱过夜。TBST清洗后于常温摇床二抗孵育2 h,ECL显色曝光,使用Image J软件对蛋白条带灰度值进行分析,与内参进行比较,分析相对蛋白表达量。
1.4 统计学分析
2 结果
2.1 实验干预对胃癌荷瘤小鼠瘤体质量及抑瘤率的影响
与模型组比,AG490阻断剂组和Stattic阻断剂组小鼠的瘤体质量显著下降(P<0.01),抑瘤率分别为40.11%、37.14%,见表1。
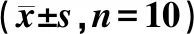
表1 各组小鼠瘤体质量及抑瘤率Table 1 Tumor mass and tumor inhibition rate of mice
2.2 ELISA检测胃癌荷瘤小鼠血清中IL-6表达情况
与空白组比,模型组小鼠血清中IL-6含量升高(P<0.01);与模型组比,AG490阻断剂组和Stattic阻断剂组小鼠血清中IL-6含量下降(P<0.01),见表2。
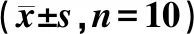
表2 各组小鼠血清中IL-6水平的比较Table 2 Comparison of IL-6 levels in serum of
2.3 免疫组化检测胃癌荷瘤小鼠瘤体组织中蛋白表达情况
与模型组比,AG490阻断剂组和Stattic阻断剂组小鼠瘤体组织中IL-6、JAK2、STAT3、c-Myc和Cyclin D1的阳性表达显著下降(P<0.05,P<0.01),见图1,表3。
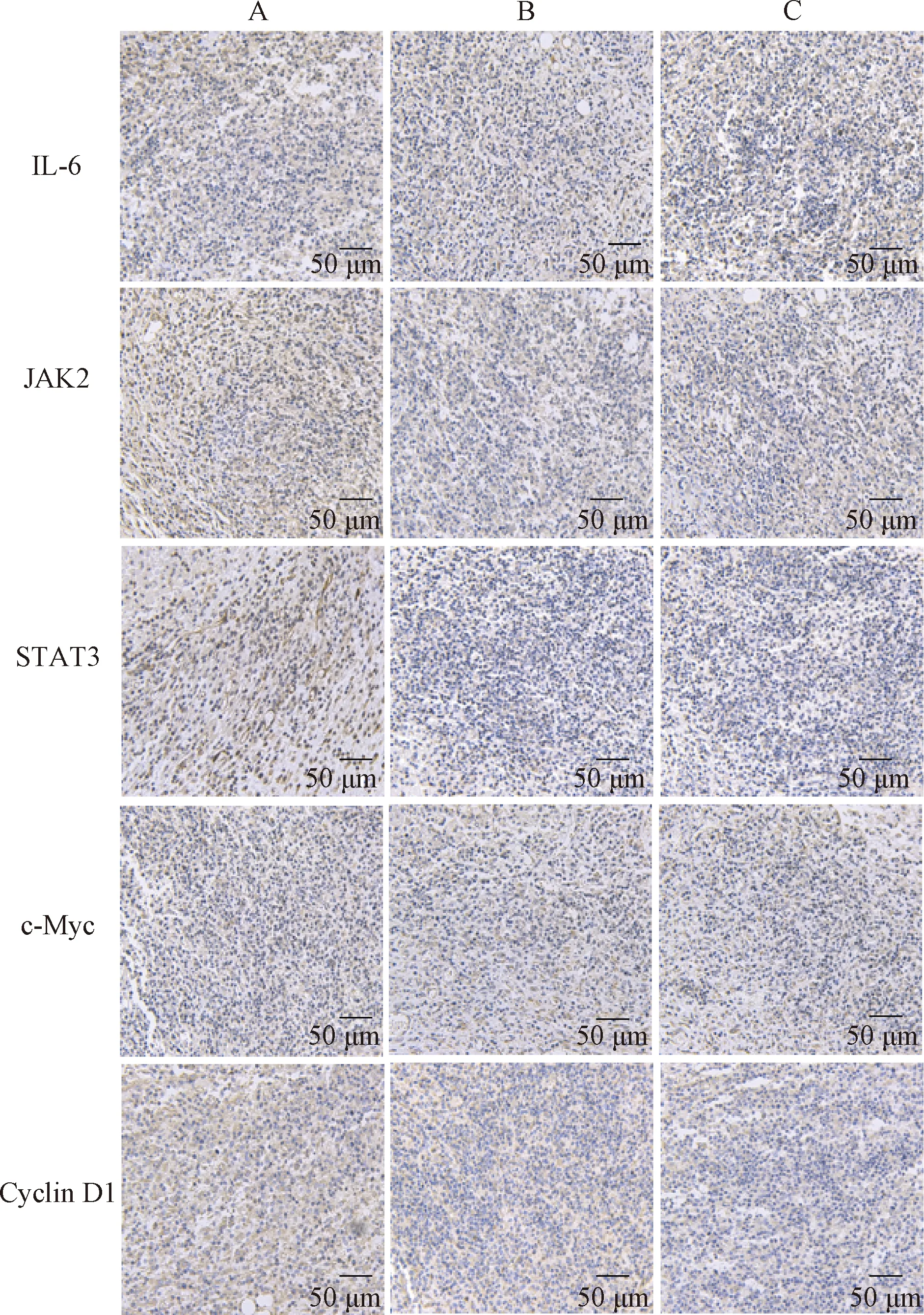
注:A.模型组;B.AG490 阻断剂组;C.Stattic阻断剂组Note: A.Model group;B. AG490 blocker group;C.Stattic blocker group图1 各组小鼠瘤体组织中IL-6、JAK2、STAT3、c-Myc和Cyclin D1含量表达Fig.1 The expression of IL-6, JAK2, STAT3, c-Myc and Cyclin D1 in tumor tissues of each group of mice
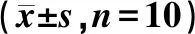
表3 免疫组化检测各组小鼠瘤体组织中蛋白表达情况Table 3 Immunohistochemical detection of protein expression in tumor tissues of mice in each
2.4 RT-qPCR检测胃癌荷瘤小鼠瘤体组织中基因表达情况
与模型组相比,AG490阻断剂组和Stattic阻断剂组小鼠的IL-6、JAK2、STAT3、c-Myc和Cyclin D1 mRNA表达均降低(P<0.01),见表4。
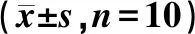
表4 RT-qPCR检测各组小鼠瘤体组织中基因表达情况Table 4 RT-qPCR detection of gene expression in tumor tissues of mice in each
2.5 Western blot检测胃癌荷瘤小鼠瘤体组织中蛋白表达情况
与模型组相比,AG490阻断剂组和Stattic阻断剂组小鼠IL-6、p-JAK2、STAT3、p-STAT3、c-Myc和Cyclin D1蛋白表达均降低,AG490阻断剂组JAK2蛋白表达降低(P<0.05,P<0.01),见图2,表5。

注:A.模型组;B.AG490 阻断剂组;C.Stattic阻断剂组Note: A.Model group;B. AG490 blocker group;C.Stattic blocker group图2 各组小鼠瘤体组织中蛋白表达水平Fig.2 Protein expression levels in tumor tissues of mice in each group
3 讨论
胃癌具有较高的发病率和病死率,严重威胁人类健康,寻找胃癌的有效治疗靶点显得至关重要。IL-6参与免疫反应和炎性反应、造血、骨代谢和胚胎发育,与慢性炎性反应、自身免疫性疾病和癌症密切相关。IL-6可激活下游相关通路,参与肿瘤细胞的生长[8]。有研究[9]证实JAK2/STAT3信号通路在miRNA-223-3p调控胃癌发生发展过程中发挥重要作用。胃癌相关成纤维细胞(CAFs)产生IL-6通过激活JAK2/STAT3信号通路,促进胃癌的迁移和上皮间质转化[10]。
IL-6是活化的T细胞和成纤维细胞产生的淋巴因子,可通过激活JAK增强胃癌细胞的增殖和侵袭能力[11],JAK是一种蛋白磷酸酶,其作用底物为STAT蛋白,即信号传导和转录活化因子。目前发现的JAK家族包括JAK1、JAK2、JAK3和TYK2。STAT激活转位入核后与特定序列DNA片断结合,调控相关基因的表达,产生特定的生物学效应。JAK蛋白酪氨酸激酶可在细胞因子受体与相应配体结合后活化,进而激活STATs诱导目的基因表达。JAK/STAT信号通路控制着多种对细胞稳态至关重要的细胞过程,在癌症进展、炎性反应和自身免疫性疾病中发挥着重要作用。在JAK/STAT亚型中,JAK2/STAT3占主要地位。通常是细胞因子、生长因子或干扰素与其受体结合,诱导其二聚化与受体接近并被磷酸化活化,再交互催化Tyr磷酸化活化,该活化位点可作为信号传导器和转录激活因子(STATs)的对接位点,并通过其SH2结构域与它们结合,结合后形成同源或异源二聚体,转入细胞核[12]。STAT3的激活,可促进下游多种靶基因,如c-Myc、Cyclin D1的活化,从而调控肿瘤的增殖及凋亡[13]。AG490是一种酪氨酸激酶受体抑制剂,可特异性阻断JAK2,Stattic是一种非肽类STAT3小分子阻断剂,可靶向针对其SH2结构域,有效抑制STAT3的激活和核易位。阻断剂的使用为临床治疗胃癌提供了新的思路,单独或与其他治疗药物联合使用可能成为未来的胃癌治疗研究方向。
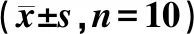
表5 Western blot检测各组小鼠瘤体组织中蛋白表达情况Table 5 Western blot detection of protein expression in tumor tissues of mice in each
在本研究中,与模型组相比,AG490阻断剂组、Stattic阻断剂组小鼠的瘤体质量显著下降,血清中IL-6含量下降,且AG490阻断剂组和Stattic阻断剂组小鼠瘤体组织中的IL-6、p-JAK2、STAT3、p-STAT3、c-Myc和Cyclin D1蛋白及基因表达显著下降,AG490阻断剂组的JAK2蛋白及基因和Stattic阻断剂组JAK2基因表达降低,说明IL-6可激活JAK2/STAT3信号通路,阻断剂通过抑制关键蛋白,进而降低下游c-Myc、Cyclin D1基因及蛋白的表达,从而影响胃癌的生长及增殖。本实验使用JAK2和STAT3阻断剂,证明该通路在胃癌增殖中的作用,为胃癌临床治疗提供新思路。
