FOXM1影响人宫颈癌细胞株Hela/DDP顺铂化疗敏感性的作用
2022-11-18徐冰南金亚彬徐丽南
徐冰南 金亚彬 徐丽南
(1.佛山市第一人民医院肿瘤妇科,广东 佛山 528000;2.广东省中山医科大学附属第六医院生殖中心,广东 广州 510000)
宫颈癌作为常见的妇科恶性肿瘤给女性的健康与生命造成了极大的危害。有调查资料显示[1],我国每年新发宫颈癌病例约占全球的1/5,且每年死于宫颈癌的病例占全球的10%左右。尽管近年来宫颈癌的发病率和死亡率有所下降,但该病有年轻化趋势,且针对该病的防治形势仍十分严峻[2]。顺铂是宫颈癌常用的化疗药物,可抑制脱氧核糖核酸(DNA)的复制和转录,减少细胞增殖,但宫颈癌使用顺铂化疗易产生耐药性[3]。因此如何增强宫颈癌顺铂化疗的敏感性已成为研究的重点。叉头盒蛋白M1(FOXM1)属于Fox转录因子家族成员,与细胞增殖密切相关,且还可参与细胞凋亡与分化等[4]。既往研究表明[5-7],FOXM1可参与多种恶性肿瘤的发生,包括肺癌、宫颈癌等,另外FOXM1表达上调可激活下游的细胞周期蛋白B1(Cyclin B1)、细胞分裂周期因子25B(CDC25B)、存活蛋白(Survivin),抑制p21,参与患者的病情进展导致预后不良。另有研究显示[8],FOXM1表达下调可增强人喉癌细胞株Hep-2顺铂化疗的敏感性,促进细胞凋亡。但FOXM1是否会影响人宫颈癌耐药细胞株Hela/DDP顺铂化疗的敏感性及其可能的机制尚不清楚。基于此,本研究展开体外细胞实验,设计FOXM1表达上调、下调及对照组,并增加空白组和抑制剂组,探讨上述问题,旨在为增强宫颈癌顺铂化疗敏感性提供新思路。
1 材料与方法
1.1 材料
1.1.1 细胞 人宫颈癌耐药细胞株Hela/DDP(购自美国ATCC细胞库,货号:FB06008)。
1.1.2 主要药品与试剂 含有正义FOXM1 互补的脱氧核糖核酸(cDNA)的真核质粒、空真核质粒、干扰FOXM1基因表达的重组、空载重组质粒构建和载体鉴定均委托宝生物(大连)公司完成;脂质体Lipofectamine2000(美国Invitrogen公司);改良伊格尔培养基(DMEM)高糖培养液(美国Gibco公司);洛斯维·帕克纪念研究所(RPMI)1640培养液(美国Gibco公司);顺铂(美国Sigma公司);硫链丝菌肽(江苏艾康生物医药研发有限公司);Trizol试剂(美国Invitrogen公司);FOXM1、Cyclin B1、CDC25B、Survivin、p21及β-actin引物均委托深圳晶美生物工程有限公司合成;二喹啉甲酸(BCA)法蛋白定量试剂盒(美国Thermo公司);鼠抗人FOXM1、Cyclin B1、CDC25B、Survivin、p21单克隆抗体(一抗),兔抗鼠FOXM1、Cyclin B1、CDC25B、Survivin、p21多克隆抗体(二抗,辣根过氧化物酶标记)(美国Santa Cruz公司);细胞增殖抑制率噻唑蓝(MTT)法试剂盒(上海歌凡生物科技有限公司);二甲基亚砜(DMSO)(江苏永健化工有限公司);Binding Buffer(江苏凯基生物技术股份有限公司);膜联蛋白-V异硫氰基荧光素(Annexin-V FITC)(美国Sigma公司);碘化丙啶(PI)(美国Sigma公司)。
1.1.3 仪器 MCO-18AIC型CO2培养箱(日本Sanyo公司);7900-Fast型聚合酶链反应(PCR)仪(美国ABI公司);Compact XS型电泳仪(德国Biometra公司);Trans-Blot®TurboTM型转膜仪(美国Bio Rad公司);iBright FL1000型成像扫描仪(Odyssey)(美国Thermo Fisher公司);XDS-18型倒置显微镜(重庆光电仪器有限公司);TDZ5-BP型医用离心机(长沙湘锐离心机有限公司);CytoFLEX型流式细胞仪(美国Thermo Fisher公司)。
1.2 方法
1.2.1 质粒与载体的构建 构建含有正义FOXM1 cDNA的真核表达载体(质粒正义链:5′-AUCUU GAGAUCUAG-3′,反义链:5′-CGUAGAUUCUAGA GAC-3′)、空质粒的真核表达载体(质粒正义链:5′-AGGGGUCUCUAA-3′,反义链:5′-CUGGGUAUAU ACGAU-3′)、干扰FOXM1基因表达的重组载体(质粒正义链:5′-UCGUAUAGCUUAUAGGA-3′,反义链:5′-AUCUAGGAUCUGAGAGCA-3′)和空载载体(质粒正义链:5′-AGUUACGATAGCTUAGC-3′,反义链:5′-AGATTCUATAUCUATAC-3′),转染脂质体Lipofectamine2000。
1.2.2 细胞培养、转染和分组 人宫颈癌耐药细胞株Hela/DDP以DMEM高糖培养液培养,含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素,培养至对数生长期,条件:37℃、5%CO2培养箱。取上述细胞接种至6孔板,每孔2.0×105个细胞。次日,按照转染试剂说明书分别将100 nmol/L的载体加入细胞进行转染,利用嘌呤霉素筛选转染成功的细胞,并分别记为过表达组(含有正义FOXM1 cDNA的真核表达质粒与干扰FOXM1基因表达的重组质粒分别上调)、过表达对照组(转染空质粒的真核表达载体)、沉默组(抑制FOXM1表达)、沉默对照组(空载载体)。另设置空白组(无转染、未添加抑制剂、无特殊干预的细胞)和抑制剂组(添加FOXM1抑制剂培养的人宫颈癌细胞株Hela/DDP)。空白组和抑制剂组仅加入RPMI1640培养液。每组5个复孔,均加入顺铂使其终浓度为100 ng/mL,抑制剂组另加入FOXM1特异性抑制剂硫链丝菌肽使其终浓度为2 μmol/L,培养48 h。
1.2.3 FOXM1基因干扰的验证 ①采用实时逆转录荧光定量PCR(RT-qPCR)法检测各组细胞FOXM1 信使核糖核酸(mRNA)表达:取各组细胞采用Trizol试剂提取总RNA,鉴定并反转录,将获取的cDNA作为模板进行扩增反应。FOXM1引物序列:正向5′-TAGAGCTTAGAGCTAG-3′,反向5′-CTGATAGGCTATAGCTAGC-3′,预计扩增产物长度240 bp;持家基因β-actin引物序列:正向5′-AGGCTAGAGCTAGACA-3′,反向5′-CTGAGAGCTTAGAGCTAGAGC-3′,预计扩增产物长度196 bp。反应流程:94℃(60 s),40个循环:72℃(90 s)、54℃(30 s),最后72℃(5 min)。计算2-△△Ct。②采用蛋白质免疫印迹法(Western Blot)检测各组FOXM1蛋白表达:各组分别加入细胞裂解液,收集总蛋白,BCA法定量。100℃煮5 min使蛋白变性,配置十二烷基硫酸钠聚丙烯酰胺(SDS-PAGE)凝胶,上样量50 μL/孔。电泳参数:浓缩胶电泳恒定电压60 V,分离胶电泳恒定电压100 V,直至溴酚蓝跑至胶底部。湿转膜,100 mA、90 min。封闭1 h后加入一抗稀释液(稀释倍数:1∶1000),4℃孵育过夜;洗膜3次、10 min/次,加入二抗稀释液(稀释倍数:1∶2000),室温孵育1 h,再次洗膜。暗室曝光显影,利用成像扫描仪扫描,系统软件计算目的蛋白条带累计光密度值与内参的比值。
1.2.4 细胞形态学观察 于倒置显微镜下观察各组培养48 h后的细胞形态学变化。
1.2.5 细胞增殖抑制率检测 采用MTT法,每孔加入MTT溶液25 μL,浓度5 g/L,避光孵育4 h。加入DMSO继续孵育4 h,150 μL/孔。震荡10 min,测定各孔在490 nm处的光密度值,该实验另设置无干预组,即仅常规培养的人宫颈癌耐药细胞株Hela/DDP,增殖抑制率=1-(观察组光密度值/无干预组光密度值)[9]。
1.2.6 细胞凋亡率检测 采用流式细胞仪双染法,取各组细胞磷酸盐缓冲液洗涤,胰酶消化,并以细胞上清液终止消化。1000 r/min(离心半径10 cm)离心5 min,以500 μL Binding Buffer重悬细胞,加入5 mL Annexin-V FITC混匀,再加入5 mL PI混匀,室温避光。20 min后上机检测,计算早期凋亡和晚期凋亡细胞占比总和记作细胞凋亡率[10]。
1.2.7 FOXM1下游相关mRNA表达检测 采用RT-qPCR法,具体操作同上,其中Cyclin B1引物序列:正向5′-ATCGGTATAGGTATAGCGTAG-3′,反向5′-CGGTATAGGAGGCTAGAGCTAG-3′,预计扩增产物长度286 bp;CDC25B引物序列:正向5′-CGTATAGGCTATAGC-3′,反向5′-AGAGCTTGA GAGCTGA-3′,预计扩增产物长度162 bp;Survivin引物序列:正向5′-CGGTAAGGCTATAG-3′,反向5′-AGAGCTTAGAGCTG-3′,预计扩增产物长度152 bp;p21引物序列:正向5′-AGAGTCTGAGAGCTA GAG-3′,反向5′-CGAGTATAGCGTATAGCTAA-3′,预计扩增产物长度218 bp。
1.2.8 FOXM1下游相关蛋白表达检测 采用Western Blot法,具体操作同上,其中一抗稀释倍数:1∶1000、1∶1000、1∶2000、1∶1000;二抗稀释倍数:1∶2000、1∶2000、1∶5000、1∶2000。
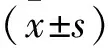
2 结果
2.1 FOXM1基因干扰验证结果 与空白组比较,沉默组和抑制剂组FOXM1 mRNA及蛋白表达均下降(P<0.05),过表达组上述指标均升高(P<0.05);空白组、过表达对照组和沉默对照组FOXM1 mRNA及蛋白表达比较差异均无统计学意义(P>0.05);沉默组和抑制剂组FOXM1 mRNA及蛋白表达比较差异均无统计学意义(P>0.05),见表1。
2.2 细胞形态学改变观察 空白组、沉默对照组、过表达对照组细胞均贴壁生长、状态良好、呈片状、紧密连接,且细胞饱满,大小和形态均匀;过表达组细胞呈贴壁生长、状态理想,连接致密,且细胞数量多;沉默组和抑制剂组细胞密度下降、体积不均、形态不一、轮廓不清,细胞间空隙加大、部分细胞呈悬浮状态,且二者可见细胞大量皱缩的细胞,且细胞碎片增多,见图1。
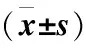
表1 各组FOXM1 mRNA及蛋白表达比较

图1 各组细胞形态学改变(倒置显微镜,200×,刻度尺:100 μm)
2.3 各组细胞增殖抑制率比较 与空白组比较,沉默组和抑制剂组增殖抑制率均升高(P<0.05),过表达组增殖抑制率下降(P<0.05);空白组、过表达对照组和沉默对照组增殖抑制率比较差异无统计学意义(P>0.05);沉默组和抑制剂组增殖抑制率比较差异无统计学意义(P>0.05),见表2。
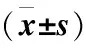
表2 各组细胞增殖抑制率比较
2.4 各组细胞凋亡率比较 与空白组比较,沉默组和抑制剂组凋亡率均升高(P<0.05),过表达组凋亡率下降(P<0.05);空白组、过表达对照组和沉默对照组凋亡率比较差异无统计学意义(P>0.05);沉默组和抑制剂组凋亡率比较差异无统计学意义(P>0.05),见表3、图2。
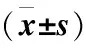
表3 各组细胞凋亡率比较
2.5 各组细胞Cyclin B1、CDC25B、Survivin、p21 mRNA表达比较 与空白组比较,沉默组和抑制剂组Cyclin B1、CDC25B、Survivin mRNA表达均下降(P<0.05),过表达组上述指标均升高(P<0.05);与空白组比较,沉默组和抑制剂组p21 mRNA表达均升高(P<0.05),过表达组上述指标下降(P<0.05);空白组、过表达对照组和沉默对照组Cyclin B1、CDC25B、Survivin、p21 mRNA表达比较差异均无统计学意义(P>0.05),沉默组和抑制剂组比较差异均无统计学意义(P>0.05),见表4。
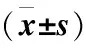
表4 各组Cyclin B1、CDC25B、Survivin、p21 mRNA表达比较
2.6 各组细胞Cyclin B1、CDC25B、Survivin、p21蛋白表达比较 与空白组比较,沉默组和抑制剂组Cyclin B1、CDC25B、Survivin蛋白表达均下降(P<0.05),过表达组上述指标均升高(P<0.05);与空白组比较,沉默组和抑制剂组p21蛋白表达均升高(P<0.05),过表达组上述指标下降(P<0.05);空白组、过表达对照组和沉默对照组Cyclin B1、CDC25B、Survivin、p21蛋白表达比较差异均无统计学意义(P>0.05),沉默组和抑制剂组比较差异均无统计学意义(P>0.05),见表5、图3。
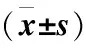
表5 各组Cyclin B1、CDC25B、Survivin、p21蛋白表达比较

图3 Western Blot检测各组Cyclin B1、CDC25B、Survivin、p21蛋白表达
3 讨论
顺铂在宫颈癌治疗中应用广泛,可作为化疗药物、放疗增敏剂发挥双重作用[11]。有报道显示[12],宫颈癌患者采用顺铂化疗的缓解率可达25%,且该药物在宫颈癌治疗中占据着重要的地位。然而顺铂副作用大,且长期应用易产生耐药性。据吴少敏等[13]报道,宫颈癌患者采用顺铂单药化疗的耐药率为32.35%,提示顺铂化疗耐药也是宫颈癌治疗中的重要难题。而目前人们关于宫颈癌顺铂化疗耐药的原因及机制认识尚浅,如何有效提高其敏感性仍需重点研究。
FOXM1属于增殖特异性因子,与细胞增殖活性、侵袭转移能力及新血管生成等均有关,当其表达水平上调不仅可通过上述途径促进肿瘤发生和进展,还可激活参与肿瘤发生和进展的多种因子,如基质金属蛋白酶-2等。关于FOXM1表达与恶性肿瘤化疗敏感性的相关性既往也有相关报道证实[14],提示FOXM1蛋白阳性表达是恶性肿瘤化疗耐药的危险因素,也说明可尝试将其作为恶性肿瘤治疗的新靶点,使用FOXM1抑制剂以增强患者化疗的敏感性。但此类研究目前仍处于实验阶段,尚未应用于临床。本研究结果显示,沉默组和抑制剂组FOXM1基因与蛋白表达水平均较空白组下降,过表达组则均升高,证实干扰FOXM1表达的载体构建成功。本研究中利用空白组评价过表达组、沉默组的基因干扰效率,了解干扰FOXM1基因表达对此类细胞的具体作用及分子机制,同时可利用过表达对照组、沉默对照组排除阳性干扰,避免结果偏倚。本研究以脂质体LiperfactimineTM2000为载体,可确保转染效率;将上述载体分别于人宫颈癌耐药细胞株Hela/DDP共培养可保证成功干扰FOXM1表达。此外,本研究设置抑制剂组,主要是因为硫链丝菌肽是FOXM1特异性抑制剂[15],设置该组可验证沉默组增强顺铂化疗敏感性的作用。FOXM1主要是通过影响细胞周期进而影响细胞增殖活性的,而顺铂则是通过破坏DNA的复制与功能、干扰细胞周期进而杀灭癌细胞的,因此推测干扰FOXM1表达很可能能够影响人宫颈癌耐药细胞株Hela/DDP顺铂化疗的敏感性。另外,本研究细胞形态学、增殖抑制率和凋亡率结果均证实上调FOXM1表达可降低人宫颈癌耐药细胞株Hela/DDP顺铂化疗的敏感性,而抑制FOXM1表达则可增强其顺铂化疗的敏感性,与上述分析相符。
FOXM1可正反馈调节其下游的Cyclin B1、CDC25B、Survivin表达,负反馈调节其下游的p21表达,而各分子均是参与恶性肿瘤细胞周期进展的重要指标[16-17]。研究发现[18],FOXM1表达上调可激活其靶基因Cyclin B1、CDC25B、Survivin等,并抑制p21等,进而在DNA合成前期末发挥作用,并持续整个DNA合成期、DNA合成后期、细胞分裂期等,而p21表达下调不仅可促进DNA合成前期向DNA合成期、DNA合成后期向细胞分裂期转换,还可抑制细胞凋亡。FOXM1表达缺失则可阻滞细胞周期进展,且常导致有丝分裂纺锤体缺陷,可引发非整倍体及多倍体产生[19]。目前肿瘤学专家普遍认为[20-22],FOXM1上调可通过DNA损伤修复、细胞增殖、细胞凋亡及组织稳态等多种途径参与实体瘤的形成,并且还可诱导恶性肿瘤细胞对铂类化疗药物产生耐药性,因此抑制FOXM1表达、阻断该信号通路的转导是增强铂类化疗药物敏感性的新方案。由此可知,抑制FOXM1表达有助于增强恶性肿瘤细胞对铂类化疗药物的敏感性,且与抑制Cyclin B1、CDC25B、Survivin表达,上调p21表达有关;而上调FOXM1表达则可增强恶性肿瘤细胞对铂类化疗药物的耐药性,且很可能与上调Cyclin B1、CDC25B、Survivin表达,下调p21表达有关。本研究结果中过表达组Cyclin B1、CDC25B、Survivin表达均较其余各组升高,p21表达则均较各组下降,且沉默组Cyclin B1、CDC25B、Survivin表达则显著低于沉默对照组和空白组,p21表达显著高于沉默对照组和空白组,研究结果与上述分析一致,提示干扰FOXM1可影响宫颈癌顺铂化疗的敏感性,建议深入研究以服务于临床。
4 结论
上调FOXM1表达可降低人宫颈癌耐药细胞株Hela/DDP顺铂化疗的敏感性,而抑制FOXM1表达可增强其敏感性,并且有助于促进细胞形态学改变,提高增殖抑制率和凋亡率,推测与调控FOXM1信号通路,正反馈调节Cyclin B1、CDC25B、Survivin表达,负反馈调节p21表达有关。但该结论应用于临床的策略及可行性仍需要进一步探讨,应作为后期研究的重点。
