巴氏杀菌牛乳中免疫球蛋白G含量和乳过氧化物酶活性
2022-11-16张锋华
张锋华
(乳业生物技术国家重点实验室,上海乳业生物工程技术研究中心,光明乳业股份有限公司,上海 200436)
巴氏杀菌乳是重要的乳制品之一,近些年国内市场在不断增长,至2021年市场规模已超过400 亿元人民币[1]。乳含有丰富的营养成分[2-4],还含有数百种生物活性物质[5-7]。近些年,国内外科研机构对乳中各类活性物质展开了研究[8-10],其中免疫球蛋白(immunoglobulin,Ig)是乳中最重要的生物活性蛋白之一,在增强机体的免疫能力、防止细菌和病毒入侵、活化补体、中和毒素、杀死肿瘤细胞等方面发挥重要作用[11-12]。乳中Ig包括IgG、IgA和IgM等[13],其中IgG含量最高,占Ig总含量的80%以上。另外,乳过氧化物酶也是乳中一种重要的生物活性物质,它是过氧化物酶家族的成员之一,是天然存在于乳汁中的一种血红素蛋白[14]。乳过氧化物酶系统对多重耐药的大肠杆菌菌株、鼠伤寒沙门氏菌、空肠弯曲杆菌、蜡样芽孢杆菌、金黄色葡萄球菌及单核细胞增生李斯特菌等病原菌的生长具有较强的抑制作用[15]。
巴氏杀菌工艺是为了避免人们受到生乳中病原微生物带来的危害风险,使用特定的设备、规范的操作,对生乳采用的一种相对温和的热处理方法[16]。巴氏杀菌能最大限度保留牛乳中的生物活性物质[17-18],相比乳铁蛋白、α-乳白蛋白、β-乳球蛋白等,IgG和乳过氧化物酶是热敏性更高的2 类活性物质[19-20],相比于乳中其他酶类,乳过氧化物酶热稳定性较好[21]。欧盟曾将乳过氧化物酶作为巴氏杀菌工艺评价的指标之一,当巴氏杀菌乳中乳过氧化物酶阴性时,则判定为“热处理过度”。另外,有研究发现无机微滤膜除菌可脱除99.8%~99.9%菌体,滤膜除菌结合较温和巴氏杀菌工艺可以有效降低对巴氏杀菌的强度要求,从而保留更多的活性成分[22]。在国内,巴氏杀菌的温度-时间组合一直未被充分明确,GB 19645—2010《食品安全国家标准 巴氏杀菌乳》中未对“巴氏杀菌”有明确的要求,GB/T 27342—2009《危害分析与关键控制点体系 乳制品生产企业要求》中规定巴氏杀菌乳的杀菌温度与时间组合分别为63~65 ℃、30 min或72~85 ℃、15~20 s,这个要求比较宽泛,所以实践中许多国内企业偏好于85 ℃杀菌,近些年由于优质乳工程的实施,乳企开始采用较低的杀菌强度。
本研究选用IgG和乳过氧化物酶2 种生物活性物质,研究巴氏杀菌乳加工过程及货架期内含量和活性变化,旨在为行业开发更高品质的巴氏杀菌乳及制定相关更为先进的标准提供参考依据。
1 材料与方法
1.1 材料与试剂
生牛乳来自上海金山廊下牧场和江苏射阳银宝牧场,0~4 ℃保存,24 h内使用。
Evergreen乳过氧化物酶活性检测试剂盒 北京中检葆泰生物技术有限公司;IgG标准品(纯度≥95%)美国Sigma公司;NaH2PO4·2H2O、Na2HPO4·12H2O、NaOH、HCl、NaCl、乙酸(均为分析纯) 国药集团化学试剂有限公司;实验室用水均为去离子水。
1.2 仪器与设备
APV 2000均质机、TP37SE中试杀菌机 美国APV公司;Micron SCT 19-P37-30GP50-23陶瓷膜过滤设备(1.4 μm) 美国Pall公司;1100高效液相色谱仪(配备紫外检测器) 美国安捷伦公司;SelectCore Protein G亲和柱、BioCore TMSEC-300液相色谱柱 纳谱分析技术(苏州)有限公司。
1.3 方法
1.3.1 IgG含量的测定
采用T/SSFS 0002—2021《乳及乳制品中免疫球蛋白IgG的测定 高效液相色谱法》分析牛乳样品中IgG的含量变化:根据高效亲和色谱原理,在磷酸盐缓冲液条件下IgG与配基亲和结合,在pH 3.0冰乙酸条件下洗脱IgG,通过凝胶过滤色谱进行检测,外标法定量。
1.3.2 乳过氧化物酶活性的测定
将样品或标准品加入微孔板中,随后加入底物及终止液,溶液由蓝色变为黄色,在450 nm波长处测定吸光度;样品中乳过氧化物酶活性与吸光度呈反比。具体测定方法参考T/CIFST 008—2022《乳中乳过氧化物酶活性的测定 比色法》[23]。
1.3.3 巴氏杀菌乳生产工艺流程
工艺流程1:生牛乳→均质→杀菌→冷却→灌装
工艺流程2:生牛乳→脱脂→微滤膜除菌→标准化→均质→杀菌→冷却→灌装
1.3.4 不同均质工艺对牛乳中生物活性物质的影响
将生牛乳分别预热到60、65、70 ℃,采用20 MPa的压力进行均质,测定牛乳均质前后IgG含量及乳过氧化物酶活性。
将生牛乳预热到65 ℃,分别采用15、20、25 MPa的压力进行均质,测定牛乳均质前后IgG含量及乳过氧化物酶活性。
1.3.5 不同杀菌工艺对巴氏杀菌乳中生物活性物质的影响
取生牛乳,分别在72、73、74、75、76、78、80、85 ℃保持15 s,冷却灌装,冷藏备用。测定牛乳杀菌前后IgG含量及乳过氧化物酶活性。
1.3.6 不同工艺流程对巴氏杀菌乳中生物活性物质的影响
取生牛乳,分别经1.3.3节2 种工艺流程加工,测定巴氏杀菌乳IgG含量及乳过氧化物酶活性。其中工艺流程1采用75 ℃、15 s杀菌,工艺流程2采用膜滤除菌结合72 ℃、15 s杀菌。
1.3.7 不同贮存条件对巴氏杀菌乳中生物活性物质的影响
将采用工艺流程1且使用75 ℃、15 s杀菌处理的巴氏杀菌乳置于屋顶盒中5 ℃保存7 d,分别在0、1、2、4、7 d测定IgG含量及乳过氧化物酶活性。
将采用工艺流程1且使用75 ℃、15 s杀菌处理的巴氏杀菌乳采用透明玻璃瓶灌装,分别置于室内日光灯照射和避光环境中,5 ℃保存,分别在0、1、2、3、4、5 d测定乳过氧化物酶活性。
1.3.8 牛乳中IgG含量剩余率及乳过氧化物酶活性剩余率计算
牛乳中IgG含量剩余率按式(1)计算。
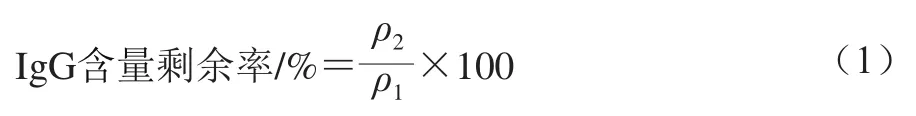
式中:ρ1为生牛乳中IgG含量/(mg/L);ρ2为不同工艺加工后牛乳或巴氏杀菌乳IgG含量/(mg/L)。
牛乳中乳过氧化物酶活性剩余率按式(2)计算。

式中:B1为生牛乳中乳过氧化物酶活力/(U/L);B2为不同工艺加工后牛乳或巴氏杀菌乳中乳过氧化物酶活力/(U/L)。
1.4 数据处理
运用Excel 2016软件对实验数据进行分析,数据两两比较采用t检验(成对双样本均值分析),P<0.05表示差异具有统计学意义。
2 结果与分析
2.1 不同均质工艺对牛乳中生物活性物质的影响
由图1可知,生牛乳在65 ℃及以下的均质温度下,采用20 MPa的均质压力处理,对牛乳中IgG含量剩余率的影响较小,而同等压力下当均质温度为70 ℃时,牛乳中IgG含量剩余率有了较为明显的变化(P<0.05)。而同样在70 ℃、20 MPa的条件下,牛乳中乳过氧化物酶活性剩余率也显著下降(P<0.05)。所以在满足均质效果的前提下,采用65 ℃及以下的均质温度更有利于牛乳中生物活性物质的保留。

图1 不同均质温度下牛乳中IgG含量及乳过氧化物酶活性剩余率Fig.1 Residual levels of IgG content and lactoperoxidase activity in milk at different homogenization temperatures
由图2可知,生牛乳在65 ℃的均质温度下,无论采用15、20 MPa还是25 MPa的均质压力处理,牛乳中IgG含量剩余率及乳过氧化物酶活性剩余率均差异不显著。Pinho等[24]研究发现,采用100 MPa及以上的均质压力处理牛乳,其乳过氧化物酶的活性先降低,压力升至150 MPa再升高,后又降低,压力升至300 MPa完全失活。本研究采用的均质压力相对较小,能保证乳脂肪等的分散性,同时又不会对活性物质产生太大影响。在实际应用中应同时考虑均质效果及能耗进行工艺选择。
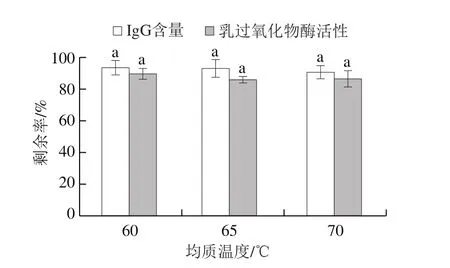
图2 不同均质压力下牛乳中IgG含量及乳过氧化物酶活性剩余率Fig.2 Residual levels of IgG content and lactoperoxidase activity in milk at different homogenization pressures
2.2 不同杀菌工艺对巴氏杀菌乳中生物活性物质的影响
由图3可知,当采用72 ℃、15 s的杀菌工艺时,巴氏杀菌乳中IgG含量及乳过氧化物酶活性剩余率最高,分别达86%和65%。随着杀菌温度的不断提高,IgG含量及乳过氧化物酶活性剩余率不断下降。当杀菌温度超过76 ℃时,IgG含量剩余率急速下降,至80 ℃时已不足5%,此时乳过氧化物酶活性剩余率为0%。从72 ℃、15 s到76 ℃、15 s这一过程中,IgG含量剩余率下降幅度不大;在经过76 ℃、15 s杀菌后,巴氏杀菌乳中IgG含量剩余率仍能保留在60%左右这一较高水平,乳过氧化物酶活性剩余率也能维持在20%左右。此杀菌强度下,乳铁蛋白等其他多种活性成分也较好保留[25]。72~76 ℃、15 s可作为优质巴氏杀菌乳的杀菌工艺参数,该杀菌温度-时间组合除能保留更多生物活性物质,同时也能有效杀灭病原菌,而且相比于GB/T 27342—2009的杀菌要求更加精确。另外,《美国优质乳条例》提到,如果某种乳制品的脂肪含量超出基础产品10%或乳固体总量超出18%,应将杀菌温度提高3 ℃,这有助于对病原菌的杀灭[26]。近些年随着我国生牛乳中蛋白、脂肪及总固体含量的不断升高,市场上出现了较多固形物含量较高的巴氏杀菌乳产品,建议此类产品采用75 ℃、15 s的杀菌方式,国内也有一些报道推荐该温度条件,潘永胜[27]研究认为,75 ℃、15 s热处理可推荐为优质巴氏杀菌乳的生产条件。

图3 不同杀菌工艺下巴氏杀菌乳中IgG含量及乳过氧化物酶活性剩余率Fig.3 Residual levels of IgG content and lactoperoxidase activity in milk with different sterilization processes
2.3 不同工艺流程对巴氏杀菌乳中生物活性物质的影响
依据1.3.3节工艺流程1,杀菌强度采用75 ℃、15 s,工艺流程2,杀菌强度采用72 ℃、15 s,分别处理31 个生牛乳样品。
由图4可知,2 种工艺流程均能检测出较高含量的IgG,分布在192~281 mg/L,而采用膜过滤方式的工艺流程制得的巴氏杀菌乳IgG含量总体相对稍高,IgG含量出现一定的波动可能是由于生牛乳中含量差异导致。

图4 不同工艺流程下巴氏杀菌乳中IgG含量Fig.4 IgG content in milk under different pasteurization conditions
由图5可知,2 种工艺流程均能检测出较高的乳过氧化物酶活性,分布在3 824~8 341 U/L,采用膜过滤方式的工艺流程制得的巴氏杀菌乳乳过氧化物酶活性明显更高。

图5 不同工艺流程下巴氏杀菌乳中乳过氧化物酶活性Fig.5 Lactoperoxidase activity in milk under different pasteurization conditions
花榜清[28]研究浓缩、脱脂等工艺处理后乳过氧化物酶活性损失率的变化,本研究中工艺流程2包含脱脂、膜滤除菌等步骤,工序较为复杂,但膜滤除菌过程采用的温度较低,基本不会对乳过氧化物酶活性造成大的影响。结果表明,杀菌强度对生物活性物质含量的影响大于其他加工工序的影响。国际上,采用膜滤除菌结合巴氏杀菌处理牛乳也被推荐用于牛乳,以延长货架期[29]。
2.4 不同贮存条件对巴氏杀菌乳中生物活性物质的影响
巴氏杀菌乳一般置于2~6 ℃条件下冷藏保存。由图6可知,在5 ℃条件下保存7 d,屋顶盒包装巴氏杀菌乳IgG含量剩余率变化不明显,而乳过氧化物酶活性剩余率有小幅下降,至第7天乳过氧化物酶活性剩余率在30%左右,还保留了一部分活性。所以在正常保质期内,巴氏杀菌乳中的生物活性物质含量或活性不会随着保存时间的延长而大幅降低。

图6 不同贮藏时间下牛乳中IgG含量及乳过氧化物酶活性剩余率Fig.6 Residual levels of IgG content and lactoperoxidase activity in milk at different storage periods
乳过氧化物酶是一种光敏感性物质,在光照下较易失活[30]。由图7可知,透明材质包装的巴氏杀菌乳产品长时间处于光照下乳过氧化物酶活性剩余率会出现一定程度的下降,但并没有完全失去活性,这可能是因为巴氏杀菌乳成分较为复杂,脂肪、蛋白等大分子的包裹对乳过氧化物酶产生了一定的保护作用。

图7 不同光照条件下牛乳中乳过氧化物酶活性剩余率Fig.7 Residual levels of lactoperoxidase activity in milk under different light conditions
3 结 论
通过研究发现,采用65 ℃以下的均质温度及15~25 MPa的均质压力处理牛乳对其IgG含量和乳过氧化物酶活性的影响较小,可结合均质效果选择合适的均质条件。相对于78~85 ℃、15 s的巴氏杀菌温度-时间组合,72~76 ℃、15 s处理对2 种生物活性物质影响较小,加工优质巴氏杀菌乳宜采用此组温度-时间组合;采用膜滤除菌结合72 ℃、15 s杀菌可以在保证食品安全的前提下,更好地保留2 种生物活性物质。在正常的保质期内,巴氏杀菌乳中的IgG含量和乳过氧化物酶活性不会随着保存时间的延长而显著降低,但采用透明包装的产品长期暴露在光照下会造成乳过氧化物酶部分失活。
