瑞格列奈在人肝微粒体中的酶促反应动力学及葛根素对其代谢的影响
2022-11-16何文娟刘秀菊孙倩李丹王淑梅河北医科大学第二医院药学部石家庄050000
何文娟,刘秀菊,孙倩,李丹,王淑梅(河北医科大学第二医院药学部,石家庄 050000)
随着人们生活水平的提高,糖尿病发病率不断攀升,成为继心血管疾病和癌症之后,威胁人类生命健康的第三大杀手[1]。葛根味甘、辛,性凉,具有解肌退热、生津止渴、升阳止泻的功效[2-3]。已有研究显示,葛根主要通过减轻β细胞氧化应激损伤,保护胰岛β细胞功能,改善胰岛素抵抗,促进糖代谢等多种途径发挥降糖作用[4]。目前,葛根已成为多种治疗糖尿病中成药的主要成分,如玉泉丸、芪药消渴胶囊、复方葛根胶囊等,并在糖尿病心脑血管并发症的治疗上取得了一定疗效。因此,研究葛根活性成分与降糖药合用的相互作用对糖尿病患者的用药安全具有重大意义。
瑞格列奈为临床常用的降糖药,是一种胰岛素促泌剂,其主要通过CYP2C8 和CYP3A4 进行代谢[5]。葛根素(puerarin)是葛根的主要活性成分,具有降血糖和改善患者糖尿病并发症等作用[6]。临床治疗过程中,葛根素和瑞格列奈会经常出现合用的情况。且已有研究表明,葛根素对CYP2B6、CYP2C9 及CYP3A4 均有一定的抑制作用,葛根素对肝组织CYP3A4 蛋白的表达具有明显的抑制作用[7-8]。因此,本实验将基于人肝微粒体孵育实验研究葛根素对瑞格列奈酶促反应动力学的影响,进而考察葛根素对瑞格列奈代谢的影响,为两药合用的安全性提供参考依据。
1 仪器与试药
1.1 仪器
超高效液相色谱仪(美国Waters 公司);冷冻离心机(GL-20G-Ⅱ,上海安亭科学仪器厂);超低温冰箱(MDF-U 3386S,Panasonic);恒温混匀仪(MTH-100,杭州米欧仪器有限公司);涡旋混合器(XW-80A,上海医科大学仪器厂);电子分析天平(CPA225D,德国Sartorius);恒温氮吹仪(KL512J,北京康林科技有限公司);超声波清洗器(KQ-300B,昆山市超声仪器有限公司);台式酸度计(哈纳PH213)。
1.2 试药
瑞格列奈(批号:100753-201303,纯度:99.8%)、葛根素(批号:110752-201816,纯度:95.4%)、阿托伐他汀(批号:100590-201804,纯度:95.0%)(中国食品药品检定研究院)。混合SD 人肝微粒体原液(20 mg·mL-1),NADPH发生系统[NRS(A)M10001.2018001,武汉普莱特生物医药有限公司)。乙酸乙酯(天津市永大化学试剂有限公司,批号:20161203);乙酸铵(Aladdin,批号:I1903034);高纯氮气(石家庄京联实用气体有限公司,批号:20211110),乙腈(HPLC 级)、甲酸(色谱纯)(Fisher Chemical),水为屈臣氏蒸馏水。
2 方法与结果
2.1 溶液的制备
2.1.1 瑞格列奈对照品溶液 称取瑞格列奈对照品适量,乙腈溶解,定容,制成浓度为1.1×104μmol·L-1的储备液,依次精密量取储备液适量,用乙腈稀释成8800.00、6600.00、4400.00、2200.00、1100.00、55.00、27.50、13.75 和6.87 μmol·L-1的对照品溶液,备用。
2.1.2 葛根素对照品溶液 称取葛根素对照品适量,乙腈溶解,定容,制成浓度为200 μmol·L-1的储备液,依次精密量取储备液适量,用乙腈稀释成50、25、10、5、2.5 μmol·L-1的对照品溶液,备用。
2.1.3 阿托伐他汀(内标)对照品溶液 称取阿托伐他汀对照品适量,乙腈溶解,定容,稀释成浓度为300 μmol·L-1的溶液。
2.1.4 空白温孵液 取肝微粒体,经高温灭活后,采用0.1 mol·L-1K2HPO4缓冲液(pH 7.4)稀释成蛋白质量浓度为0.5 mg·mL-1的空白温孵液。
2.2 人肝微粒体温孵实验
2.2.1 温孵条件 K2HPO4缓冲液(pH 7.4)176 μL,NADPH 发生系统12 μL(A 液10 μL,B 液2 μL),人肝微粒体10 μL,底物瑞格列奈(5.5 μmol·L-1)2 μL。以上试剂均置于37℃水中,预热5 min 后混合,得到肝微粒体孵育体系,终体积为200 μL。该体系于37℃,恒温震荡(150 r·min-1)一定时间后,取出并立即放至-40 ℃冰箱,冷冻10 min 终止反应,每个样品平行处理3 次。为排除肝微粒体内基质及NADPH 发生系统成分的干扰,配置灭活肝微粒体+NADPH 发生系统+等量溶剂作为空白温孵样品。
2.2.2 样品处理 从冰箱中取上述处理后的温孵反应体系,迅速解冻,加入阿托伐他汀溶液2 μL,涡旋混匀,加入乙酸乙酯1000 μL,涡旋5 min,进行萃取,10 800 r·min-1离心10 min,取上清液900 μL,于40℃水浴下氮气吹干,用乙腈50 μL 复溶,再次涡旋振荡、离心,取上清液进样分析。
2.3 色谱条件
色谱柱:Waters C18柱(2.1 mm×50 mm,1.7 μm),流动相:10 mmol·L-1乙酸铵(pH 4.0)-乙腈(45∶55),流速:0.15 mL·min-1,柱温:30℃,进样量:2 μL,检测波长:245 nm。
2.4 方法学考察
2.4.1 专属性 取肝微粒体温孵样品,按“2.2.2”项下方法处理后测定;用等量溶剂替代瑞格列奈溶液制备空白样品,按“2.2.2”项下方法处理后测定(不加内标);取等量的瑞格列奈对照品溶液和阿托伐他汀对照品溶液进样测定。结果表明,瑞格列奈和阿托伐他汀的保留时间分别为6.25 min和2.34 min,与其他杂质峰分离良好,结果见图1。

图1 高效液相特征色谱图Fig 1 HPLC chromatogram
2.4.2 标准曲线的绘制 以灭活的肝微粒体制备空白温孵液,加入系列浓度的瑞格列奈对照品溶液,配制成终浓度分别为0.6875、1.375、2.75、4.4、5.5 μmol·L-1的模拟温孵样品,按照“2.2.2”项下方法处理后测定。瑞格列奈与阿托伐他汀峰面积比值为纵坐标,横坐标为瑞格列奈浓度,绘制标准曲线,计算回归方程。结果表明,瑞格列奈在0.6875~5.5 μmol·L-1内与峰面积线性关系良好(Y=0.2138X-0.0135,R2=0.9995)。
2.4.3 精密度 制备温孵体系,其中瑞格列奈高、中、低浓度分别为4.4、2.75、1.375 μmol·L-1,每个浓度制备6 份,按照“2.2.2”项下方法于同一日进行处理并测定,计算日内精密度;连续测定5 d,计算日间精密度。结果见表1。
2.4.4 回收试验 制备温孵体系,其中瑞格列奈高、中、低浓度分别为4.4、2.75、1.375 μmol·L-1的温孵体系,每个浓度制备6 份,按照“2.2.2”项下方法处理并测定;根据标准曲线计算得到的测得浓度与相应理论浓度的比值,计算方法回收率;分别进样等量的瑞格列奈对照品溶液和内标对照品溶液,根据温孵体系中瑞格列奈或内标峰面积与等量瑞格列奈或内标对照品溶液峰面积的比值,计算提取回收率。结果见表1。

表1 精密度、准确度和提取回收率Tab 1 Precision,accuracy and extraction recovery
2.5 酶促反应动力学研究
2.5.1 温孵时间的影响 人肝微粒体孵育体系中,瑞格列奈的浓度为5.5 μmol·L-1,人肝微粒体蛋白质量浓度为0.5 mg·mL-1,37℃温孵,分别于10、20、30、40、60 min 取样,处理后进样测定(n=3)。最终选择40 min 为最佳反应孵育时间。结果见图2。

图2 孵育时间对人肝微粒体中瑞格列奈浓度的影响Fig 2 Effect of incubation time on the concentration of repaglinide in human liver microsomes
2.5.2 蛋白浓度的影响 人肝微粒体孵育体系中,肝微粒体蛋白质量浓度依次为1.0、0.7、0.5、0.2、0.1 mg·mL-1,瑞格列奈浓度为5.5 μmol·L-1,温度37℃孵育40 min,孵育完成后,处理并进样测定(n=3),计算瑞格列奈的减少量。瑞格列奈减少量在肝微粒体蛋白质量浓度为0.1~1.0 mg·mL-1内增加,结果见图3。

图3 蛋白浓度对人肝微粒体中瑞格列奈浓度的影响Fig 3 Effect of protein concentration on the concentration of repaglinide in human liver microsomes
2.5.3 酶促反应动力学参数的测定 孵育体系中瑞格列奈的初始浓度依次为5.5、4.4、2.75、1.76、1.375、0.6875 μmol·L-1,人肝微粒体蛋白质量浓度均为0.5 mg·mL-1,37℃孵育40 min,按照“2.2.2”项下方法处理并测定。每个浓度处理3 份样品,计算瑞格列奈平均剩余量。采用底物消除法,应用GraphPad Prism 5.0 软件处理,计算最大反应速率(Vmax)和米氏常数(Km),结果Km值为5.66 μmol·L-1,Vmax为1.71 μmol·min-1·(mg·protein)-1。结果见图4。

图4 瑞格列奈在人肝微粒体中酶促反应动力学Fig 4 Enzymatic kinetics of repaglinide in human liver microsomes
2.6 葛根素对瑞格列奈代谢的影响研究
肝微粒体孵育体系中,葛根素的浓度分别50、25、10、5、2.5、0 μmol·L-1,瑞格列奈的浓度为5.5 μmol·L-1,蛋白质量浓度为0.5 mg·mL-1,37℃孵育40 min,处理后进样测定,计算瑞格列奈剩余量。结果葛根素对瑞格列奈的代谢未产生明显影响(见图5)。
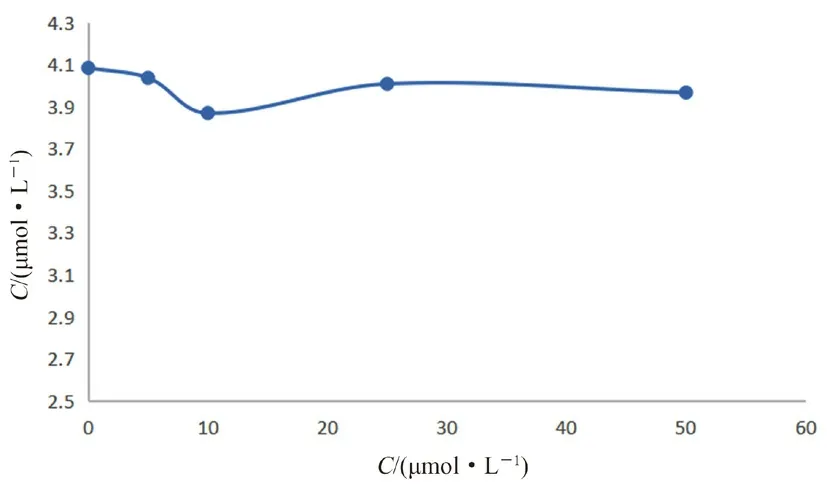
图5 葛根素对瑞格列奈在人肝微粒体中代谢的影响Fig 5 Effect of puerarin on the metabolism of repaglinide in human liver microsomes
3 讨论
目前,基于药物代谢酶的体外药物代谢方法得到广泛应用,如体外肝微粒体孵育、器官灌流、重组肝微粒体酶、细胞模型等。肝微粒体孵育法,不仅操作简便,实验周期短,且重现性好,故本实验选择肝微粒体孵育法进行研究。
孵育时间0~40 min,瑞格列奈的减少量呈线性减少,40~60 min 减少速率减慢。为了实现底物耗尽方法的最佳效用,应使用低酶浓度和短孵育时间[9]。因此,本实验选择40 min 为最佳孵育时间。对于微粒体孵育,使用较低的酶浓度可以更好地预测体内值,且根据所研究的化合物类别,理想条件是酶质量浓度低于0.5 mg·mL-1[9]。综合考虑酶蛋白质量浓度对反应速率的影响,本实验选择0.5 mg·mL-1作为最佳反应蛋白浓度。
瑞格列奈可作为CYP2C8 的探针底物,故通过考察葛根素对瑞格列奈的影响,可进一步考察葛根素对CYP2C8 活性的影响。细胞色素CYP2C8占人体 CYP 酶系总量的 6%~7%,代谢至少1%经Ⅰ相代谢的药物。但目前对于中药及其有效成分对CYP2C8 介导的药物相互作用研究尚不完善。已有研究显示,同为黄酮类化合物的苦参酚Ⅰ、苦参黄酮G 等对CYP2C8 的活性具有较强的抑制作用。然而尚未见葛根素对CYP2C8 活性影响的研究[10]。
本实验结果得出Km=5.66 μmol·L-1。Km值的大小与酶的亲和力成反比,与先前的大鼠肝微粒体孵育实验相比[11],提示瑞格列奈与人肝微粒体具有更强的亲和性。本实验以瑞格列奈为底物,通过建立葛根素与瑞格列奈在人肝微粒体中的共同孵育体系,考察葛根素对瑞格列奈代谢的影响。结果显示,葛根素在0~50 μmol·L-1内,瑞格列奈在人肝微粒体中的代谢没有发生明显变化。因10 μmol·L-1<IC50<50 μmol·L-1,即为弱抑制作用[12],故葛根素对瑞格列奈几乎未产生抑制作用。两药联用可能不会因药物代谢性相互作用而影响疗效和患者的安全性。
当然,体外研究结果并不能代表体内过程,有时与体内过程存在差异。因此,尚需体内研究进行进一步的验证。但体外实验可为体内研究提供理论基础及作用机制分析,对体内研究具有重要意义。
