基于HPLC-CAD指纹图谱结合化学计量学方法分析不同产地北柴胡药材质量
2022-11-16周丽娟杨晓宁王雅芝张超王玉龙孙欣光北京振东光明药物研究院有限公司北京00085山西振东道地药材开发有限公司山西长治04700
周丽娟,杨晓宁*,王雅芝,张超,王玉龙,孙欣光*(.北京振东光明药物研究院有限公司,北京 00085;.山西振东道地药材开发有限公司,山西 长治 04700)
柴胡为伞形科植物柴胡Bupleurum chinenseDC.或狭叶柴胡Bupleurum scorzonerifoliumwilld.的干燥根,前者习称北柴胡,春秋二季采挖,除去茎叶和泥沙,干燥。柴胡具有疏散退热、疏肝解郁、升举阳气等功效,临床用于感冒发热、寒热往来、胸胁胀痛、月经不调、子宫脱垂、脱肛等[1]。药理学研究表明,柴胡具有解热、抗炎、抗肿瘤、保肝、免疫调节等药理作用[2-4]。我国柴胡资源丰富,分布广泛,人工栽种主要以北柴胡为主,且在山西和甘肃等地的栽种面积最大。
柴胡药材含有皂苷、黄酮、挥发油、多糖等多种活性成分[2,5-6],目前多以柴胡皂苷来评价柴胡的质量,2020年版《中国药典》一部“柴胡”药材项下,仅以柴胡皂苷a 和柴胡皂苷d 作为质控指标[1]。中药成分复杂多样,其临床药效的发挥是所含化学成分共同作用的结果,因此,单一或几个成分的含量测定很难全面地评价中药质量,而中药指纹图谱可以从整体上对中药的成分进行分析,能较全面地反映中药质量,体现中药材质量的整体性[7-8],因此本研究建立了柴胡药材的指纹图谱,并对不同产地的柴胡药材进行了研究。
目前关于柴胡药材指纹图谱的研究大多采用紫外检测器(UV)或蒸发光散射检测器(ELSD)[9-12]。UV 灵敏度高、噪声低、线性范围宽,但是不适用于无紫外吸收或弱紫外吸收化合物的分析;ELSD 为通用检测器,但其灵敏度低、重现性较差。电喷雾检测器(CAD)作为一种通用型检测器,其检测不依赖于分析物的分子结构,尤其适用于皂苷类、糖类、生物碱类、脂类化合物等无紫外吸收或弱紫外吸收成分的分析[13-14]。同时CAD 是一个质量敏感型检测器,其检测的响应值与进样成分的含量相关,且具有较高的灵敏度和较低的检测限[15-16],特别适合中药指纹图谱的全面成分分析,可定量化表征其中的化学成分,在中药成分检测及质量研究方面得到广泛应用[17-21]。柴胡皂苷类成分具有较弱的紫外吸收,不适合采用UV 检测,与ELSD 相比CAD 具有更高的灵敏度和更低的检测限,因此选择HPLC-CAD 法建立柴胡药材的指纹图谱。
本研究建立了北柴胡HPLC-CAD 药材指纹图谱方法,标定共有峰,并结合相似度分析、聚类分析(CA)、主成分分析(PCA)和偏最小二乘法-判别分析(PLS-DA)对不同产地北柴胡成分进行成分表征及质量差异研究,为北柴胡药材的质量评价和质量控制提供科学依据。
1 材料
Uitimate 3000 型高效液相色谱仪(赛默飞世尔科技有限公司);ME204/02 型万分之一电子天平(瑞士梅特勒-托利多公司);MSA36S-0CE-DH 型百万分之一电子天平(德国赛多利斯公司);Milli-Q 超纯水仪(美国Millipore 公司);KQ-500DE 型数控超声波清洗器(昆山市超声仪器有限公司);Agilent ZORBAX SB-C18(150 mm×4.6 mm,3.5 μm)。
色谱乙腈、甲醇(FEPRUE);分析纯甲酸(MREDA);纯水(MiLLi-Q 制备)。柴胡皂苷a(批号:110777-201912,纯度:94.8%)、柴胡皂苷d(批号:110778-201912,纯度:96.3%)(中国食品药品检定研究院);柴胡皂苷c(批号:PS000193,纯度:99.65%)、柴胡皂苷e(批号:PS200702-15,纯度:99.94%)(成都普思生物科技股份有限公司);柴胡皂苷f(批号:6131,纯度:99.7%,上海诗丹德标准技术服务有限公司)。北柴胡药材均购自安国药材市场,经山西医科大学高建平教授鉴定为伞形科植物柴胡Bupleurum chinenseDC.的干燥根。
2 方法与结果
2.1 色谱条件
色谱柱Agilent ZORBAX SB-C18(150 mm× 4.6 mm,3.5 μm);流动相为0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱(0~20 min,10%~30%B;20~35 min,30%~35%B;35~60 min,35%~40%B;60~65 min,40%~45%B;65~70 min,45%B;70~85 min,45%~65%B;85~90 min,65%~85%B;90~100 min,85%~90%B;100~105 min,90%~95%B);柱温40℃;流速1.4 mL·min-1;进样量20 μL,CAD 雾化室温度50℃。
2.2 对照品溶液的制备
取柴胡皂苷a、柴胡皂苷c、柴胡皂苷d、柴胡皂苷e、柴胡皂苷f 对照品,分别精密称定,加80%甲醇制成每1 mL 分别含0.10 mg、50 μg、0.15 mg、20 μg、50 μg 的混合对照品溶液。
2.3 供试品溶液的制备
取柴胡药材粉末(过3 号筛),约1.0 g,精密称定,加80%甲醇25 mL,称重,超声处理(500 W,40 kHz)30 min,取出,放冷,用80%甲醇补足减失的重量,摇匀,滤过,即得。
2.4 方法学验证
2.4.1 精密度试验 取柴胡药材(S1),按“2.3”项下方法制备供试品溶液,连续进样6 次。以柴胡皂苷d(13 号峰)的保留时间和峰面积为参照,计算22 个共有峰的相对保留时间和相对峰面积。结果各共有峰的相对峰面积RSD均小于5.0%,相对保留时间RSD均小于1.0%,表明仪器精密度良好。
2.4.2 重复性试验 取柴胡药材(S1),按“2.3”项下方法平行制备6 份供试品溶液。进样检测。以柴胡皂苷d(13 号峰)的保留时间和峰面积为参照,计算22 个共有峰的相对保留时间和相对峰面积。结果各共有峰的相对峰面积RSD均小于5.0%,相对保留时间RSD均小于1.0%,表明方法重复性良好。
2.4.3 稳定性试验 取柴胡药材(S1),按“2.3”项下方法制备供试品溶液,分别在0、4、8、12、20、30、48 h 进样检测。以柴胡皂苷d(13 号峰)的保留时间和峰面积为参照,计算22 个共有峰的相对保留时间和相对峰面积。结果各共有峰的相对峰面积RSD均小于5.0%,相对保留时间RSD均小于1.0%,表明室温放置48 h 内稳定性良好。
2.5 柴胡指纹样品图谱的建立
取16 批不同产地的北柴胡药材,按“2.3”项下方法制备供试品溶液,进样检测。将指纹图谱依次导入《中药色谱指纹图谱相似度评价系统软件》(2012.0 版本)中,以S1 为参考图谱,手动匹配16 批指纹图谱,见图1,根据匹配结果确定22 个共有峰,并生成对照指纹图谱,见图2。通过对照品比对,指认了其中的5 个峰,其中13 号峰(柴胡皂苷d)峰形好,峰面积稳定,分离度较好,选定为指纹图谱的参照峰(S),见图3。

图1 16 批北柴胡药材的指纹图谱Fig 1 Fingerprints for 16 batches of Bupleurum chinense
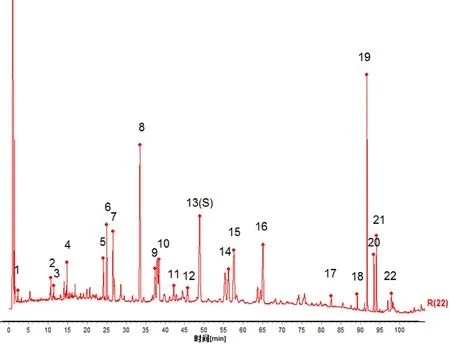
图2 北柴胡药材对照指纹图谱Fig 2 Reference fingerprint of Bupleurum chinense
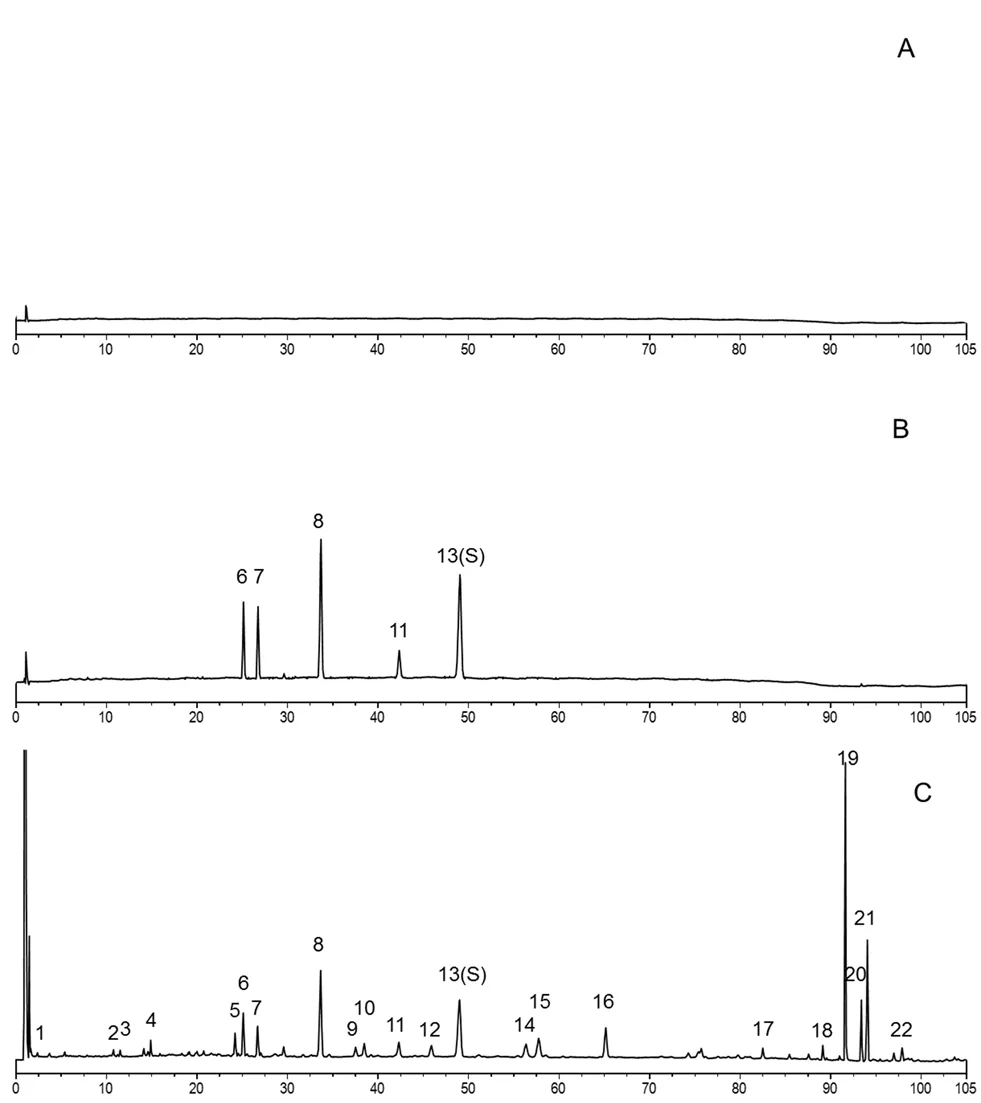
图3 空白溶剂(A)、对照品(B)和样品(C)的色谱图Fig 3 Reference chromatogram of blank solvent(A),control(B)and sample(C)
2.6 化学模式识别分析
2.6.1 相似度分析 采用《中药色谱指纹图谱相似度评价系统软件》计算16 批北柴胡药材与对照指纹图谱的相似度,结果见表1。16 批北柴胡药材与对照指纹图谱的相似度均大于0.90,除样品S8 和S9 外(产地均为陕西),其他14 批样品与对照指纹图谱的相似度在0.919~0.991,可见不同产地的柴胡药材质量相对稳定。
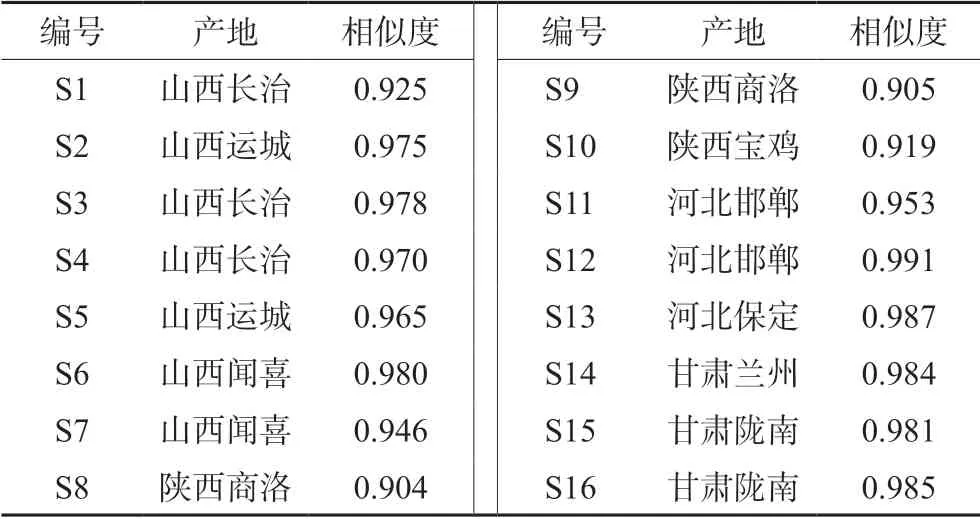
表1 16 批北柴胡样品相似度结果Tab 1 Similarity evaluation of 16 batches of Bupleurum chinense
2.6.2 CA 将16 批样品的22 个共有峰峰面积数据导入SPSS 软件进行CA,采用组间连接法结合欧氏距离的方法对数据进行分析,结果见图4,16 批柴胡药材大致可以被分成两大类(山西一类,陕西、河北和甘肃为一类),其中陕西、河北和甘肃3 个产地的药材中陕西的药材可以单独分成一小类,甘肃和河北的药材没有明显区分。不同产地的北柴胡药材虽然相似度较高,但不同产地的北柴胡药材化学成分仍存在一定差异,从热图可知,22 个指纹特征峰在不同柴胡药材中存在一定差异(见图5)。
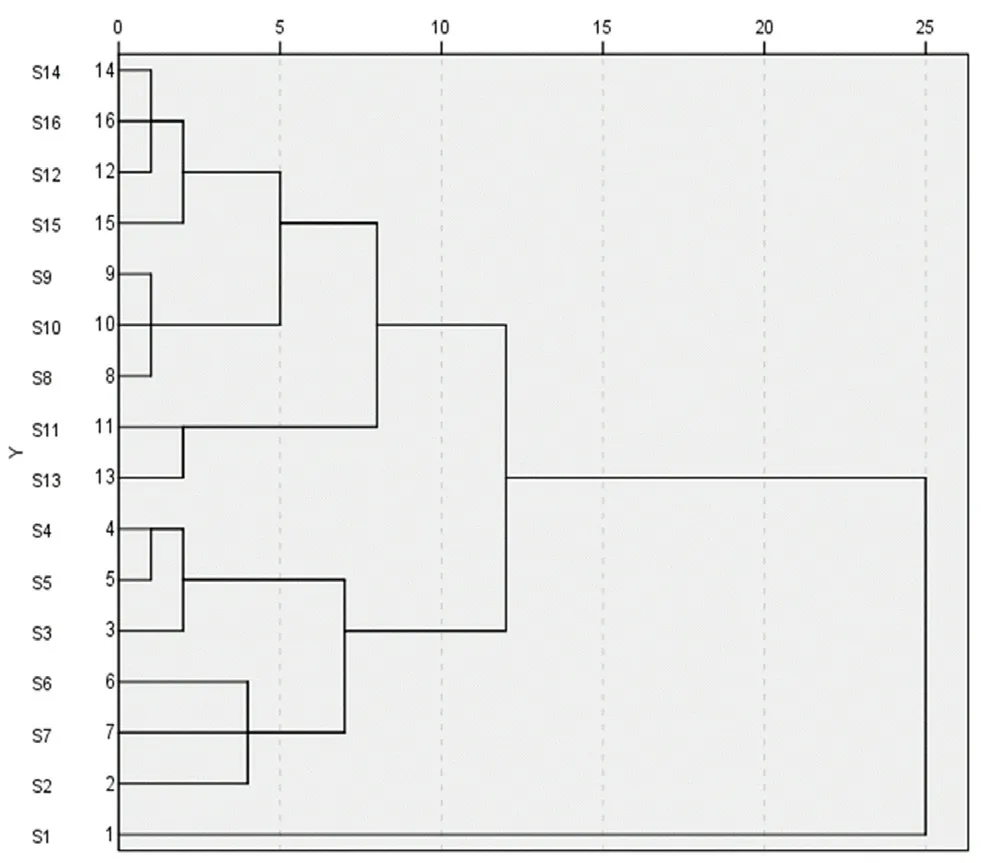
图4 16 批北柴胡药材的聚类分析Fig 4 Cluster analysis based on 16 batches Bupleurum chinense
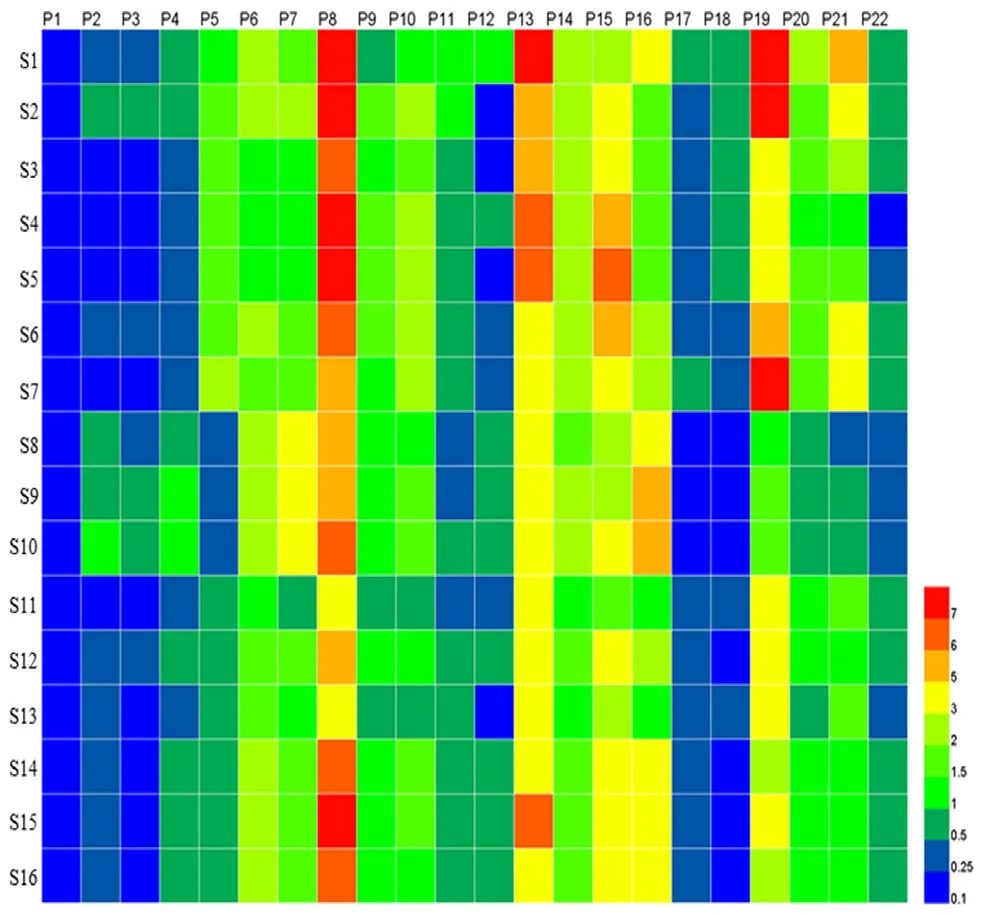
图5 16 批北柴胡药材的22 个指纹特征峰热图Fig 5 Heat-map of 22 comment peaks in 16 batches Bupleurum chinense
2.6.3 PCA、PLS-DA 为寻找不同产地柴胡的质量差异成分,将16 批北柴胡样品的22 个共有峰的峰面积导入SIMCA-P14.1 软件进行PCA,得到PCA 得分图,再进行监督模式识别方法PLSDA 建模分析,获得相应的模型[22-24],如图6所示。4 个产地的16 批北柴胡药材聚类趋势明显,可以分为三类,S1、S2、S3、S4、S5、S6、S7分为一类(产地均为山西)、S8、S9、S10 分为一类(产地均为陕西)、其余样品分为一类(产地为甘肃和河北),与聚类分析结果基本一致。
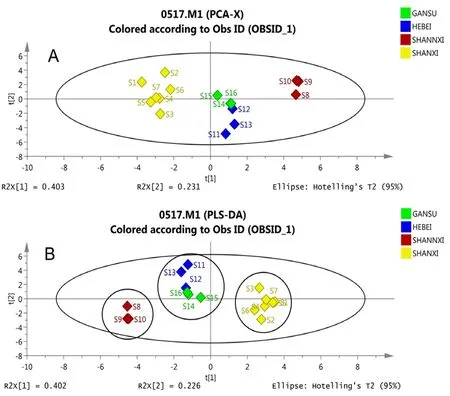
图6 16 批北柴胡药材的PCA(A)和OPLS-DA(B)得分图Fig 6 PCA(A)and OPLS-DA(B)scores plots from principle components analysis of Bupleurum chinense
为进一步说明各个共有峰变量差异大小,采用变量重要性投影(VIP)法筛选导致样品分类差异较大的成分,各成分的VIP 值见图7。VIP是筛选差异性化合物的重要指标,VIP 值越高,对组间差异的影响越大。以VIP >1 为标准,筛选出对样品分类起关键性作用的9 个成分,按照VIP 大小依次为色谱峰6(柴胡皂苷c)、色谱峰16、色谱峰3、色谱峰18、色谱峰14、色谱峰7(柴胡皂苷f)、色谱峰8(柴胡皂苷a)、色谱峰1、色谱峰5,这些成分初步拟订为不同产地柴胡药材质量差异的主要化学标志物。
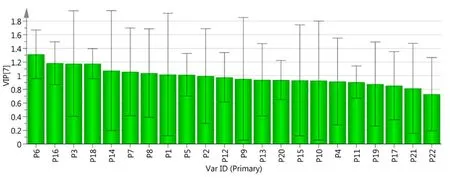
图7 北柴胡PLS-DA 的VIP 值Fig 7 PLS-DA VIP value diagram of Bupleurum chinense
3 讨论
建立药材系统、全面的指纹图谱是进行药材质量评价的有效办法之一[25-26]。本研究建立了基于HPLC-CAD 的柴胡指纹图谱方法,对收集于具有代表性地域的北柴胡药材进行全面成分表征及质量评价,能够表征出柴胡药材更加全面的色谱峰信息,特别是具有弱紫外吸收的皂苷类成分在CAD 检测器下得到了良好的检测和分离。近年来,CAD 检测器因其自身特点,在中药皂苷类检测方面具有明显的优势而被广泛使用[27-29]。
本研究采用指纹图谱结合相似度评价、CA、PCA 和PLS-DA 等多元统计分析方法,对不同产地的柴胡药材进行分析评价,结果具有良好的一致性,说明此方法能够对药材质量进行全面反映,可以用作中药整体质量控制的有效方法[24]。
北柴胡药材之间的相似度较高,但不同产地的北柴胡药材在成分含量上仍存在差异[30-31]。本研究建立的HPLC-CAD 指纹图谱结合PCA 分析表明不同产地北柴胡药材化学成分存在差异,同时利用PLS-DA 分析筛选出造成不同产地北柴胡差异性的9 个成分,其中包括2020年版《中国药典》一部项下柴胡药材的含量检测指标柴胡皂苷a。后续还需对不同产地北柴胡药材成分含量差异进行更深入的研究,以期为北柴胡的质量控制以及资源利用提供依据。
综上所述,本文建立了一种简便、高效的HPLC-CAD 指纹图谱方法,结合化学计量学方法可用于北柴胡药材差异分析及质量评价。所建立的HPLC-CAD 指纹图谱可全面科学地为北柴胡药材质量评价体系建立提供参考。
