mTOR信号通路介导短链脂肪酸调控PLIN3表达促进乳脂合成
2022-11-11侯晓明张金友
侯晓明,江 怡,刘 灿,杨 洋,张金友
(1.东北农业大学细胞与遗传工程黑龙江省重点实验室,哈尔滨 150030;2.黑龙江省农垦科学院畜牧兽医研究所,哈尔滨 150038)
乳脂是牛乳中重要营养成分,也是牛乳独特风味构成因素之一。甘油三酯(Triglyceride,TAG)在乳脂中占比最大,约占脂类总量98%[1]。乳脂中TAG在内质网中合成,新生TAG由内质网膜包裹,形成细胞内乳脂滴。PLIN3是PAT蛋白家族成员,最早在胎盘中被发现[2]。PLIN3为脂滴结合蛋白,主要富集在以TAG为核心的细胞内脂滴膜上[3]。PLIN3蛋白水平与细胞中TAG水平直接相关,抑制PLIN3表达可阻止细胞内脂滴发育,减少TAG向脂滴掺入,从而影响脂类在细胞内积累[4]。Pavlova等对人乳样本进行质谱分析发现PLIN3与乳中脂质含量存在显著正相关,表明PLIN3对乳脂合成具有促进作用[5]。Redwan和Chong等研究发现,在牛脂滴中,小的乳脂滴膜上存在PLIN3表达[6-7]。本试验前期研究发现PLIN3在泌乳期奶牛乳腺组织中高表达,表达量远高于其他PLIN家族成员,提示PLIN3可能与泌乳奶牛乳脂合成相关。PLIN3在泌乳奶牛乳腺上皮细胞中的具体功能和调节机制尚不明确。
短链脂肪酸是泌乳奶牛乳脂合成的底物,也可作为调节物调控乳脂合成[8]。mTOR是哺乳动物雷帕霉素靶蛋白关键信号分子,属于磷脂酰肌醇3-激酶相关激酶家族。mTOR在细胞内可感知营养信号,参与乳腺发育和泌乳调节[9]。张花等研究表明短链脂肪酸以剂量依赖方式激活mTOR信号通路,促进牛乳腺上皮细胞中乳脂合成[10]。Cheng等在牛乳腺上皮细胞中研究发现短链脂肪酸可通过诱导mTOR信号通路分子S6K磷酸化,提高SREBP1表达,上调脂肪酸合成相关酶ACC和FASN的mRNA表达水平[11]。PLIN3作为泌乳奶牛乳腺组织中高表达的脂滴相关蛋白,短链脂肪酸是否可诱导其表达上调,以及短链脂肪酸对PLIN3表达的诱导作用是否与mTOR信号通路相关目前尚不清楚。
为阐明PLIN3在泌乳奶牛乳脂合成中的作用及调节方式,本研究以泌乳期奶牛乳腺上皮细胞为试验材料,通过基因过表达及Western bolt方法检测PLIN3对乳脂合成的影响,利用乙酸和β-羟丁酸诱导乳脂合成,结合添加信号通路抑制剂方法研究mTOR信号通路在短链脂肪酸诱导的PLIN3表达和乳脂合成之间信号传递作用,旨在明确奶牛乳腺泌乳过程中PLIN3调节乳脂合成分子机制。
1 材料与方法
1.1 主要试剂和仪器
主要试剂:Ⅰ型胶原酶(购自上海Sigma),DMEM/F12(购自美国Life technology),TAG检测试剂盒(购自北京普利来基因技术有限公司),BCA浓度检测试剂盒(购自大连TaKaRa),EcoRⅠ和HindⅢ限制性内切酶(购自美国Thermo),Lipofectamine 2000(购自美国Invitrogen),雷帕霉素(购自北京Biotopped),PLIN3抗体、β-ACTIN抗体、山羊抗兔二抗、山羊抗鼠二抗(购自武汉ABclonal),mTOR、P70S6K、4E-BP1、p-mTOR、p-P70S6K、p-4E-BP1、CK18抗体(购自美国Cell Signaling Technology)BODIPY493/503(购自美国Invitrogen)、抗荧光淬灭封片剂(购自上海碧云天生物技术有限公司)。
主要仪器:CO2细胞培养箱(购自美国Thermo),激光共聚焦显微镜(购自德国Leica),PCR仪(购自美国Eppendorf),酶标仪(购自美国Thermo),化学发光成像系统(购自北京赛智生物制品有限公司)。
1.2 牛乳腺上皮细胞培养、纯化及处理
本试验选取泌乳期的中国荷斯坦奶牛乳腺组织,采用胶原酶消化法分离乳腺上皮细胞。具体步骤如下:将新鲜乳腺实体组织块先用75%酒精冲洗,后用含青霉素(100 U·mL-1)和链霉素(100 μg·mL-1)的D-Hanks清洗2~3次,于超净工作台中使用干净无菌剪刀剪至肉糜状,置于胶原酶中37℃充分消化。使用400目铜网过滤,滤液室温1 000 r·min-1离心10 min沉淀细胞,使用无血清DMEM/F12重悬,1 000 r·min-1离心10 min,重复2~3次,完全培养基重悬铺瓶,放入5% CO2的37℃培养箱中培养。待单层细胞长满,利用成纤维细胞与牛乳腺上皮细胞对胰酶敏感性不同,纯化上皮细胞。
当细胞生长至融合度80%,将细胞培养液更换成含8 mmol·L-1乙酸钠和1 mmol·L-1BHBA的培养液。处理组细胞加入0.1 mmol·L-1雷帕霉素,对照组添加DMSO。48 h后收集细胞,用于Western blot检测。
1.3 牛乳腺上皮细胞鉴定及脂滴观察
采用免疫荧光方法检测细胞中CK18表达,将纯化获得的牛乳腺上皮细胞传代至3.5 cm细胞培养皿中,待细胞生长至80%融合度,弃培养液,PBS清洗细胞两次,每次5 min。采用4%多聚甲醛室温固定20 min后,采用10%马血清37℃封闭1 h。弃封闭液,加入PBST稀释的CK18抗体(1∶50)4℃孵育过夜。PBS清洗细胞3次后,加入PBST稀释的FITC标记的二抗(1∶200),37℃孵育1 h,含DAPI的封片剂封片后,激光共聚焦显微镜观察。
采用BODIPY标记细胞中的脂滴,将纯化获得的牛乳腺上皮细胞传代至3.5 cm细胞培养皿中,采用4%多聚甲醛室温固定20 min,PBS清洗细胞3次后用1 μg·mL-1BODIPY 37℃避光孵育细胞20 min。PBS清洗细胞3次后,含DAPI的封片剂封片,激光共聚焦显微镜观察。
1.4 牛PLIN3表达载体构建
利用组织/细胞RNA微量提取试剂盒提取泌乳期乳腺上皮细胞RNA,反转成cDNA。以反转录获得的cDNA为模板,利用PLIN3基因特异性引物进行PCR扩增,引物见表1。将PLIN3基因PCR产物进行胶回收,同pcDNA3.1载体分别进行EcoRⅠ和HindⅢ双酶切。回收酶切产物用T4连接酶连接,连接产物转化进入大肠杆菌感受态细胞,涂板过夜培养获得单菌落,挑菌鉴定及测序后获得正确质粒。

表1 PCR引物序列Table 1 Sequences of PCR primer
1.5 转染
将细胞接种至六孔板中,待细胞生长至70%融合度,采用Lipofectamine 2000试剂转染。对照组细胞中转染2.5 μg pcDNA3.1,处理组细胞中转染2.5 μg pcDNA3.1-PLIN3,48 h后收集细胞进行后续试验。
1.6 Western blot检测mTOR信号通路分子及PLIN3表达
采用含10%SDS的蛋白裂解液充分裂解细胞,将裂解液收集于蛋白样品管,100℃煮沸10 min使蛋白变性。将蛋白经10% SDS-PAGE凝胶电泳分离后转移到硝酸纤维素膜,把硝酸纤维素膜放入含5%脱脂乳、0.1%(V/V)Tween-20的Tris缓冲液中封闭2 h。4℃下采用PLIN3、mTOR、p70S6K、4EBP1、p-mTOR、p-p70S6K、p-4E-BP1特异性抗体(所有抗体皆为兔源,1∶1 000稀释)孵育过夜。TBST清洗3次,将膜与HRP标记的山羊抗兔的二抗在37℃下孵育1h。TBST清洗3次后,采用增强化学发光检测系统检测印迹。
1.7 TAG含量测定
采用裂解液低温处理细胞约10 min,短暂离心后收集上清加热10 min,用于普利莱TAG检测试剂盒对不同处理组的细胞样品中的TAG进行定量测定。相应细胞样品的蛋白浓度由BCA浓度检测试剂盒测定,每个处理重复3次。
1.8 数据处理与统计分析
引物由PREMIER 5.0软件设计;Western blot条带使用Image-Pro Plus 6.0进行灰度扫描;试验数据通过GraphPad Prism 6进行统计分析,采用t检验方法对两组不同处理数据进行统计检验。
2 结果与分析
2.1 奶牛乳腺上皮细胞培养与鉴定
本研究使用的原代细胞,由消化法分离获取利用成纤维细胞与上皮细胞对胰酶敏感性不同的特点,纯化获得牛乳腺上皮细胞。细胞呈梭形,聚集生长。CK18免疫荧光结果显示细胞核呈蓝色,视野中所有细胞均有CK18表达,呈绿色,丝状分布于细胞核周围(见图1A)。采用BODIPY标记细胞内脂滴,可观察到乳腺上皮细胞有大量脂滴存在(见图1B),表明该细胞具有乳脂合成能力。
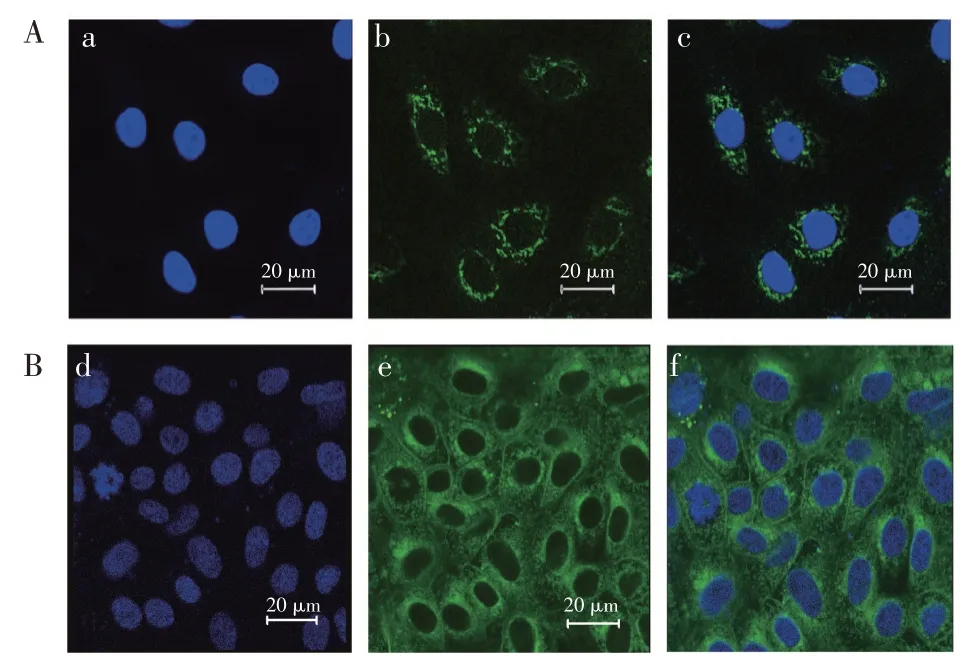
图1 奶牛乳腺上皮细胞培养与鉴定Fig.1 Identification of cultured mammary epithelial cells of dairy cows
2.2 PLIN3调节奶牛乳腺上皮细胞乳脂的合成
为研究PLIN3在奶牛乳腺上皮细胞乳脂合成中作用,本试验构建牛pcDNA3.1-PLIN3质粒并转染至奶牛乳腺上皮细胞,并以转染pcDNA3.1(+)质粒的奶牛乳腺上皮细胞作为阴性对照。Western blot结果显示pcDNA3.1-PLIN3转染的乳腺上皮细胞中PLIN3基因表达高出对照组约3倍(见图2A、B);PLIN3过表达细胞中TAG含量显著高于对照组(见图2C;P<0.05),提示PLIN3可正向调节奶牛乳腺上皮细胞TAG合成。

图2 PLIN3对奶牛乳腺上皮细胞中乳脂合成的影响Fig.2 Effects of PLIN3 on milk fat synthesis in mammary epithelial cells of dairy cows
2.3 短链脂肪酸对奶牛乳腺上皮细胞中PLIN3表达的调节
采用8 mmol·L-1乙酸钠和1 mmol·L-1BHBA处理奶牛乳腺上皮细胞,Western blot结果显示与对照组比较,乙酸钠和BHBA处理组中PLIN3蛋白表达极显著升高(见图3A、B;P<0.01)。与对照组相比,乙酸钠和BHBA处理奶牛乳腺上皮细胞中TAG含量极显著增加(见图3C;P<0.01)。该结果显示乙酸钠和BHBA上调脂滴相关蛋白PLIN3表达,诱导细胞中乳脂合成。

图3 短链脂肪酸对PLIN3表达的影响Fig.3 Effects of short-chain fatty acids on PLIN3 expression
2.4 短链脂肪酸通过mTOR信号通路调节PLIN3表达
采用8 mmol·L-1乙酸钠和1 mmol·L-1BHBA处理奶牛乳腺上皮细胞,检测mTORC1信号通路相关蛋白变化。与对照组比较,乙酸钠和BHBA处理组中p-mTOR、p-P70S6K以及p-4E-BP1表达极显著增加(见图4A、B;P<0.01)。在添加乙酸钠和BHBA基础上添加雷帕霉素,抑制mTORC1活性,Western blot结果显示mTORC1信号通路分子p-mTORC1、p-P70S6K以及p-4E-BP1表达降低,PLIN3表达以及乳脂合成相关基因ACC、FASN表达也相应降低(见图4C),且细胞中TAG含量显著下降(见图4D;P<0.05)。以上结果提示短链脂肪酸可通过mTORC1信号通路调节PLIN3表达,调节乳脂合成。

图4 短链脂肪酸通过mTORC1信号通路调节PLIN3表达及乳脂合成Fig.4 Short-chain fatty acids regulate PLIN3 expression and milk fat synthesis through mTORC1 signaling pathway
3 讨论
泌乳奶牛乳腺是乳脂合成旺盛器官,乳脂中各种脂类均在乳腺上皮细胞中合成[11]。本文利用体外培养的奶牛乳腺上皮细胞作为平台研究泌乳奶牛乳脂合成的调节。通过对分离培养的奶牛乳腺上皮细胞进行角蛋白18和脂滴荧光标记染色可知,试验获得细胞为纯化乳腺上皮细胞,具有乳脂合成能力,表明其适于乳脂合成调控的相关研究。
PLIN3为脂滴相关蛋白,在脂类合成旺盛场所,如肝细胞、脂肪细胞、乳腺上皮细胞、肠细胞、巨噬细胞中均检测到PLIN3表达,提示其与脂类代谢密切相关[12-14]。在饥饿培养的HEK293T细胞中,PLIN3活性降低导致细胞内脂解增强,脂肪酸氧化分解增加[15-16]。在PLIN3基因敲除的小鼠中也可观察到脂解作用增强,提示PLIN3表达与脂类合成呈正相关[17]。Carroll等研究显示PLIN3在正常生理状态下广泛存在于细胞质中[18]。在脂类合成过程中,PLIN3可通过其N端包含的11-mer螺旋重复序列与细胞内脂滴相互结合[19]。在Hela细胞TAG快速合成时期,PLIN3从细胞质转位到脂滴表面,促进脂类积累;当PLIN3表达被抑制时,TAG合成减少[20-21]。徐会芬研究报道在奶山羊乳腺上皮细胞中存在PLIN3表达,当乳脂合成相关转录因子SREBP1表达下调时,PLIN3表达降低,导致细胞内脂类合成下降,脂解增强[22]。体外培养试验也表明在奶牛乳腺上皮细胞中有PLIN3蛋白表达,PLIN3过表达显著提高细胞中TAG合成,表明PLIN3表达对泌乳奶牛乳脂合成具有促进作用。
乙酸与β-羟基丁酸是泌乳反刍动物乳腺中乳脂合成前体物质。宋书媛和张娜等研究表明在体外培养的奶牛乳腺上皮细胞中,8 mmol·L-1乙酸和1 mmol·L-1β-羟基丁酸显著提高奶牛乳腺上皮细胞中TAG含量,同时上调脂类合成相关基因ACC、ACSS2、FASN、DGAT1、PPARG以及SREBP1的mRNA及蛋白水平表达[23-24]。本研究结果显示,在泌乳奶牛乳腺上皮细胞中,8 mmol·L-1乙酸和1 mmol·L-1β-羟基丁酸可诱导PLIN3基因表达上调,提示短链脂肪酸是PLIN3上游营养调节物,通过上调PLIN3表达促进乳脂合成。这一结果与Fan等在小鼠的研究结论一致,即PLIN3表达受游离脂肪酸诱导[25]。在泌乳奶牛乳腺中mTOR信号通路虽然可将外源营养信号传递到细胞内上调相应基因表达,促进脂类合成,但尚未有报道表明PLIN3是mTOR信号通路下游靶蛋白。仅Garcia-Macla等在肝脏细胞中发现mTOR与PLIN3在脂滴表面存在相互作用关系[26]。本研究结果显示乙酸和β-羟基丁酸处理可激活奶牛乳腺上皮细胞中mTOR信号通路。当采用雷帕霉素抑制乙酸和β-羟基丁酸激活mTOR,其下游信号分子P70S6K及4E-BP1的磷酸化水平显著降低,乙酸和β-羟基丁酸对PLIN3表达的诱导作用也被抑制。该结果表明,在短链脂肪酸诱导的乳脂合成过程中,mTOR信号通路通过调节脂滴相关蛋白PLIN3表达,促进乳脂合成过程。
4 结论
综上,PLIN3与奶牛乳腺上皮细胞中乳脂合成密切相关。乙酸和β-羟基丁酸通过激活mTOR信号通路调节PLIN3表达,促进乳脂合成,该研究结果可为深入研究泌乳奶牛乳脂合成调控机制提供理论支持。
