西瓜果皮颜色及单性花关键基因定位与候选基因筛选
2022-11-11栾非时倪博新刘宏宇
栾非时,倪博新,刘宏宇,刘 识
(1.农业农村部东北地区园艺作物生物学与种质创制重点实验室,哈尔滨 150030;2.东北农业大学园艺园林学院,哈尔滨 150030)
西 瓜[Citrullus lanatus(Thunb.)Matsumura&Nakai]是全球受欢迎水果之一,种植广泛。中国作为西瓜生产和消费大国,西瓜产业发展迅速,产量、面积均位居世界第一[1]。20世纪30年代以来各国研究者围绕西瓜性状开展遗传研究,如果肉颜色[2]、果实形状和大小[3]、果皮相关性状[4-5],开花习性等重要目标性状[6]。西瓜果实外部形态分为果实形状、表皮颜色、条纹(清晰或扩散)、条纹颜色和宽度等。内部形态主要包括果皮厚度、果肉颜色和硬度。西瓜果皮外观影响消费者评价标准,是重要育种性状,选择符合大众期望的果皮外部性状是育种主要目标。20世纪30年代末和40年代初,研究人员建立关于西瓜果皮表面相关性状遗传模型,西瓜果皮颜色及条纹由3个等位基因G、gs和g控制,控制条纹的基因gs对等位基因G(深绿色果皮)为隐性,但gs对浅绿色果皮g为显性[3,7]。Lou和Wehner在上述研究基础上,提出西瓜果皮和条纹颜色遗传模式,G基因座上有5个等位基因:G(深绿色果皮)、gW(果皮宽条纹)、gM(果皮中宽条纹)、gN(果皮窄条纹)和g(浅绿色表皮),显性效应为G>gW>gM>gN>g[8]。Park等将控制西瓜黄色果皮的基因Dgo定位到4号染色体前端[9]。Yang等对黄-绿色果皮、深绿-浅绿色果皮,有无条纹3个控制果皮表型的性状开展遗传和连锁分析发现,3个性状均受单基因控制,其中黄色果皮对绿色果皮为显性,深绿色果皮对浅绿色果皮为显性,条纹对无条纹为显性[10]。
植物授粉率和座果率与植株体性别表达关系密切。被子植物花器官包括雌花、雄花和完全花,不同组合方式使植株以7种主要性别形式存在:雌雄异花同株性型、雄全同株性型、雌全同株性型、雌花雄花完全花性型、完全花株性型、全雌株和全雄株性型[11]。国内外研究学者已对葫芦科作物性别分化开展大量研究。黄瓜植株性别由三对等位基因共同决定,分别为M/m、F/f和A/a基因,其中M基因控制单性花发育,m基因控制完全花发育,F基因控制雌花发育,a基因参与控制雄性系发育[12-14]。甜瓜性别分化受3个基因控制,为a、g、m基因,a基因与雄全同株发育相关;g基因控制全雌株性状;m基因与雌全同株和三体同株性型相关[15]。西瓜中,Rosa以西瓜雌雄异花同株和雄全同株为材料开展遗传分析,认为西瓜雄全同株受隐性单基因a控制[16]。Jiang和Lin认为隐性单基因gy控制西瓜全雌株性型[17]。本研究以浅绿色果皮雄全同株材料ZXG1555、绿色果皮雌雄异花同株材料COS为亲本,构建F2代群体及两组极端性状基因池(绿色-浅绿色果皮、单性花-两性花),结合BSA-seq与亲本重测序数据,利用InDel和CAPS标记对F2群体作基因分型,缩小定位区间,分析区间内基因,筛选并初步推测候选基因。
1 材料与方法
1.1 植物材料
母本(P1)为ZXG1555浅绿色果皮,雄全同株,雌花为两性花(由国家西甜瓜种质资源中期库提供);父本(P2)为Cream of Saskatchewan(简称“COS”)绿色果皮,雌雄异花同株,雌花为单性花(由原美国农业部南部研究中心Angela R.Davis博士提供)。亲本杂交获得F1代,F1自交获得F2代。2021年春季,P1(15株)、P2(15株)、F1(15株)和F2(216株)植株在东北农业大学向阳试验示范基地种植;2021年秋季,播种200株F2于东北农业大学设施园艺工程中心育种温室内,全部采用随机区组试验设计播种,双蔓整枝。
1.2 表型调查与统计分析
授 粉40~45 d后,收 获P1、P2、F1和F2代 果实,直接观察果皮表面颜色情况并拍照保存,统计果皮颜色分离情况,作卡方检验,明确果皮颜色性状在群体中遗传规律。
分别于2021年春秋两季晴天清晨对开放雌花作表型统计,记录每朵雌花上雄蕊数量,每株至少统计4朵雌花。根据Martínez等[18]定义的两性花指数(Andromonoecious index,AI值)对雌花计算AI值及分类,将无雄蕊发育的单性雌花定义为AI=1,雄蕊数为1和2或雄蕊不产生花粉的两性花AI=2,雄蕊数大于或等于3且产生花粉的两性花AI=3。计算分离群体中各单株AI平均值,AI<1.2雌花为单性花,AI>1.2雌花为非单性花。调查比例,使用Graphpad Prism 8.0绘制AI值在F2代群体中频率分布直方图。
1.3 BSA-seq及基因初步定位
1.3.1 DNA提取及BSA-seq分析
采集P1、P2、F1、F2代单株幼嫩叶片并存放于-80℃冰箱中,采用改良CTAB(十六烷基三甲基溴化铵)法提取基因组DNA,经1%琼脂糖凝胶电泳和DNA紫外分光光度计检验DNA质量和纯度。
于春季F2群体中选择绿色和浅绿色果皮单株各20株,提取基因组DNA,等量混合,建立绿色-浅绿色基因池;选择单性花(AI值为1)和两性花(AI值为3)各20株,提取基因组DNA等量混合,构建单性花-两性花基因池,将构建的基因池及亲本DNA样品送至深圳华大基因科技有限公司测序。于Illumina HiSeq XTen测序平台测序,作BSA-seq分析,亲本及各基因池测序深度为20×,以97103 V2为参考基因组(http://cucurbitgenomics.org/organism/21)。
1.3.2 分子标记开发
根据BSA-seq结果及亲本重测序数据,抽取亲本BSA-seq结果区间序列,查看区间内InDel变异,选择插入或缺失片段大于5 bp位点前后各500 bp序列,设计引物。对于定位区间内的SNP位点,选择位点上下游各500~700 bp序列,利用SNP2CAPS软 件[19]及5种 限 制 性 内 切 酶(TaqI、EcoR I、BamH I、MspI、XhoI)筛选位于酶切位点处SNP突变,将其转化为CAPS标记,采用Primer Premier 5.0软件设计引物,引物序列由上海生工生物工程技术服务公司合成。
1.3.3 F2代群体基因分型与分子标记数据统计
利用亲本ZXG1555和COS及其F1代筛选具有共显性多态性分子标记,果皮颜色性状利用春季收获F2代进行基因分型;单性花性状分别对春秋两季F2代单株进行基因分型。PCR体系为1 μL DNA,上下游引物各0.5 μL,dNTP 0.5 μL,10×PCR buffer(含Mg2+)1 μL,Taq酶0.1 μL。PCR程序使用降落式PCR扩增,反应程序参照Amanullah等[20]。InDel标记PCR产物直接经8%聚丙烯酰胺凝胶在220 V、400 mA下电泳1 h,银染法显影;CAPS标记PCR产物使用相应限制性内切酶进行酶切反应后(TaqI在65℃下酶切,其他限制性内切酶均于37℃下反应3~4 h),1%琼脂糖凝胶电泳检验。
分子标记条带统计,与父本COS相同条带记为A,与母本ZXG1555相同条带记为B,含有双亲条带杂合类型单株记为H。使用Microsoft®Excel 2007统计带型,在表现为隐性性状单株中利用分子标记检测重组事件,缩短定位区间。
1.3.4 候选基因筛选
选择亲本COS及其他6份果皮绿色、单性花西瓜品种(W1-105、W1-92、W1-61、W1-17、W1-1、LSW-177)基因组测序数据与亲本ZXG1555(浅绿色果皮、两性花)基因组数据作对比,利用IGV(Integrative genomics viewer)软件分析两种性状定位区间内候选基因编码区(Coding sequence)序列变异情况,候选基因序列和氨基酸变异使用DNAMAN 6.0(美国Lynno Biosoft)软件作比对,筛选候选基因。
2 结果与分析
2.1 西瓜果皮颜色性状遗传分析
母本ZXG1555表现为浅绿色果皮,父本COS为绿色果皮,F1表现为绿色果皮,与父本一致,F2代群体中共产生绿色果皮和浅绿色果皮两种表型(见图1),其中绿色果皮为150株,浅绿色果皮37株,经卡方检验,符合3∶1遗传分离比例(χ2=2.71,P=0.10),上述结果表明,浅绿色果皮性状由单隐性基因调控。

图1 亲本P1、P2及F1、F2果皮性状表型Fig.1 Peel trait of P1,P2,and F1,F2
2.2 西瓜单性花性状遗传分析
母本ZXG1555(P1)雌花为两性花,父本COS(P2)雌花为单性花,F1表现为两性花,与ZXG1555相同,说明单性花为隐性性状。F2代分离群体中包含单性花和两性花,其中两性花中雄蕊数量由1~5个不等(见图2),计算每个单株AI值平均值作为表型数据,2021年春季调查获得有效数据单株为187株(见图3a),其中AI>1.2(非单性花)植株数为129株,AI<1.2(单性花)植株数为58株,通过卡方检验,符合3∶1(χ2=3.6,P=0.057);2021年秋季共获得有效数据单株137株,其中AI>1.2(非单性花)植株数为84株,AI<1.2(单性花)植株数为53株(见图3b),单性花比例升高。由此初步推断,存在主效隐性基因调控西瓜单性花性状,且环境因素影响单性花形成。

图2 亲本P1、P2及F1、F2雌花性状表型Fig.2 Female flower trait of P1,P2,and F1,F2
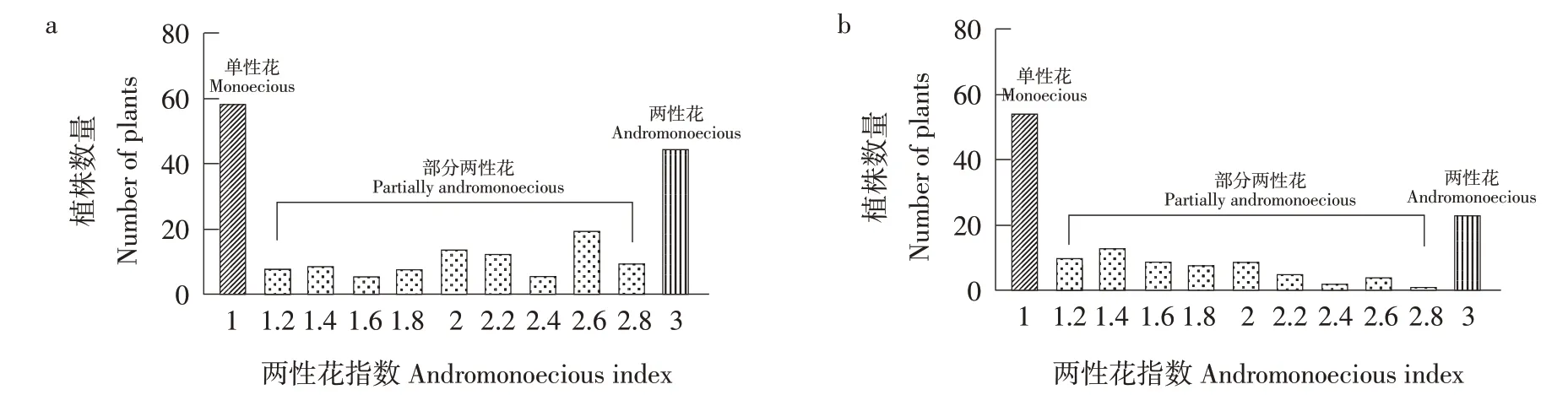
图3 F2雌花AI值频率分布Fig.3 Frequency distribution of AI value of felame flower trait in F2
2.3 西瓜果皮关键基因定位与候选基因筛选
BSA-seq结果显示,在9号染色体上获得与果皮颜色连锁的染色体区段,物理距离为9 231 575~14 532 222 bp(约5.3 Mb)。在区间内设计40对In-Del引物,经筛选获得20对具有多态性分子标记,选择其中13个代表性分子标记,从2021年春季收获的187个F2代群体中对37株具有隐性性状(浅绿色果皮)单株进行基因分型,其中13个单株检测到重组事件,区间缩至12 625 472~13 732 411 bp,区间长度1.1 Mb(见图4)。

图4 西瓜果皮颜色基因定位结果Fig.4 Genetic mapping of rind color gene in watermelon
定位区间内共包含37个候选基因,利用两亲本及其他6份果皮均为绿色西瓜材料基因组重测序数据,检测37个候选基因中仅在浅绿色果皮ZXG1555中发生突变,利用DNAMAN软件分析突变是否造成氨基酸序列改变。结果表明,37个候选基因中,22个基因在编码区存在非同义突变(见表1)。通过葫芦科数据库及拟南芥官网(https://www.arabidopsis.org/)分析候选基因来源及代谢途径。经筛选初步推测Cla97C09G175170为浅绿色果皮性状候选基因,Cla97C09G175170编码Two-component response regulator-like protein APRR2,在西瓜及其他葫芦科作物中,认为APRR2基因与叶绿素代谢有关。本试验中,Cla97C09G175170编码区在ZXG1555中存在三处非同义突变,第585个碱基由G突变为A使第195位氨基酸由甲硫氨酸变为异亮氨酸;第595个碱基由A突变为C使第199个氨基酸由甲硫氨酸变为亮氨酸;第1496位碱基由C突变为T,该处氨基酸由脯氨酸变为异亮氨酸。
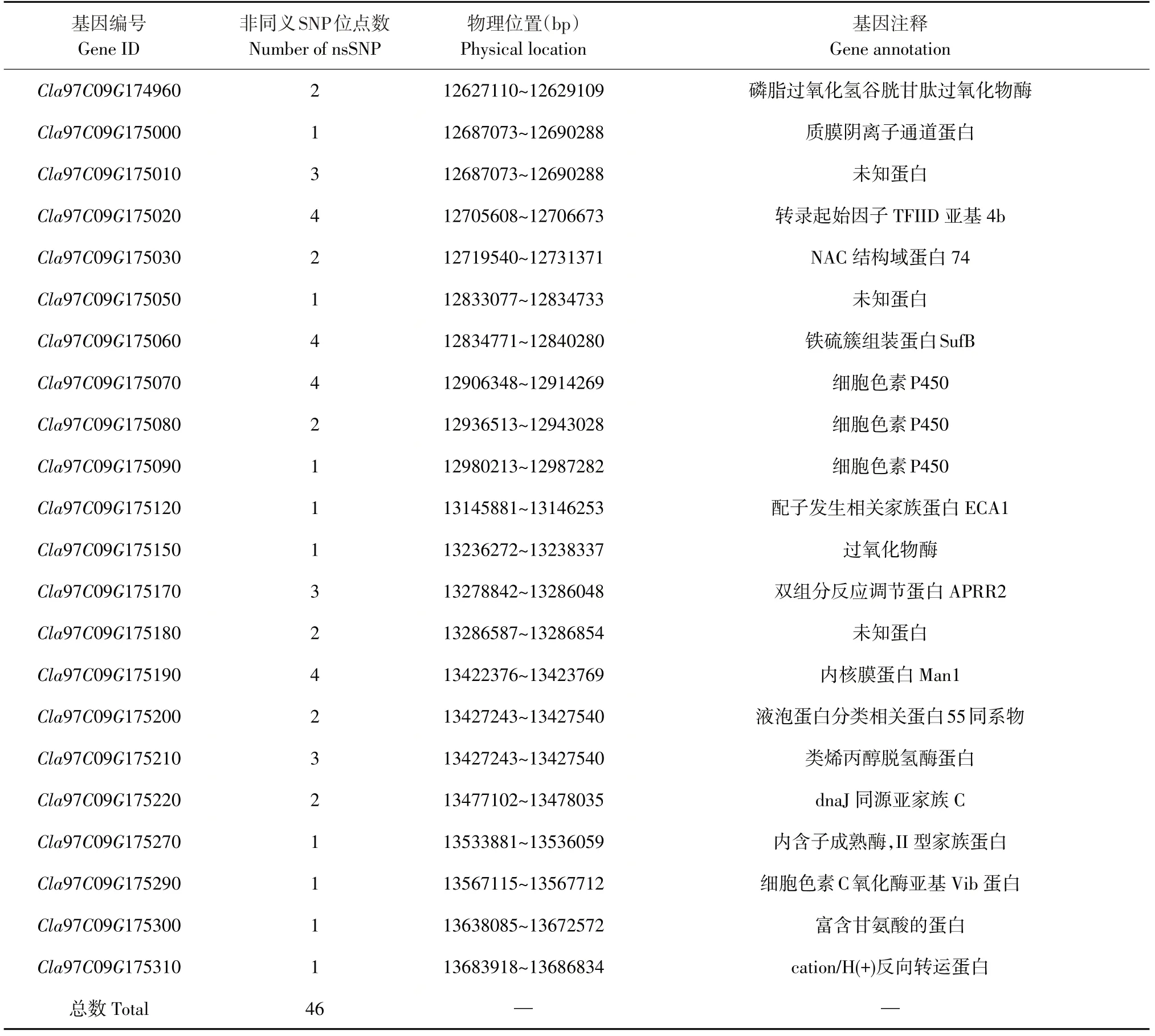
表1 西瓜果皮颜色区间内候选基因Table 1 Candidate genes of watermelon rind color
2.4 西瓜单性花关键基因定位与候选基因筛选
利用BSA-seq将控制西瓜单性花基因定位于3号染色体,物理位置为28 443 661~29 576 359 bp(约1.1 Mb),另向外扩充开发分子标记,区域长度共为2.51 Mb。在区间内设计10对InDel引物和24对CAPS引物,经多态性检测分别有3对和10对具有多态性。选择其中11个标记作基因分型。2021年春季187个植株中存在53个隐性单株,其中14株发生重组;秋季137个植株中存在51个隐性单株,其中9株发生重组,两季F2隐性单株定位分析均将区间缩至同一位置29 252 650~30 021 268 bp处,物理距离约为0.7 Mb(见图5)。

图5 西瓜单性花基因定位结果Fig.5 Genetic mapping of unisexual flower gene in watermelon
定位区间内共包括74个候选基因,利用本试验亲本和其他6种单性花西瓜材料重测序数据,与西瓜参考基因组(97103 V2)作比对,检测候选基因中仅存在ZXG1555突变,其中27个基因在编码区显示非同义突变(见表2)。使用葫芦科数据库和拟南芥官网查询候选基因相关信息,以拟南芥同源基因作为参考,在定位区间内存在基因Cla97C03G066110在西瓜基因组中功能注释为1-aminocyclopropane-1-carboxylate synthase 7,认为该基因参与植物体乙烯生物合成,在葫芦科作物性别分化过程中,乙烯发挥重要作用,故初步推测Cla97C03G066110可能为西瓜单性花性状候选基因。在Cla97C03G066110编码区内,ZXG1555发生两处非同义突变,第792位碱基由G突变为C,该处氨基酸由天冬氨酸变为赖氨酸;第1 185位碱基由C突变为G,氨基酸由亮氨酸变为苯丙氨酸。
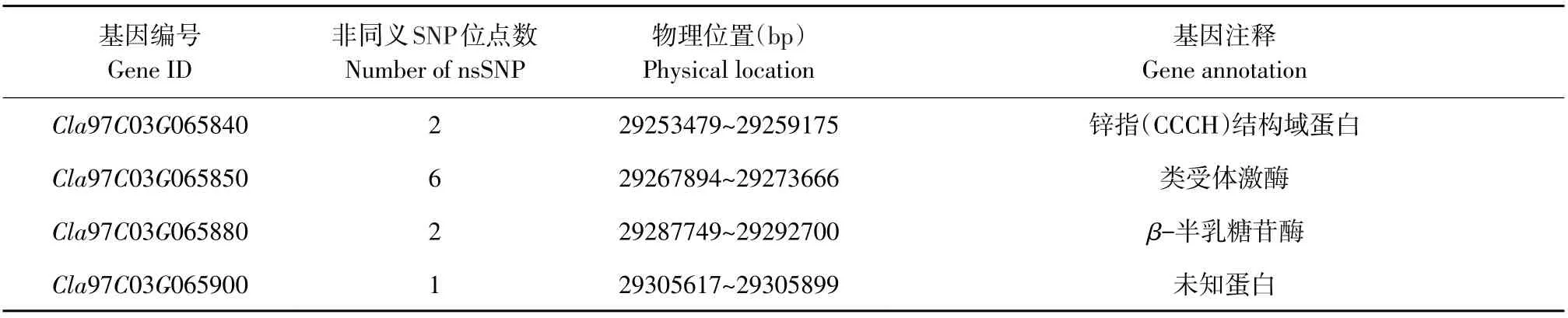
表2 西瓜单性花区间内候选基因Table 2 Candidate genes of unisexual flower trait of watermelon
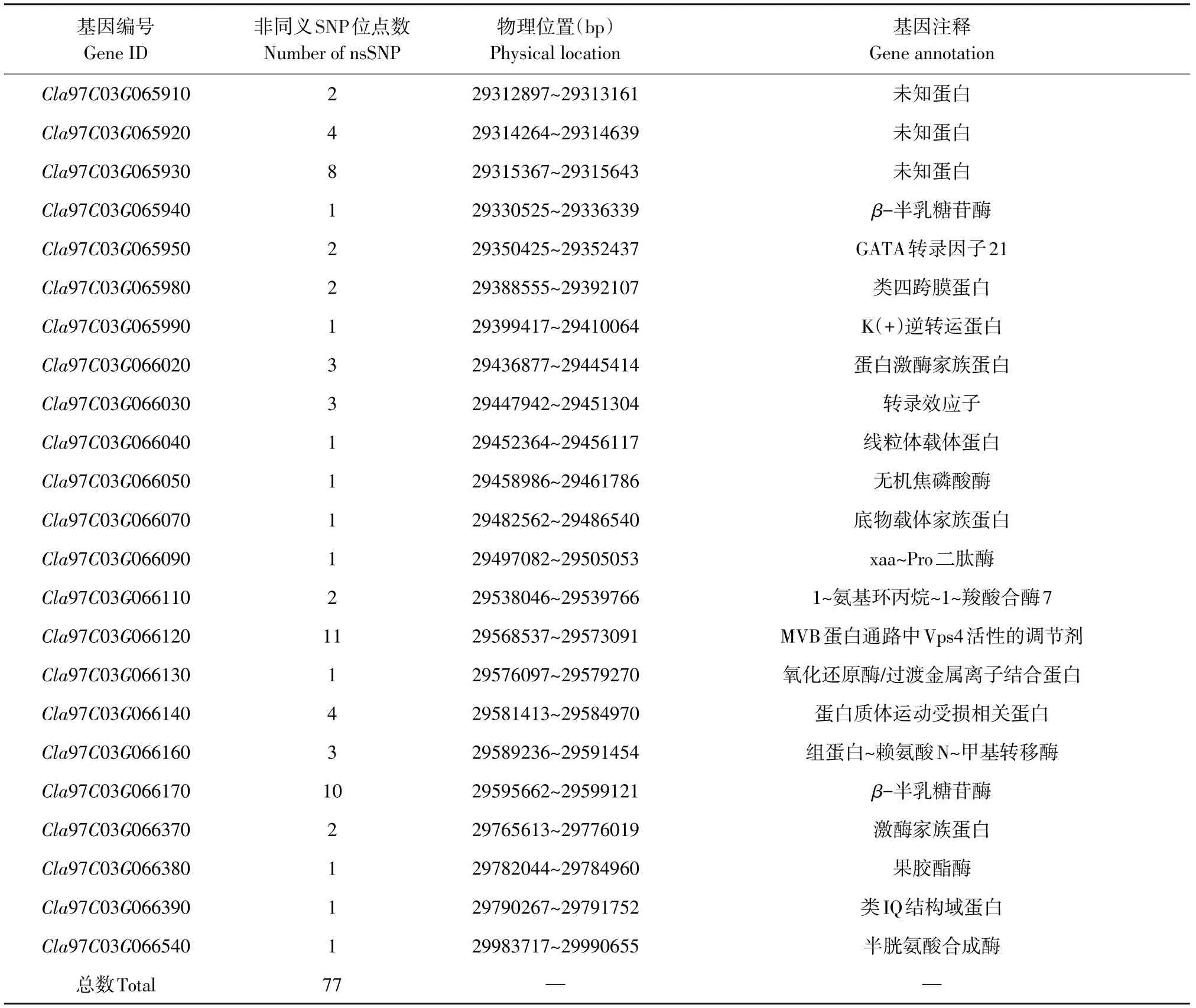
续表
3 讨论
3.1 西瓜浅绿色果皮定位及候选基因分析
西瓜果皮颜色是重要商品性状,对消费者选择具有直接影响,外皮分为果皮底色和条纹颜色。果皮底色包括深绿、绿色、浅绿、黄色等不同颜色,主要由内源色素比例决定,如叶绿素和类黄酮[21]。Park等研究西瓜果皮颜色深度,构建遗传连锁图谱,在8号染色体上发现一个与深绿色果皮连锁标记chr8_26061[9]。Kumar和Wehner认为浅绿色果皮受g-1和g-2共同调控,当两基因均为隐性时,果皮呈浅绿色,当其中任意一个以显性形式(G-1或G-2)单独存在或同时存在,则形成深绿色果皮[22]。Li等研究深绿、浅绿色果皮时,发现果皮颜色由8号染色体上ClCG08G017810控制,该基因编码Ubiquinone/menaquinone biosynthesis methyltransferase UbiE,编码区存在的非同义突变使氨基酸由精氨酸变为甘氨酸,导致西瓜果皮颜色存在差异[23]。与果皮颜色基因多被定位到8号染色体,本研究则将控制西瓜浅绿色果皮的基因定位于9号染色体,前人研究中以深绿和浅绿果皮为亲本,本研究以绿色和浅绿色为亲本,具有不同遗传背景,说明存在多个基因影响西瓜果皮颜色形成。分析定位区间内22个候选基因,推测Cla97C09G175170(APRR2)为调控西瓜浅绿色果皮候选基因。Oren等研究西瓜和甜瓜果皮发现,APRR2可能是致使两种作物中绿色和浅绿色外皮产生差异的关键基因[24]。故本研究初步推测Cla97C09G175170可能为控制浅绿色果皮性状候选基因。
3.2 西瓜单性花定位及候选基因分析
在常规育种中,单性花品种自然授粉结实率低,需人工授粉,两性花使自然授粉更容易,果实通常比单性花更圆[25]。葫芦科作物性别分化与乙烯高度相关,甜瓜、黄瓜和西葫芦中3个乙烯生物合成同源基因CmACS7[26]、CsACS2[27]和CpACS27A[18]发生突变使雌花在发育过程中产生雄蕊,生成两性花。使用乙烯利和硝酸银处理2叶1心西瓜,待植株长至4叶期,作qPCR分析,所有处理CitACS4表达水平均显著降低。喷洒乙烯利时产生两性花,是因外源喷施乙烯抑制内部乙烯形成,从而抑制子房发育;喷洒乙烯抑制剂硝酸银导致内部乙烯合成量减少,使西瓜仅诱导两性花[28]。李凤梅等开发CitACS4在甜瓜中同源基因CmACS7的CAPS分子标记,可用于对甜瓜单性花材料分子鉴定及辅助育种[29]。Manzano等研究西瓜CitACS4基因发现,该基因编码参与乙烯生物合成的花特异性ACS酶,基因编码区出现一个非同义突变,导致CitACS4蛋白364位氨基酸由半胱氨酸变为色氨酸,花芽中乙烯合成减少,雌花向两性花转变[6]。本试验初步推测3号染色体上Cla97C03G066110(CitACS4)为西瓜单性花形成候选基因。本研究中,CitACS4在ZXG1555发生两处非同义突变,使第264位氨基酸由天冬氨酸变为赖氨酸,第395位氨基酸由亮氨酸变为苯丙氨酸,可能导致雌花生长过程中部分功能丧失,乙烯合成减少,单性花转变为两性花。除受遗传因素影响外,光照强度、光周期和温度等环境因素也影响西瓜性别表达,本试验调查两季表型数据有差异,秋季单性花比例增加可能是受环境影响,秋季光照弱,太阳高度角低,温度光照分布不均匀,而短日、低光照强度和夜间温度低均促进雌花发育,从而产生更多单性花[30]。
4 结论
本研究中,西瓜浅绿色果皮及单性花性状均受隐性单基因控制,试验初步定位控制两个性状基因,通过序列比对和基因功能注释推测Cla97C09G175170和Cla97C03G066110可能是影响两个性状形成的候选基因,研究结果为今后两个性状目标基因精细定位、基因克隆及功能分析研究工作提供理论基础。
