单叶蔷薇远缘杂交中花粉管生长的荧光显微观察
2022-11-11冯策婷张宇静庄玥莹
欧 哲,杨 宇,冯策婷,江 律,张宇静,庄玥莹,罗 乐,于 超
(花卉种质资源创新与分子育种北京市重点实验室,国家花卉工程技术研究中心,城乡生态环境北京实验室,园林环境教育部工程研究中心,林木花卉遗传育种教育部重点实验室,北京林业大学园林学院,北京 100083)
单叶蔷薇(Rosa persica)为蔷薇科(Rosaceae)蔷薇属(Rosa)单叶蔷薇亚属(Hulthemia)低矮小灌木,多年生落叶植物,分布在中亚、西伯利亚、伊朗等地,在我国分布于新疆西北部地区[1]。单叶蔷薇在蔷薇属中身份特殊,其独特性体现在其分类学地位和形态外观上。中国蔷薇属植物共分为2个亚属,分别为单叶蔷薇亚属(仅1种)与蔷薇亚属。从形态上看单叶蔷薇与蔷薇亚属植物差异较大,单叶互生,花瓣基部有紫红色斑点(蔷薇属植物叶大多为奇数羽状复叶且花瓣不具有花斑),观赏价值独特。关于单叶蔷薇研究主要集中在细胞学、形态学及繁殖生物学等层面,与同属植物相比,单叶蔷薇在基因型、核型、叶片表型等方面较为特别[2-4],在演化中具有特殊地位,与同属植物亲缘关系较远。单叶蔷薇对干旱大陆性气候有特殊的生态适应性,具有典型旱生结构[5],对低温、高温、干旱等逆境均具有较强耐性[6-7]。
凭借其独特花斑与耐寒耐旱的优良性状,单叶蔷薇受到月季育种学家关注,被利用开展与现代月季的远缘杂交育种。远缘杂交是植物种质创新和品种改良重要途径之一,其杂交后代有明显的杂种优势,结合种间甚至属间两个不同物种优点,获得抗逆性强、观赏价值高的植物新品种[8]。例如,现代月季品种诞生,其代表品种‘法兰西’便是由中国古老月季月月粉(R.chinensis)、法国蔷薇(R.gallica)及其他蔷薇属植物经多年远缘杂交育成。但亲缘关系较远,物种间存在一定生殖隔离,蔷薇属植物远缘杂交常出现杂交不亲和情况,如坐果率低、子代出苗率低或后代不可育等现象[9-11]。不亲和原因主要有亲本染色体倍性差异,遗传信息差异大,亲本不具有可育性及受精前、受精后障碍等,其中蔷薇属内远缘杂交不亲和主要因素是受精前与受精后障碍。受精前障碍是指两个可育物种授粉后无法完成受精过程,表现为花粉在柱头上不萌发、花粉管生长异常及难以伸入子房,或是雄配子进入子房无法受精等,受精后障碍是指亲本完成受精过程,但胚胎发育遇到障碍,出现胚合子不发育、幼胚畸形、种子发育异常等现象[12-13]。在远缘杂交过程中找到不亲和原因并克服障碍可有效提高育种成功率。
以现代月季‘眼睛’系列品种育种史为例,其亲本单叶蔷薇与蔷薇属植物亲缘关系较远,存在杂交不亲和现象,因此育种过程进程缓慢甚至停滞。早在1835年,单叶蔷薇被Hardy应用于杂交育种,与R.clinophylla培育出最早的杂交种R.‘hardii’,但该品种完全不育,导致后期育种工作陷入停滞;20世纪70年代英国育种学家Harkness再次将单叶蔷薇应用于杂交育种,与蔷薇属芹叶组、桂味组、现代月季等诸多品种培育出53种新栽培品种,目前可溯源品种有‘Xerxes’‘Tigris’‘Nigel Hawthorne’‘Euphrates’,其中仅‘Tigris’作母本时可育。20世纪80年代初,英国玫瑰育种家Chris Warner选用现代月季品种与‘Tigris’杂交,培育出6株幼苗,分别取名为‘Tag’‘Tog’‘Tug’‘Tingle’‘Tang’‘Tiggle’。在2004年Peter James使用现代月季与Tiggle杂交,培育出带花斑现代月季‘眼睛’系列代表品种‘Eyes For You’(‘万众瞩目’),其花朵中心具有深色独特花斑,因此而得名。之后陆续有新的‘眼睛’系列现代月季品种问世,如‘巴比伦眼睛’系列,在众多现代月季品种中脱颖而出,其花量多、花期长、色彩组合丰富、可重复盛开,广受国内外人们喜爱。但‘眼睛’系列月季在长期定向选择育种过程中,部分抗性基因流失,在北方地区易受冻害,限制其分布范围和应用,与此同时其遗传背景复杂,自身可育性低,育种改良难度大。
中国蔷薇属种质资源丰富,随调查深入,仍有大量性状优异品种未参与现代月季育种历程,将蔷薇属中优良基因引进现代月季需大量的育种工作积累和系统化的理论指导。结合研究背景与育种目标,本研究从蔷薇亚属中选取5个组部分植物(分别为芹叶组、月季组、合柱组、桂味组、四倍体野生蔷薇组)作为父本与单叶蔷薇开展杂交试验,探究不同组合之间杂交坐果率,通过荧光显微镜观察比较各组花粉柱头萌发情况及花粉管生长动态,旨在从细胞学层面探究蔷薇属不同组植物与单叶蔷薇杂交亲和性,判断不亲和具体原因并克服其受精障碍,提高杂交成功率,为利用单叶蔷薇和我国蔷薇属植物杂交选育抗逆性强的带花斑月季中间材料及新品种提供理论基础。
1 材料与方法
1.1 杂交实验地概况
试验地点位于新疆昌吉回族自治州呼图壁县,海拔500 m,该地气候属于温带大陆性干旱半干旱气候,夏季炎热,冬季寒冷,昼夜温差大。平均气温为6.7℃,1月份平均气温为-15.6℃,7月份平均气温为24.5℃。降水主要集中在夏季,年降水量为167 mm,无霜期为180 d,全年日照总时数为3 090 h,平均每日平均光照达10 h以上。
1.2 材料
试验所选用父本材料为蔷薇属5个不同组植物的混合花粉,分别为:①芹叶组,②月季组,③合柱组,④桂味组,⑤四倍体野生蔷薇组,各组花粉具体种类信息见表1。花粉采集时间为2020年3~5月,用镊子取出花药,放置在玻璃干燥皿中等待干燥散粉,将花粉保存在采集管中置于干燥皿中密封存储。母本材料为新疆呼图壁县野外单叶蔷薇自然群落,高度为0.3~0.5 m,授粉处理时间为2020年5月下旬,选择生长健壮、无病虫害、花苞数量多且饱满植株作为授粉取材对象,每组授粉花蕾数尽量不少于200朵。

表1 杂交父本信息Table 1 Pollenin for mation of hybridization combination
1.3 方法
1.3.1 杂交试验
于2021年5月中旬在新疆呼图壁县野外开展杂交试验。以单叶蔷薇为母本,父本选取的种或品种共分为5组,采集每组植物花粉,混合后对单叶蔷薇授粉。为防止昆虫等传粉媒介影响,前一天傍晚对含苞待放的花苞按照不同组去雄、挂签、标记、套袋,次日晴朗无风10:00,用毛笔蘸取花粉对柱头授粉,授粉后6 h去除套袋,换成透气网纱袋作标记,记录各组授粉花朵数,同年9月采摘收集果实,统计不同杂交组合坐果率。坐果率(%)=果实总数/杂交花朵个数×100。
1.3.2 柱头采集
授粉后柱头采集与杂交试验同步进行,授粉前一天傍晚选择5组各40个花蕾(共计200个)挂签标记为待采样品,去雄套袋,第二天10:00用毛笔分别蘸取不同组合花粉授粉。为防止单叶蔷薇自身花粉影响荧光柱头试验结果,授粉后直至采摘前全程需用硫酸纸袋包裹柱头。选择授粉后8个时间节点进行柱头取样(见图1),每次取样5个花朵,将花去除萼片,将带花托的花柱放入FAA固定液(40%甲醛∶冰醋酸∶70%乙醇=5∶5∶90)中固定,将其根据柱头采集时间先后顺序编号为1~8号,共有5×8(共计40)组样品,带回实验室置于4℃冰箱保存备用。
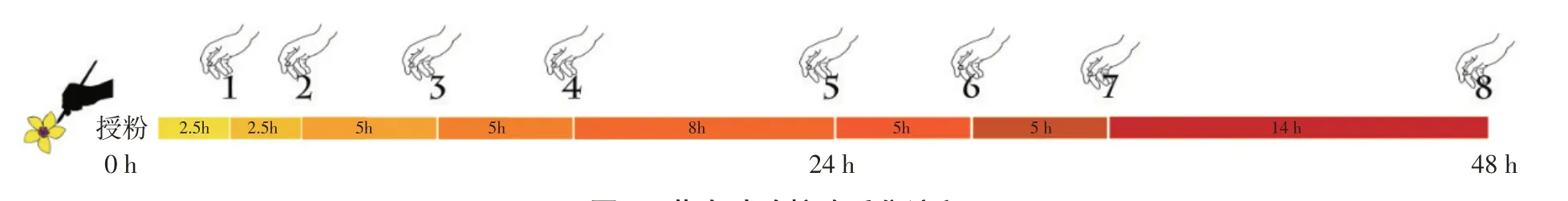
图1 荧光试验柱头采集流程Fig.1 Process of fluorescence experiment stigma acquisition
1.3.3 荧光柱头萌发观察
参照苯胺蓝染色制片方法制作单叶蔷薇雌蕊荧光切片[14],取出FAA液中固定的不同编号材料,将其置于容器中用自来水冲洗3~4次,置于2 mol·L-1NaOH溶液中,在60℃水浴锅中软化35 min,蒸馏水冲洗3次后用小刀和解剖针将其雌蕊连同子房结构剥出,转入水溶性苯胺蓝溶液(1 g·L-1苯胺蓝+0.1 g·L-1磷酸二氢钾)中染色20 min后取出。用小针将染色完成的材料挑至载玻片上,盖上盖玻片,编号1~8,用力压片直至柱头结构扁平透光,放置Leica DM4000荧光显微镜下观察柱头黏附花粉数量、花粉萌发、柱头乳突细胞胼胝质产生以及花粉管生长情况并多次拍照记录。
2 结果与分析
2.1 杂交坐果率统计
杂交试验中,5个组合总计授粉1 229朵花,获得191个果实(见表2)。5组亲本与单叶蔷薇均能产生果实,平均坐果率为15.4%,表明单叶蔷薇与5组植物均具有亲和性。不同组合间坐果率差异较大,其中芹叶组坐果率最高,为28.1%,月季组坐果率最低,仅为5.8%,其余组合坐果率依次为桂味组15.3%、四倍体野生蔷薇组15.2%和合柱组13.4%。191个杂交果实共获得1 289粒种子,平均每个果实获得6.7粒种子。
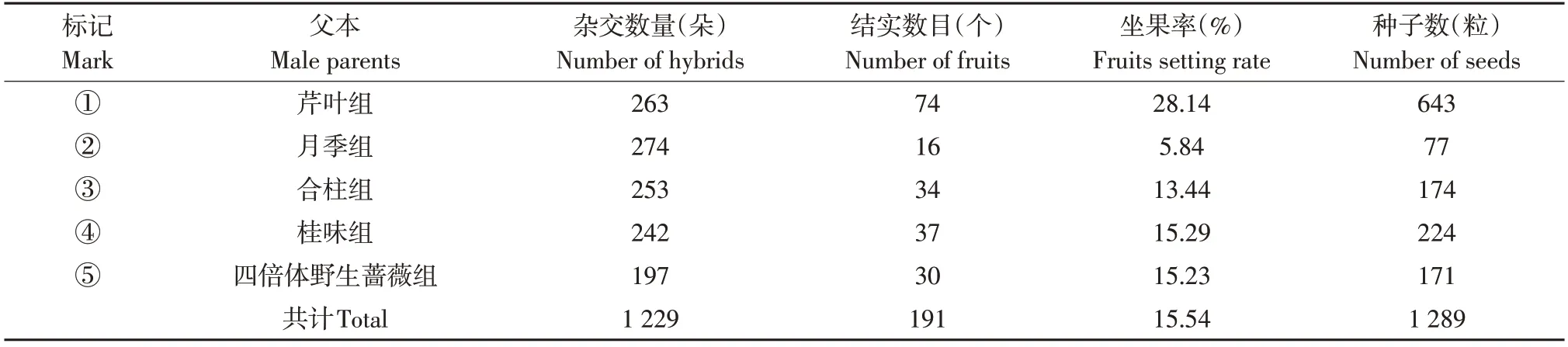
表2 杂交组合结实统计Table 2 Fruits setting of hybridization combination
2.2 花粉萌发情况观察
2.2.1 授粉后花粉粒萌发情况
当柱头(见图2a)上沾附花粉粒萌发时,在荧光下柱头表面会显示亮黄绿色荧光颗粒物质,未萌发花粉粒(见图2b)不显示荧光。随花粉萌发进入花柱(见图2c),所形成的花粉管显示荧光。授粉2.5 h后(第一阶段),通过显微镜观察到各组柱头表面有大量黏附而未萌发的花粉粒,此时仅有部分组合如芹叶组和桂味组材料花粉少量萌发(见图3-①-1、④-1),可知,芹叶组、桂味组材料花粉在单叶蔷薇柱头上萌发速度较快。授粉5 h后(第二阶段),四倍体野生蔷薇组、合柱组材料花粉也开始萌发(见图3-⑤-2、③-2),可见部分花粉形成的花粉管穿过表层乳突细胞进入花柱,荧光现象不明显且主要集中在柱头表面,月季组柱头表面仍未出现萌发的花粉粒(见图3-②-2)。授粉10 h后(第三阶段),花粉大量萌发,芹叶组、桂味组、四倍体野生蔷薇组花粉管达到1/4花柱长度(见图3-①-3、④-3、⑤-3),月季组花粉开始萌发(见图3-②-3),部分组合柱头已形成胼胝质堆积。授粉后16 h(第四阶段),5组花粉均已萌发,荧光现象明显,各组花粉管生长长度达到花柱的1/4-1/3,花粉萌发数量存在显著差异,表现为芹叶组、桂味组及四倍体组萌发数量较多(见图3-①-4、④-4、⑤-4),合柱组和月季组萌发数量较少(见图3-②-4、③-4)。

图2荧光显微镜下单叶蔷薇柱头a(40×);未萌发花粉粒b(40×);单叶蔷薇花柱c(40×)Fig.2 R.persica stigma a(40×);Undeveloped pollen b(40×);Stylec(40×)under fluorescence microscopy

图3 花粉在单叶蔷薇柱头上的萌发1~4阶段(40×)Fig.3 Germination 1-4 stages of pollen on the stigma(40×)
2.2.2 授粉后花粉管动态变化
授粉后24 h(第五阶段),各组柱头表面荧光明亮,向花柱内延伸的花粉管较多,表明该时间段是花粉管生长旺盛时期。本阶段芹叶组花粉管达到3/4花柱长度(见图4-①-5b),部分花粉管即将到达子房,月季组花粉管达到1/2处花柱(见图4-②-5b),数量相较于4阶段更少,表明此前形成的部分花粉管未继续生长而是被降解,合柱组萌发的花粉管达到2/3处花柱(见图4-③-5b),桂味组(见图4-④-5b)和四倍体野生蔷薇组(见图4-⑤-5b)花粉管到达花柱2/3处。授粉后29 h(第六阶段)至34 h(第七阶段),各组花粉管向下生长向子房延伸,此期间可见蓝绿色花粉管穿过花柱抵达花柱下端,进入子房(子房在图中未显示),此阶段芹叶组、桂味组、四倍体野生蔷薇组(见图4-①-7、④-7、⑤-7)在花柱中形成的花粉管数量较多,月季组、合柱组(见图4-②-7、③-7)较少。

图4 花粉在单叶蔷薇柱头上的萌发5~7阶段(40×)Fig.4 Germination 5-7 stages of pollen on the stigma(40×)
2.2.3 授粉末期花粉萌发情况
授粉后48 h(第八阶段)(见图5),柱头表面花粉粒较多,荧光现象明显,花柱内束状花粉管较多,大部分已到达花柱基部,表明5组花粉已形成进入子房的花粉管。相同授粉环境下,以授粉后48 h柱头荧光观察结果作为参考,芹叶组、月季组、合柱组、桂味组、四倍体野生蔷薇组花粉在单叶蔷薇柱头上的萌发情况如下:以柱头表面萌发的花粉数量为评价指标,四倍体野生蔷薇组、芹叶组、桂味组(见图5-①、④、⑤)萌发的花粉数量较多,合柱组(见图5-③)较少,月季组(见图5-②)最少;以花柱内形成花粉管数量为评价指标,芹叶组、桂味组和四倍体野生蔷薇组(见图5-①b、④b、⑤b)数量多,合柱组(见图5-③b)数量较少,月季组(见图5-②b)最少;从萌发速率上对比,芹叶组、桂味组在授粉2.5 h内开始萌发,合柱组、四倍体野生蔷薇组在授粉后2.5~5 h内开始萌发,月季组萌发速度最慢,在5~10 h内开始萌发,且萌发部分花粉管无法生长而后期被降解;各组花粉管生长速率差异不显著,在授粉后29~34 h内,各组陆续有花粉管抵达子房。各组柱头表层均出现不规则的黄绿色胼胝质堆积,但仍有部分花粉正常萌发并生长。综上所述,参与试验的蔷薇属5组植物花粉均被单叶蔷薇柱头识别并萌发抵达子房花粉管,不同组萌发情况存在较大差异。

图5 各组花粉在单叶蔷薇柱头上的萌发第8阶段(40×)Fig.5 Germination eighth stages of pollen on the stigma(40×)
3 讨论与结论
单叶蔷薇性状独特且抗性优良,但利用其开展现代月季育种存在困难,原因是单叶蔷薇与蔷薇属植物亲缘关系较远,易出现杂交不亲和现象,表现为坐果率低、子代发芽率低、成苗率低、子代不可育等问题,严重影响其杂交育种效率。其中蔷薇属内远缘杂交不亲和原因主要为受精前障碍与受精后障碍[11],本研究通过杂交试验和荧光柱头萌发试验探究蔷薇属植物与单叶蔷薇之间杂交亲和性,并尝试找到不亲和的具体原因,为高效利用单叶蔷薇和我国蔷薇属植物杂交选育抗逆性强的带花斑现代月季中间材料及新品种提供理论基础。
被子植物受精关键识别位点主要位于花粉与柱头、花粉管与花柱及雌雄配子之间,任意阶段无法识别均导致生殖障碍。主要过程有花粉与柱头的识别(花粉壁蛋白与雌蕊组织间的识别反应),花粉管在柱头内伸长识别以及最终雌雄配子的结合识别[15]。若花粉与柱头间亲和性强,花粉粒可正常萌发且其尖端分泌的角质酶可分解柱头表面蛋白质膜下角质层,进入花柱继续生长[16]。花粉萌发过程中乳突细胞表面产生胼胝质阻碍花粉管伸长,过多的不规则胼胝质导致花粉管无法继续生长进入花柱,柱头上花粉管出现扭曲、肿胀、结合和分枝等现象[17]。利用荧光显微镜技术可观察到植物杂交后花粉在柱头上的萌发与生长状态及形态变化,判断其亲和性及不亲和的主要原因。国内利用荧光显微镜分析沙田柚自交和异交亲和性[18],沙梨‘丰水’与其他品种远缘杂交不亲和性[19-20],蔷薇属植物金樱子与现代月季品种‘东方欲晓’和‘火焰舞’远缘杂交亲和性[13],其花粉萌发生长过程反映杂交不亲和发生的具体阶段,为克服杂交不亲和提供理论依据。
单叶蔷薇柱头由3部分构成,顶部有少量羽毛状细胞,这种结构可增加单叶蔷薇对花粉的黏附性[21]。从图2b、图5中可知,授粉初期单叶蔷薇柱头可黏附吸收数量较多的花粉,且试验花粉均与单叶蔷薇柱头结合萌发,表明单叶蔷薇柱头对蔷薇属5组花粉均具有可授性。试验以单叶蔷薇为母本,蔷薇属植物各组花粉均可在其柱头上附着并萌发,形成抵达花柱下端的花粉管,但不同杂交组合花粉萌发速率、数量及花粉管数量存在显著差异(见图5):以花粉萌发速度为评价指标,芹叶组和桂味组萌发最快,月季组萌发速度最慢;以花粉萌发数量为指标,芹叶组、桂味组、四倍体野生蔷薇组萌发的花粉、花粉管数量较多,合柱组次之,月季组最少。尽管单叶蔷薇柱头中形成部分胼胝质堆积,但并未严重影响各组植物花粉管生长,柱头上未出现大量肿胀、扭曲的花粉管,说明胼胝质堆积不是影响单叶蔷薇与蔷薇属植物杂交亲和性的主要原因。综上,单叶蔷薇与蔷薇属5组植物具有不同程度的花粉-柱头亲和性,芹叶组、桂味组、四倍体野生蔷薇组与单叶蔷薇的花粉-柱头亲和性高于合柱组、月季组,其花粉在单叶蔷薇柱头上萌发生长情况正常,可形成较多进入子房的花粉管,月季组花粉在柱头上萌发和生长受阻,与单叶蔷薇存在受精前障碍。
结合杂交试验结果分析(见表2),5个杂交组合均有后代,坐果率各异但整体偏低,表明单叶蔷薇与蔷薇属植物杂交亲和性较低且亲和性不同。以单叶蔷薇作母本时,杂交亲和性由高到低依次为芹叶组>桂味组、四倍体野生蔷薇组和合柱组>月季组。研究显示植物种间杂交不亲和程度与亲本间亲缘关系呈正相关[17],可根据杂交试验与荧光柱头试验结果推测单叶蔷薇与蔷薇属不同组植物间亲缘关系远近。与此同时,普遍偏低的坐果率与荧光观察结果中部分组合较高的花粉-柱头亲和性不符,说明芹叶组、桂味组、四倍体野生蔷薇组、合柱组与单叶蔷薇的杂交过程存在其他的不亲和现象,不亲和原因推测为受精前障碍中雄配子无法与胚囊结合或受精后障碍杂交合子发育不良导致败育,之后可通过杂交果实发育观察判断其是否存在杂交后期败育的情况。因杂交试验花粉种类多,采集时间跨度大,无法排除花粉采集时间、花粉活力变化、观察样本偏差等因素对荧光试验、杂交试验结果准确性的影响,结果可能存在误差。
综上,以单叶蔷薇为母本与蔷薇属植物进行远缘杂交时存在不亲和现象,可产生后代但坐果率低,其柱头具有较高可授性,证明利用中国蔷薇属植物与单叶蔷薇杂交培育高抗性带花斑的现代月季中间材料及新品种具有可行性。单叶蔷薇在蔷薇属植物中与芹叶组亲和性相对较高,与月季组存在受精前障碍,与芹叶组、桂味组、四倍体野生蔷薇组、合柱组的不亲和原因推测为受精后障碍,需进一步研究。针对受精前障碍,可尝试通过柱头喷洒生理活性物质、涂抹花粉培养液、蕾期预授粉、重复授粉、蒙导法克服障碍,针对受精后障碍,可采取胚拯救、激素处理措施提高杂交成功率[12]。
