呼伦贝尔黄花苜蓿MfMYB30基因的克隆及表达分析
2022-11-09周昕越刘叶飞韩慧杰刘亚玲
周昕越,刘叶飞,邱 锐,韩慧杰,刘亚玲,赵 彦*
(1 内蒙古农业大学 草原与资源环境学院/农业部饲草栽培、加工与高效利用重点实验室/教育部草地资源重点实验室/教育部创新团队——草地资源可持续利用的研究[IRT-17R59],呼和浩特 010018;2 内蒙古蒙草生态环境[集团]股份有限公司,呼和浩特 010030)
黄花苜蓿(MedicagofalcataL.)是多年生苜蓿属豆科牧草,适口性好[1],营养价值非常高,具有很强的抗逆性[2]。在解决中国畜牧业面临的蛋白质饲料缺乏、改善天然草地和草原土壤肥力下降等问题中具有重要的地位和作用[3]。由于现有黄花苜蓿品种的再生性和抗病性较差,容易受到生物和非生物因素的胁迫,从而影响品质和产量[4-6]。为了降低这些影响,植物进化出一系列复杂的抵御外界胁迫的反应机制,即通过转录因子整合外界信号和基因调控的方式产生相应的蛋白和代谢产物来适应胁迫,从而提高植物的抗逆性[7]。
植物中的MYB家族十分庞大,尤其是R2R3-MYB亚家族[8-9]。MYB类蛋白的N端通常含有约51个氨基酸组成的高度保守的MYB结构域,C端为转录激活结构域。MYB30转录因子属于R2R3-MYB家族,R2R3-MYB转录因子拥有一个N端保守的MYBDNA结合结构域和一个通常定位在C端的可变的激活或抑制区域[10]。MYB30转录因子最早被发现是在植物抵抗病原菌侵染的HR(Hypersensitive Response)反应的最初阶段[11]。研究显示,MYB30转录因子参与了多种植物的生长发育和胁迫响应过程,如参与植物次生生长、激素信号转导以及参与多种植物逆境防御反应[12],在信号通路中,MYB30转录因子通过与其他蛋白互作或是在蛋白水平上受到修饰,或是调节下游基因从而参与胁迫应答[13]。还有研究表明,MYB30转录因子具有生物学功能的多效性,可在非生物逆境抗性及抗病性中具有生物学功能[14]。对模式植物拟南芥的研究表明,MYB30转录因子可以加快拟南芥的开花过程,从而将其病原菌胁迫相应通路与开花调控过程联系在一起[15]。桑树MaMYB30基因可能参与桑树对桑脉带相关病毒的防御调控过程,证明该基因与植物抵御逆境胁迫关系密切[16]。MYB30还可以通过调控超长链脂肪酸(Very Long Chain Fatty Acid, VLCFA)的代谢参与低氧胁迫响应[17]。由此可见,MYB30转录因子基因在介导植物抵御生物与非生物胁迫中发挥着重要作用。
综上,本研究以呼伦贝尔黄花苜蓿(MedicagofalcataL.cv. Hulunbuir)为材料,利用RT-PCR技术克隆得到黄花苜蓿MfMYB30基因,对该基因进行生物信息学特征分析,利用荧光定量PCR技术分析MfMYB30在不同刈割天数后的相对表达,并在拟南芥原生质体中进行了亚细胞定位分析,以期为黄花苜蓿抗逆与再生基因筛选及分子育种应用提供依据。
1 材料和方法
1.1 试验材料与处理
本研究选取的植物材料为呼伦贝尔黄花苜蓿,挑选颗粒饱满的黄花苜蓿种子,用砂纸打磨破除硬实,放在培养皿里培养至发芽,将发芽的种子播种于无菌培养土中并放至人工气候室中培养,栽培期间为长日照条件(16 h光照/8 h黑暗),昼/夜温度为26 ℃/18 ℃,通风良好,定期浇水。当生长到开花期时,进行刈割胁迫处理。
选取3株长势较好并处于开花期的黄花苜蓿进行模拟刈割处理,刈割留茬高度15 cm,分别处理3、5和7 d,各时间点选取叶片与茎组织于2 mL离心管,并选取一株未进行刈割处理的植株作为对照,同时取样,液氮速冻,-80 ℃条件保存备用,生物学重复3次。
1.2 方 法
1.2.1 RNA的提取与cDNA的合成取-80 ℃保存备用的黄花苜蓿样品按照TransZoL. Up Plus RNA kit试剂盒(北京全式金基因科技有限公司)参考说明书提取总RNA。利用紫外分光光度计测定RNA含量,经1.2%琼脂糖凝胶电泳检验,将质量合格的RNA在-80 ℃条件保存备用。以测定后的高质量总RNA为模板,使用TransScriptⅡOne-Step gDNA Removal and cDNA Synthesis SuperMix(北京全式金基因科技有限公司)试剂盒进行cDNA第一链的合成,-20 ℃条件保存备用。
1.2.2MfMYB30基因的克隆根据转录组测序数据筛选的差异表达候选基因,获取MfMYB30基因全长序列,用Oligo7.0软件设计扩增引物(表1),以反转录cDNA第一链为模板,进行PCR扩增。PCR扩增体系为50 μL,包含cDNA模板2 μL,高保真酶PrimeSTAR 25 μL,上、下游引物各2.5 μL,ddH2O补至50 μL。扩增程序为94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,35个循环,72 ℃延伸5 min,16 ℃保存。将扩增产物进行琼脂糖凝胶电泳检测合格后胶回收,然后将其连接到克隆载体1300-cYFP上,采用热激法转化大肠杆菌感受态DH5α,挑取阳性单菌落,经过菌落以及菌液PCR检测后送往广州睿博生物技术有限公司进行测序。

表1 所用引物信息
1.2.3 生物信息学分析对克隆得到的MfMYB30基因序列进行生物信息学分析,运用NCBI中的BLAST (https://bL.ast.ncbi.nL.m.nih.gov/BL.ast.cgi)功能进行序列比对;利用NCBI中的Open Reading Frame Finder(https://www.ncbi.nL.m.nih.gov/orffinder/)工具,找到cDNA序列中的最大开放阅读框;利用SMART(http://smart.embL.-heideL.berg.de/)在线工具分析保守结构域;利用ExpasyProtParam tooL.(https://web.expasy.org/protparam/)工具分析蛋白质理化性质;利用PRABI(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_ automat.pL.?page=npsa_sopma.htmL.)和SWISS-MODEL.(https://swissmodeL..expasy.org/interactive)在线软件分别预测蛋白二级结构。利用SignaL.P-5.0(https://services.heaL.thtech.dtu.dk/service.php?SignaL.P-5.0)预测蛋白质信号肽;TMHMM-2.0(https://services.heaL.thtech.dtu.dk/service.php?TMHMM-2.0)分析蛋白跨膜结构;利用Plant CARE在线软件(https://bioinformatics.psb.ugent.be/webtooL.s/pL.antcare/htmL./)分析预测顺式作用元件。利用MEGA7.0软件、ITOL在线软件及邻接法(Neighbor-Joining, NJ)(bootstrap=1 000)构建系统进化树,分析其与其他物种之间的进化关系。
1.2.4MfMYB30基因的表达分析根据克隆得到的MfMYB30基因序列,采用实时荧光定量PCR方法,设计qRT-PCR引物(表1),以黄花苜蓿Actin基因作为内参基因,检测黄花苜蓿分别在模拟刈割胁迫处理3、5和7 d后的表达情况。试验进行3次生物学重复。反应结束后对结果进行分析。使用Excel按照2-ΔΔCT方法进行计算,样品间的差异性用SPSS 25.0进行检验。
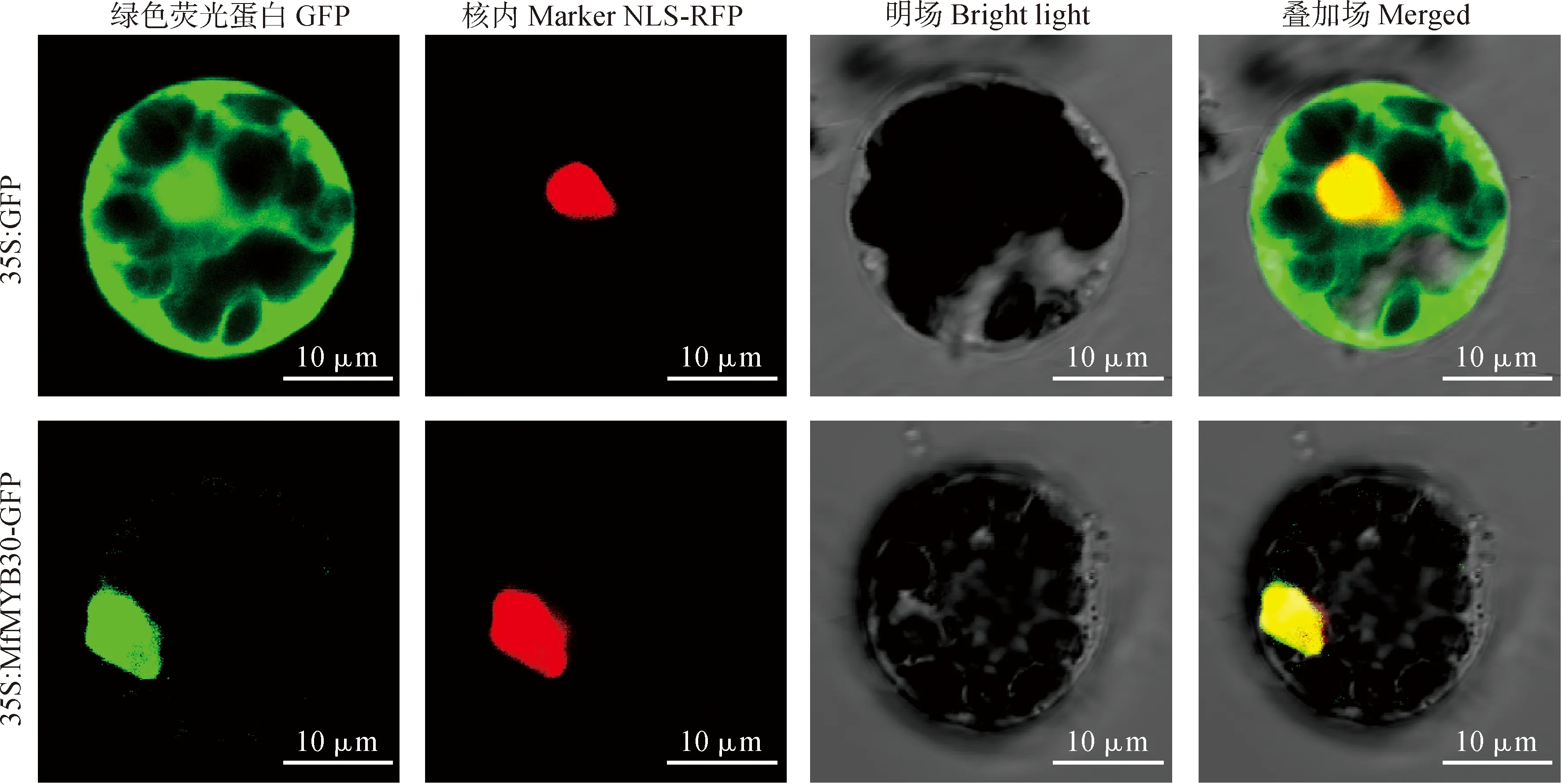
1.2.5 MfMYB30亚细胞位置的预测及定位利用在线软件WoLFPSORTPrediction对MfMYB30蛋白进行亚细胞定位预测分析。采用酶切连接法构建以PUC19为骨架的pUC19-HA-MfMYB30-GFP瞬时表达载体。以空载体GFP作为对照,将构建好的载体pUC19-HA-MfMYB30-GFP及核定位信号(nucle-us localization signal,NLS)RFP融合红色荧光蛋白的载体共同转化拟南芥原生质体,利用激光共聚焦显微镜观察荧光信号,进行MfMYB30亚细胞定位。
2 结果与分析
2.1 MfMYB30基因的克隆
以呼伦贝尔黄花苜蓿总RNA反转录的cDNA为模板进行PCR 扩增,得到大小为1 000 bp左右的片段,所得片段大小与预期理论值一致。对片段进行回收纯化、载体连接及转化,最后将阳性菌液送至广州睿博生物技术有限公司进行测序,测序结果显示片段长1 060 bp(图1)。进一步分析表明该序列开放阅读框(ORF)957 bp,编码318个氨基酸(图2),并将其命名为MfMYB30。
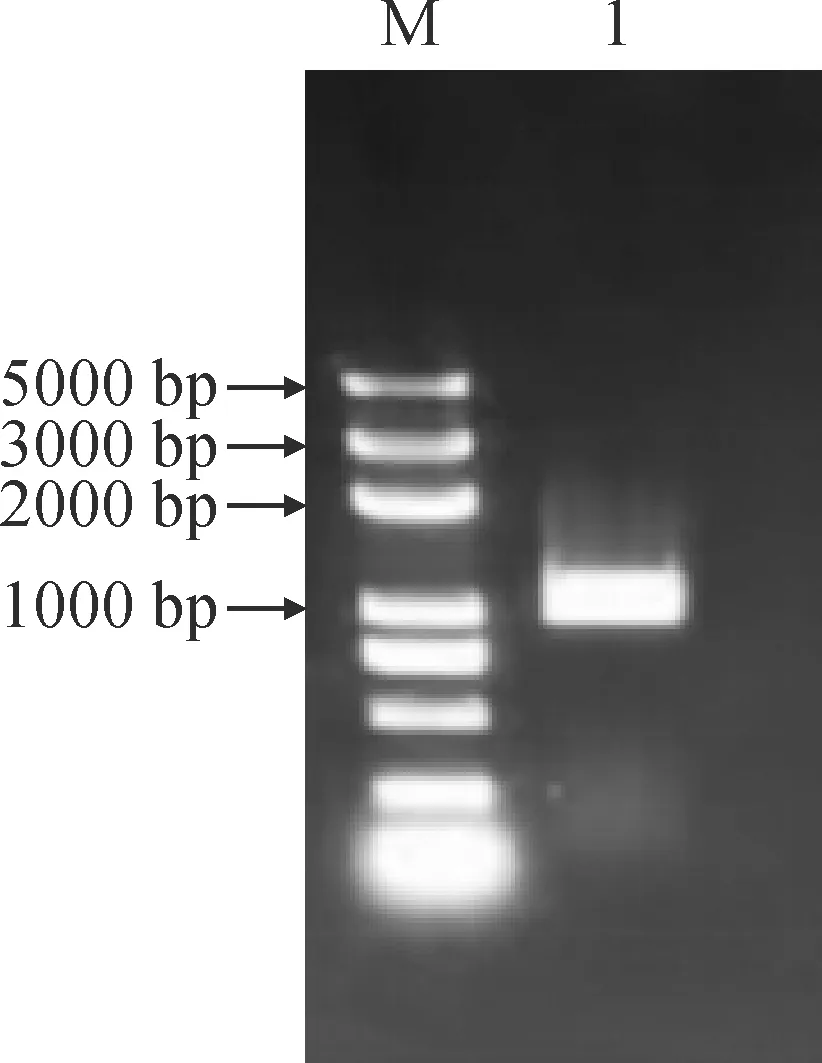
M. DL5000;1.MfMYB30

图2 MfMYB30基因的完整开放阅读框及推测氨基酸序列
2.2 黄花苜蓿MfMYB30蛋白结构特征分析
利用Expasy-ProtParam tool对MfMYB30基因的蛋白质理化性质进行预测,结果表明,分子量为86.85 kD,理论等电点为5.11,分子式为C3257H5456N1060O1363S174,氨基酸组成为Ala(33.9%)、Cys(16.4%)、Gly(21.2%)、Thr(28.5%),脂肪系数为33.87,不稳定系数为44.43,该蛋白为不稳定蛋白。利用Protscale预测MfMYB30基因编码蛋白的亲疏水性,结果显示,最大亲水分值为-0.633,最大疏水分值为2.033,总平均亲水指数(grand average of hydropathicity, GRAVY)为0.736,为疏水性蛋白。利用SMART分析MfMYB30蛋白的保守结构域,有2个SANT保守结构(分别位于13~63 bp和66~114 bp)和1个低复杂性结构域(Low-complexity domain, LCD),均具有与MYB家族相似的结构(图3)。MfMYB30 蛋白的信号肽以及跨膜结构域预测分析表明,MfMYB30蛋白无信号肽和跨膜结构域。

A.MfMYB30蛋白的保守域分析; B.MfMYB30蛋白质的二级结构:蓝色.α螺旋;红色.延伸链;紫色.无规则卷曲;绿色.β转角
通过 SPOMA 在线工具分析二级结构,预测表明MfMYB30含有33.02%的α-螺旋,5.66%的延伸链,59.75%的不规则卷曲。α-螺旋对于黄花苜蓿MfMYB30蛋白质结构来说具有一定稳定性,无规则卷曲在功能上充当酶和蛋白质的活性中心(图4)。

Mf.黄花苜蓿;Mt.蒺藜苜蓿;Cc.木豆;Gs.野大豆;Mp.刺毛黛豆;Ss.密花豆;Va.赤豆;Vr.绿豆;Vu.豇豆
2.3 MfMYB30基因的元件分析
利用Plant CARE在线软件分析表明(表2),在MfMYB30基因上游启动子区含有基本元件TATA-box和CAAT-box,光响应顺式作用元件 G-box、Box-4、LAMP-element和MRE,与抗病、再生相关的响应元件P-box、TCA-element和ARE,此外,还有与转录因子MYB结合位点有关顺式作用元件Box Ⅲ、MYB和MYB-like sequence。
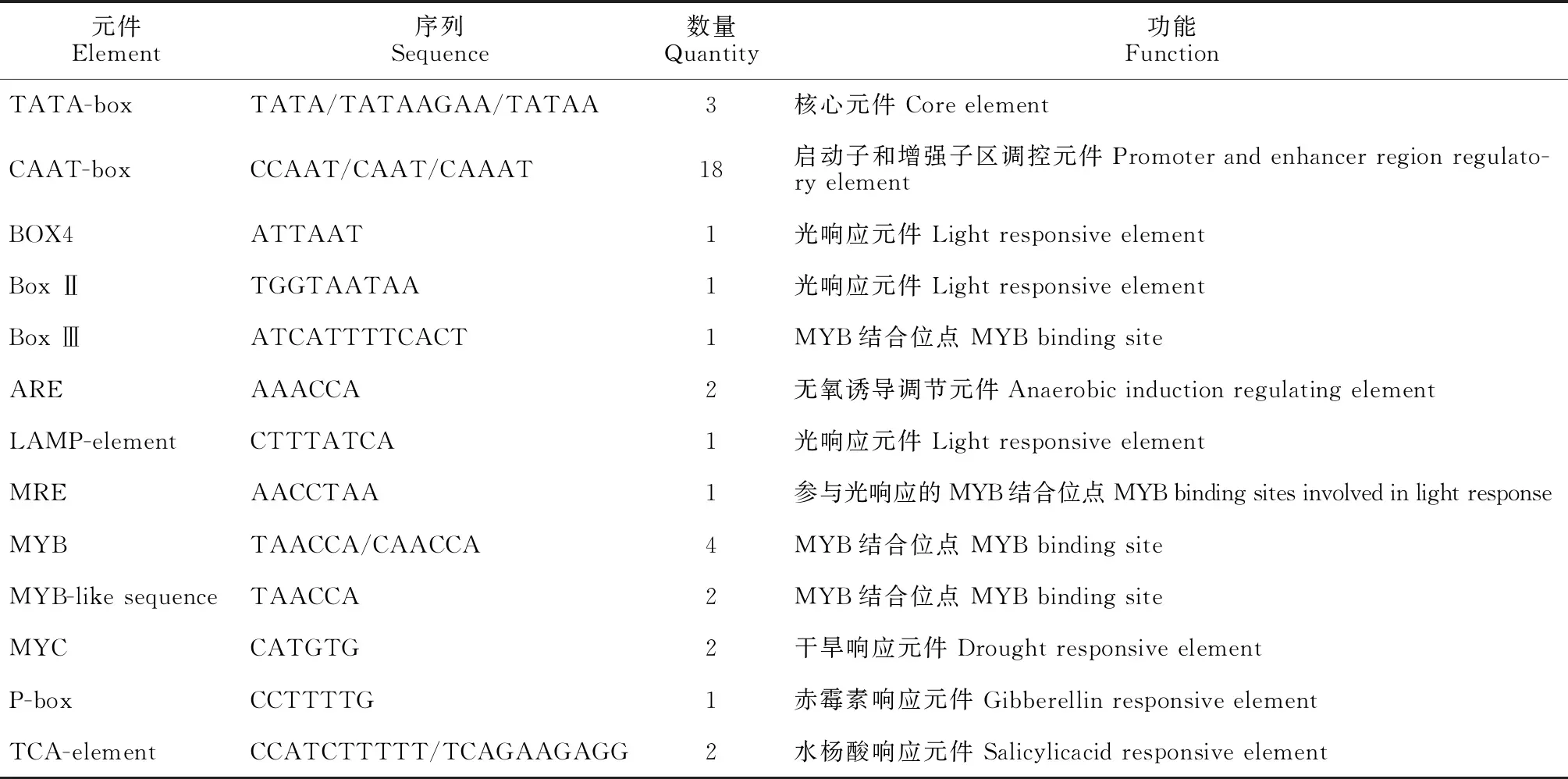
表2 MfMYB30基因启动子序列顺式作用元件
2.4 MfMYB30编码氨基酸序列比对与系统进化树分析
将MfMYB30氨基酸序列提交至NCBI在线BLASTn检索,利用DNAMAN软件对绿豆、豇豆、野大豆等8种豆科植物的MYB30蛋白进行多序列比对分析,结果表明,MfMYB30编码的氨基酸序列与不同豆科植物MYB30氨基酸序列表现出高度相似性,大约在65%~99%之间,其中与同科植物蒺藜苜蓿MtMYB(Medicagotruncatula, XP_003618488.1)的氨基酸序列相似性最高,相似度达到了99%(图5)。
为了更好地了解MfMYB30蛋白的系统发育关系,将大豆(14个)、蒺藜苜蓿(5个)、紫花苜蓿(3个)、拟南芥(5个)和木豆(2个)MYB蛋白,用MEGA7.0软件与ITOL软件对30个MYB蛋白构建系统进化树(图5),根据进化树分支, 将30 个MYB 转录因子划分为6类, 其中黄花苜蓿MfMYB30蛋白与紫花苜蓿MsMYB4、拟南芥AtMYB30、木豆CcMYB30、蒺藜苜蓿MtMYB30和大豆GmMYB60聚为一类,表明氨基酸序列差异较小,亲缘关系较近,具有较高的相似性, 在功能上可能也具有相似性。
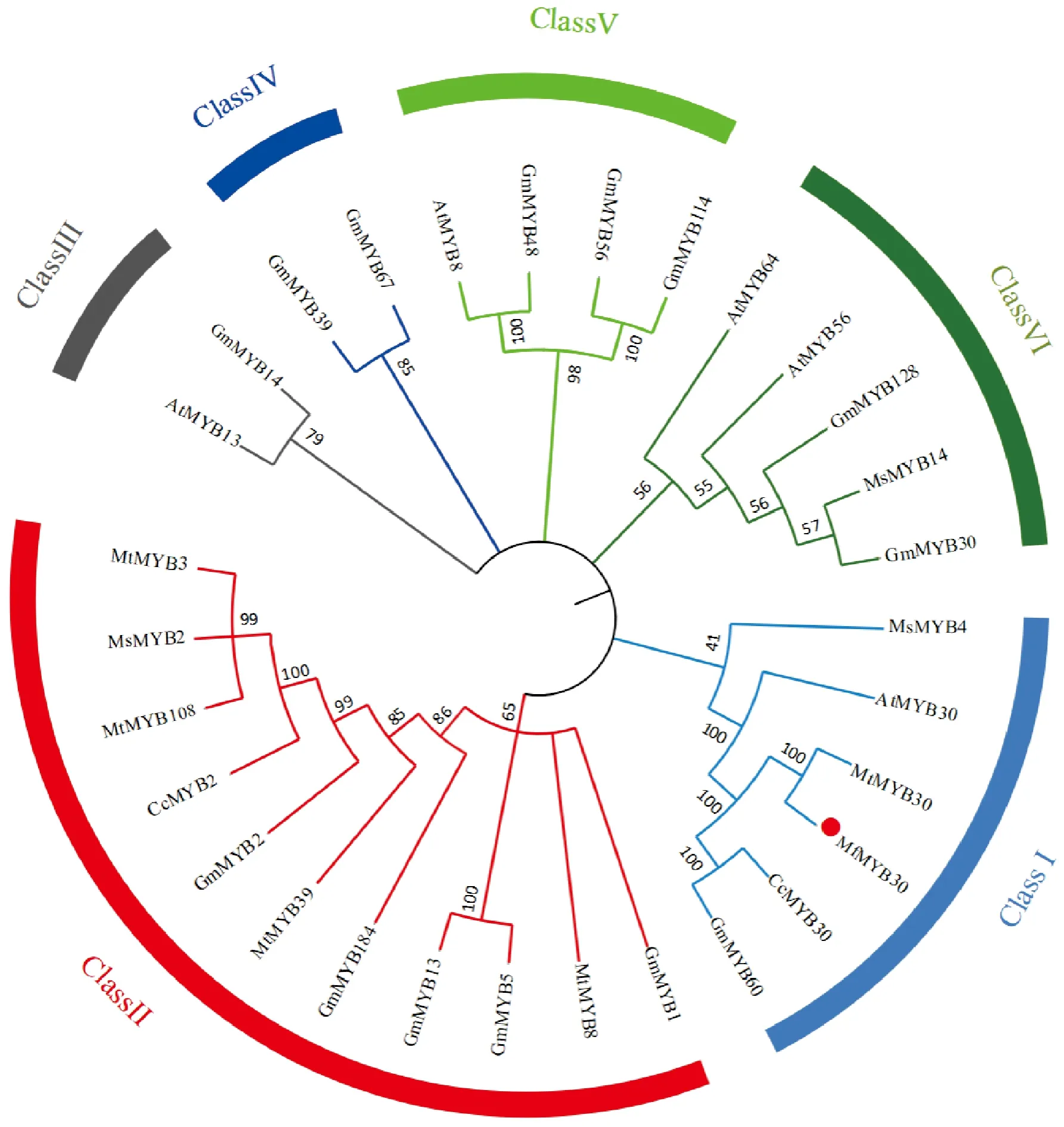
Mf.黄花苜蓿;Mt.蒺藜苜蓿;Ms.紫花苜蓿;Cc.木豆;Gm.大豆;At.拟南芥
2.5 黄花苜蓿MfMYB30基因的表达分析
为初步分析MfMYB30基因的功能,采用实时荧光定量PCR方法,以刈割胁迫不同天数后的黄花苜蓿叶片与茎组织的cDNA为模板,并以黄花苜蓿Actin基因作为内参基因,检测黄花苜蓿刈割(模拟放牧)不同天数MfMYB30基因的表达情况。结果表明:在模拟刈割胁迫不同天数处理下,MfMYB30基因相对表达量呈现“降-升-升”的变化趋势,在刈割7 d后达到峰值(图6)。说明刈割(模拟放牧)处理对MfMYB30的表达有影响,黄花苜蓿面对非生物胁迫(刈割或放牧)时MfMYB30可能具有一定的调节功能。
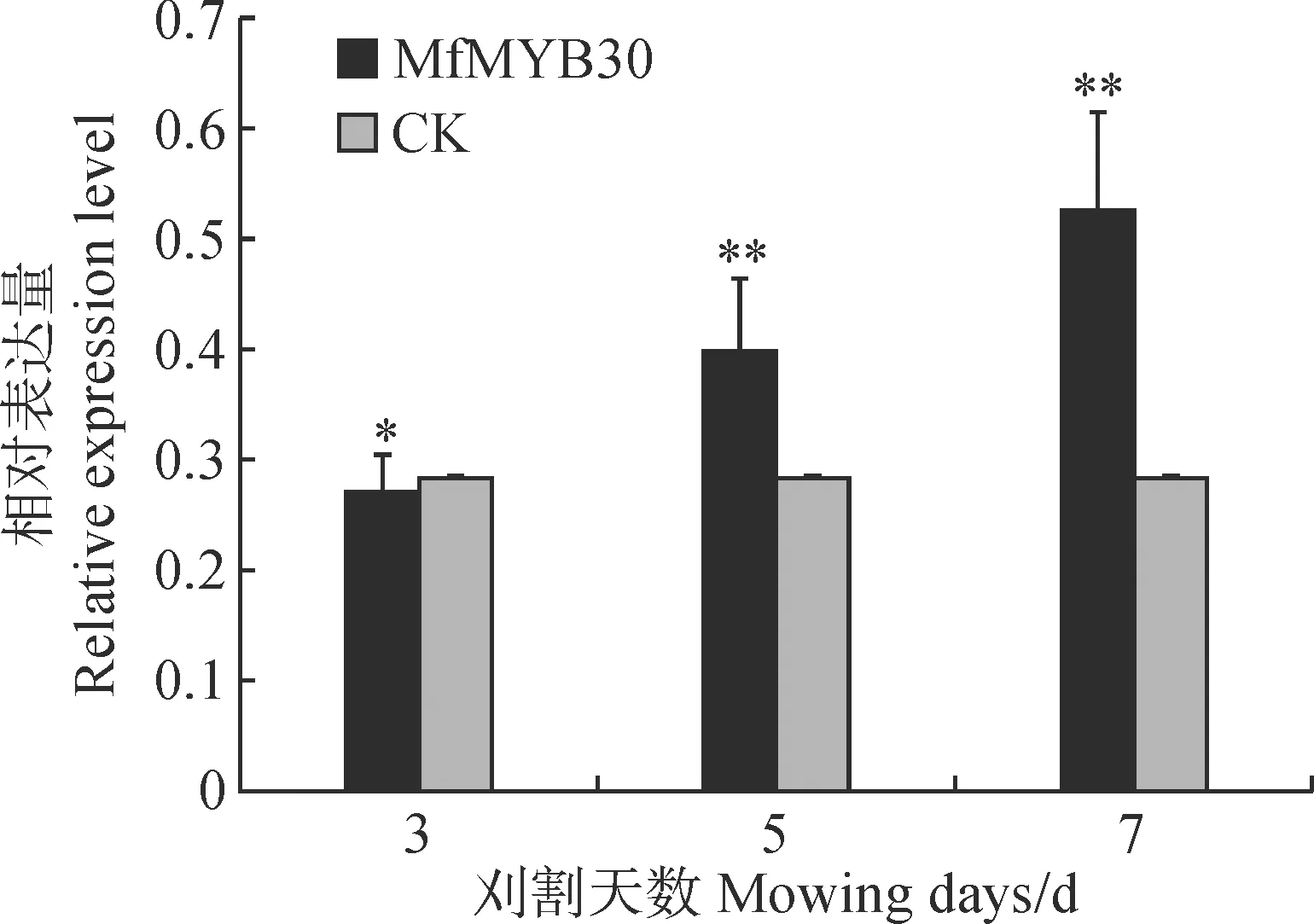
星号分别表示处理与对照之间基因表达水平存在显著性差异(*. 0.01 通过WolF PSORT Protein Subcellular localization Prediction在线工具对MfMYB30蛋白进行亚细胞定位预测,分析该蛋白位于细胞的细胞核中。为进一步验证MfMYB30蛋白的作用机制,我们构建了以pUC19为骨架的pUC19-HA-MfMYB30-GFP瞬时表达载体,通过拟南芥原生质体瞬时转染技术进行了亚细胞定位分析,利用激光共聚焦显微镜观察显示,单独的GFP荧光呈现弥散的状态,而转入MfMYB30-GFP融合蛋白后,荧光聚集在细胞核中,进一步证实MfMYB30蛋白亚细胞定位在细胞核中(图7)。 图7 MfMYB30蛋白的亚细胞定位 MYB类是一类重要的转录因子,在植物生长发育和抗逆过程中起着重要作用。其中,R2R3-MYB亚家族是植物中发现的最丰富的MYB家族,在植物特有的信号通路中,初生和次生代谢、细胞分化、形态发育和对生物胁迫和非生物胁迫的响应等发挥着重要作用[18]。 本研究根据转录组测序数据基础筛选差异表达基因,克隆得到黄花苜蓿一个MYB(MfMYB30)基因。结构分析表明,MfMYB30编码的蛋白由318个氨基酸组成,N端具有2个SANT 结构,2个结构域分别由51和49个氨基酸组成,属于典型的R2R3-MYB转录因子结构特征。通过分析其编码的氨基酸序列,发现MfMYB30蛋白与蒺藜苜蓿MtMYB30蛋白具有很高的相似性,在系统进化上,该蛋白与蒺藜苜蓿MtMYB30亲缘关系较近,并且与处于进化树同一分枝的其他植物的同源蛋白具有相同的保守结构域,说明MfMYB30在进化过程中具有功能上的高度保守性。亚细胞定位结果分析表明, MfMYB30蛋白定位在细胞核。 刈割是牧草的主要利用方式之一,科学合理的刈割制度是确保牧草生产力和品质,保证草地畜牧业的可持续发展的重要前提[3,19],当植物受到刈割胁迫后,容易受到病原菌的感染,植物受病原菌侵染后,诱导表达的抗病蛋白能够直接与病原体的侵染结构接触,抑制、干扰病菌的生长进程,激发植物产生系统获得性抗性,发挥广谱抗病作用[20-21]。前人研究表明,MYB30转录因子是通过调控乙酰辅酶A(acyL-CoA)延伸酶复合体基因的表达,进而调控超长链脂肪酸(Very-Long-Chain Fatty Acid,VLCFA)合成基因的表达以及HR反应,包括 KCS、FDH、KCR、ECR、PAS2/HCD、CER2、CER3 和 LTPG1[22]。而MYB30同时也能调控抗病相关激素水杨酸(SA)的合成[23]。在BR(Brassinosteroids)信号通路中,MYB30和BES1(BriL.-Ems-Suppressor 1)相互作用,共同调控了BR响应基因的表达,从而影响模式植物拟南芥下胚轴的伸长[24]。脱落酸(ABA)是被认为是非生物和生物胁迫反应的关键调控因子,MYB30是ABA信号通路的正调节物,它能被SUMO E3连接酶SIZ1所SUMO化,这对MYB30在ABA信号通路中的作用非常重要,MYB30可以调控脱落酸信号下的根细胞伸长[25-26]。还有研究表明,MYB30能调控拟南芥蜡粉的合成,表皮蜡粉在植物抵御病虫害和降低紫外线福射等方面起着重要作用[27-29]。通过上述分析,黄花苜蓿MfMYB30基因可能在响应刈割胁迫反应起作用,提高植物的抗逆性,进而促进植物的再生。 实时荧光定量PCR是一种快速准确的核酸定量分析技术,具有特异性强、灵敏度高、速度快等优点。本研究RT-PCR的结果进一步表明了MfMYB30很有可能参与黄花苜蓿中刈割胁迫调控,在刈割3、5和7 d处理下,MfMYB30在5 d和7 d后的表达均有明显上调。由此推测在刈割胁迫条件下MfMYB30可能起正调控作用。 由于在生命活动中真正起作用的是基因的表达产物蛋白质,而蛋白质的功能与其在细胞中的亚细胞定位密切相关,蛋白质位于细胞的不同部位所行使的功能也不同,因此对蛋白质进行亚细胞定位是研究其功能必不可少的环节之一[30]。为了进一步探究MfMYB30的作用机制,确定黄花苜蓿MfMYB30蛋白在细胞中的存在位置,本实验构建了pUC19-HA-MfMYB30-GFP瞬时表达载体,并通过拟南芥原生质体瞬时转染技术进行分析,在激光共聚焦显微镜下观察并拍照。结果表明,MfMYB30定位于细胞核中,是一个核蛋白。 综上所述,本研究从黄花苜蓿转录组中筛选和克隆获得1个表达显著上调的MfMYB30基因,并通过生物信息学方法和RT-qPCR分析对其生物学特性与功能进行研究,以期为阐明黄花苜蓿MfMYB30基因在响应刈割(或放牧)胁迫的分子机制提供理论基础。同时通过RNA-Seq测序和数据分析发现,在获得的黄花苜蓿转录组数据中除MYB转录因子外还存在其他差异表达基因,挖掘和解析这些重要基因的功能有助于进一步提高黄花苜蓿的抗逆性,也为利用分子生物学手段培育抗逆性强的黄花苜蓿品种奠定基础。2.6 黄花苜蓿MfMYB30蛋白的亚细胞定位
3 讨 论
