水木和宁方通过调控泛素-蛋白酶体通路对MPP+诱导帕金森病体外模型细胞损伤的影响*
2022-11-09张天琪李传成邱朝阳刘萍翟茜茜霍青
张天琪,李传成,邱朝阳,刘萍,翟茜茜,霍青
(1.山东中医药大学,山东 济南 250355;2.临沂市中心医院,山东 临沂 276400;3.潍坊医学院,山东 潍坊 261000;4.山东省妇幼保健院,山东 济南 250014;5.山东中医药大学附属医院,山东 济南 250011)
帕金森病(Parkinson’s disease,PD)是人类第二大常见的神经退行性疾病,目前全球患病人数已超过600万,其病理特征包括路易小体和路易神经突起形式的神经包涵体、黑质和其他脑区的细胞丢失[1-3]。泛素-蛋白酶体通路(ubiquitin-proteasome pathway,UPP)是体内重要的非溶酶体蛋白降解途径,功能缺陷时蛋白质不能及时降解,细胞氧化应激水平上升,促使DA神经元变性、凋亡,从而导致PD的发生[4-6]。本病治疗以左旋多巴制剂、多巴胺能受体激动剂、抗胆碱能制剂等为主,尽管在一定程度上减轻了症状,但仍然无法阻止或逆转疾病进展,且随着疾病的进展,药物的疗效会逐渐减弱[7]。长期使用还可能出现“开关现象”、“剂末现象”、肌张力运动障碍等运动并发症[8]。水木和宁方是霍青经过多年的临床实践总结的治疗PD的经验方。本课题组前期多项研究表明,本方可有效改善PD患者运动及非运动症状,改善患者睡眠情况,提高患者的生活质量,具有良好的临床疗效[9-11]。课题组前期动物实验结果表明水木和宁方可能通过调节UPP功能,促进α-syn的降解,从而改善PD小鼠的运动功能[12]。本研究拟在前期工作基础上,从细胞层面构建PD体外细胞模型,选择与UPP通路相关的指标,采用Real-time PCR法和Western blotting法进行探究,进一步验证水木和宁方调控蛋白降解通路,保护多巴胺(dopaminer,DA)能神经元的作用机制。
1 材料
1.1 实验细胞 PC12细胞株购自中国科学院上海细胞库。
1.2 药物与试剂 水木和宁方配方颗粒(江阴天江药业有限公司,批号:21051561),由熟地黄10 g,山茱萸6 g,黄精10 g,牛膝10 g,当归10 g,桃仁10 g,红花6 g,茯苓10 g,白术10 g,地龙10 g等药物组成[10];美多芭(上海罗氏,批号:SH5198),以上药物均购自山东中医药大学附属医院。N-甲基-4-苯基吡啶鎓碘化物(MPP+iodide)(美国西格玛公司,批号:D048);MTT试剂盒(北京索莱宝科技有限公司,批号:M8180);胎牛血清(Lonsera,批号:OB08933);RPMI 1640培养基(美国康宁公司,批号:BIO10040CV);BCA试剂盒(批号:P0012S)、ECL化学发光液(批号:P0018S)、SDS-PAGE试剂盒(批号:P0690)均购自上海碧云天技术有限公司;TH抗体(批号:ab112)、UCH-L1抗体(批号:ab8189)、ubiquitin抗体(批号:ab7780)、Parkin抗体(批号:ab77924)、α-syn抗体(批号:ab52168)、UBE1抗体(批号:ab181225)均购自Abcam公司;beta-actin抗体(武汉三鹰生物技术有限公司,批号:20536-1-AP);HRP标记山羊抗兔IgG二抗(批号:7074)、HRP标记山羊抗鼠IgG二抗(批号:7076)均购自CST公司;RNA快速提取试剂盒(思科捷生物,批号:AC0202);反转录试剂预混液试剂盒(批号:AG11706)、SYBR Green Pro Taq HS预混型qPCR试剂盒(批号:AG11701)、PCR引物均购自艾科瑞生物。
1.3 主要仪器 Multiskan Go1510型酶标仪、NanoDrop2000型微量紫外可见分光光度计(赛默飞世尔科技公司);Light Cycler 480 Ⅱ型实时荧光定量PCR仪(美国罗氏集团);Mini-Protean Tetra电泳系统、转膜仪(美国伯乐公司);Fluor Chem Q成像和分析系统(美国Protein simple公司);Axiovert 40型倒置相差显微镜(德国卡尔蔡司)。
2 方法
2.1 水木和宁方的配制 在传统煎煮方法的基础上,参考现代离体实验中药提取方法[13]。计算水木和宁方颗粒各味中药总和为300 g,将中药溶解于180 mL高压灭菌的ddH2O中,使用水浴锅进行加热,最终配制成质量浓度为2 g/mL的中药母液。将中药母液分装后,以5 000 r/min离心10 min,经过多次离心后,取上清液,0.22 μm滤膜进行过滤除菌,分装避光储存于-80 ℃冰箱中,现取现用。
2.2 细胞培养 细胞复苏后,培养于RPMI 1640培养液中(含10%胎牛血清、100 U/mL青霉素及0.1 mg/mL链霉素),37 ℃、5% CO2饱和湿度下进行培养,隔日更换1次培养液,待细胞生长融合至80%以上时,消化传代,选用对数生长期细胞进行后续实验。
2.3 PD体外细胞模型建立 MPP+不仅能够损害DA能神经元,产生PD样症状,还能在体外实验中诱导α-syn的过表达和聚集,因此本实验选用MPP+诱导PD模型[14-15]。实验设6个复孔,每孔100 μL,设置空白对照组、对照组、实验组(MPP+)。实验组分为0.25、0.5、1、2 mmol/L共4个浓度,空白对照组和对照组弃原液,加入1640基础培养基,采用MTT法筛选MPP+的最佳浓度。选用MPP+最佳浓度作用于细胞,孵育24 h,观察造模情况。
2.4 水木和宁方和美多芭药物最佳浓度筛选 筛选水木和宁方最佳浓度时,分为空白对照组、对照组、实验组(水木和宁方)。实验组分为0.5、1、2、4、6、8、10、12 mg/mL共8个质量浓度,空白对照组和对照组弃原液,加入1640基础培养基,采用MTT法筛选最佳浓度。美多芭药物最佳浓度的筛选方法同水木和宁方,药物质量浓度分别设置为25、12.5、6.25、3.125 l、1.5625μg/mL。
2.5 细胞分组及处理 实验分为对照组、模型组、水木和宁方组、美多芭组,干预一定时间后,收取细胞上清,冻存于-80 ℃冰箱,以备后续进行Real-time PCR和Western blotting检测。
2.6 水木和宁方对MPP+诱导的PC12细胞形态学影响 细胞干预结束后,将细胞培养瓶放置于倒置显微镜下观察,详细记录各组细胞形态学改变,并拍照分析。
2.7 水木和宁方对MPP+诱导的PC12细胞存活率的影响 采用MTT法检测细胞存活率,将细胞稀释成浓度为1×105个/mL的悬液,每孔取100 μL接种于96孔培养板中。培养24 h后,根据实验分组的不同进行干预,每孔设置6个复孔,药物干预24 h后加入200 μL MTT溶液(5 mg/mL)。继续培养4 h后弃上清,每孔加入150 μL DMSO,振荡10 min后,酶标仪490 nm处测定吸光度值,并计算细胞存活率。
2.8 Real-time PCR法检测泛素化相关分子mRNA表达水平 根据试剂盒说明提取总RNA,测定RNA浓度。通过反转录试剂盒将mRNA反转录成cDNA,以cDNA为模板,GAPDH为内参,使用PCR仪进行扩增和检测。PCR扩增条件:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火60 s,共40个循环;溶解曲线95 ℃5 s,65 ℃60 s;降温50 ℃30 s。每个实验指标重复检测3次取其平均值,计算采用2-ΔΔCt法进行分析。引物序列见表1。

表1 α-syn、TH、泛素化相关基因引物序列
2.9 Western blotting法检测泛素化相关蛋白的表达 采用RIPA裂解液裂解细胞,4 ℃、12 000 r/min离心15 min,取上清收集总蛋白,采用BCA法进行蛋白定量。取适量蛋白样品进行SDS-PAGE 电泳,转膜至PVDF膜上,5%脱脂奶粉封闭2 h,4 ℃一抗(β-actin 1∶5 000,Ubiquitin 1∶1 000,α-syn 1∶500,UCH-L1 1∶400,Parkin 1∶400,TH 1∶400,E1 1∶1 000)孵育过夜。次日TBST洗膜15 min×3次,加入二抗(羊抗兔1∶5 000,羊抗小鼠1∶5 000)室温孵育1 h,TBST洗膜15 min×3次。最后通过化学发光剂ECL显色曝光,采用Image J软件分析条带灰度值。
2.10 统计学方法 采用IBM SPSS 26.0进行统计学处理,计量资料以“均数±标准差”()表示,多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
3 结果
3.1 MPP+最佳造模浓度筛选 随着MPP+浓度的升高,OD值逐渐下降,MPP+浓度为0、0.25、0.5、1、2 mmol/L时,OD值分别为1.233±0.012、1.116±0.008、0.867±0.018、0.660±0.011、0.403±0.014,细胞存活率依次为为100.00%、92.46%、70.29%、53.53%、37.71%,差异有统计学意义(P<0.05)。当1 mmol/L MPP+作用于PC12细胞时,细胞存活率为53.53%,接近于IC50值,对细胞的影响差异有统计学意义(P<0.05),故本实验选择1 mmol/L作为MPP+最佳造模浓度。(见图1)
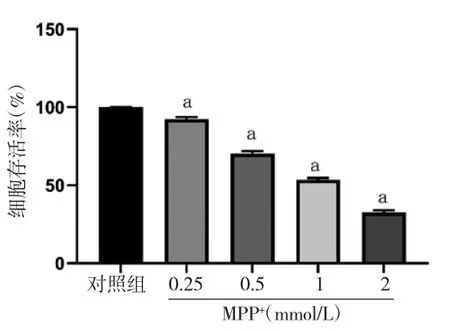
图1 MPP+对PC12 细胞存活率的影响(,n=3)
3.2 水木和宁方和美多芭药物最佳浓度选择 随着水木和宁方浓度的升高,PC12细胞的活力呈下降趋势,当水木和宁方质量浓度大于6 mg/mL时,细胞存活率明显降低(P<0.05),故选择6 mg/mL作为水木和宁方最佳干预浓度。随着美多芭浓度的升高,细胞存活率呈下降趋势,当美多芭质量浓度大于3.125 μg/mL,细胞存活率明显降低(P<0.05),因此本实验选择3.125 μg/mL作为美多芭最佳干预浓度。(见图2)

图2 水木和宁方和美多芭对PC12 细胞存活率的影响(,n=3)
3.3 各组PC12细胞存活率比较 与对照组比较,模型组PC12细胞存活率明显降低(P<0.05);与模型组比较,水木和宁方组和美多芭组PC12细胞存活率明显升高(P<0.05),且水木和宁方组PC12细胞存活率明显高于美多芭组(P<0.05),进一步说明水木和宁方和美多芭对MPP+诱导的PC12细胞具有保护作用,能够提高PC12细胞存活率,且水木和宁方对细胞保护作用优于美多芭。(见图3)

图3 各组PC12 细胞存活率比较(,n=3)
3.4 各组PC12细胞形态学比较 对照组PC12细胞呈长梭形或者多角形贴壁生长,折光性能良好,有类似神经细胞的突起;模型组PC12细胞呈圆形,折光性变差,间隙变大,悬浮细胞数目增多,突触数目减少;水木和宁方组和美多芭组PC12细胞的形态、折光性、细胞间隙、突触数目均优于模型组,由此可见水木和宁方和美多芭对MPP+诱导的PC12细胞的损伤具有一定保护作用。(见图4)

图4 各组PC12 细胞形态学比较(×10)
3.5 各组PC12细胞α-syn、TH、泛素化相关分子mRNA表达水平比较 与对照组比较,模型组PC12细胞α-syn mRNA表达明显上调(P<0.05),TH mRNA、UBE1 mRNA、Parkin mRNA、UCH-L1 mRNA、ubiquitin mRNA表达均明显下调(P<0.05);与模型组比较,水木和宁方组和美多芭组PC12细胞α-syn mRNA表达均明显下调(P<0.05),TH mRNA、UBE1 mRNA、Parkin mRNA、UCH-L1 mRNA、ubiquitin mRNA表达均明显上调(P<0.05);与美多芭组比较,水木和宁方组PC12细胞α-syn mRNA表达均明显下调(P<0.05),TH mRNA、UCH-L1 mRNA、ubiquitin mRNA表达均明显上调(P<0.05)。(见表2)
表2 各组PC12 细胞α-syn、TH、泛素化相关分子mRNA表达水平比较(,n=3)

表2 各组PC12 细胞α-syn、TH、泛素化相关分子mRNA表达水平比较(,n=3)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与美多芭组比较,cP<0.05
3.6 各组PC12细胞α-syn、TH、泛素化相关蛋白表达比较 与对照组比较,模型组PC12细胞α-syn蛋白表达明显上调(P<0.05),TH、UBE1、Parkin、UCH-L1、ubiquitin蛋白表达均明显下调(P<0.05);与模型组比较,水木和宁方组和美多芭组PC12细胞α-syn蛋白表达均明显下调(P<0.05),TH、UBE1、Parkin、UCH-L1、ubiquitin蛋白表达均明显上调(P<0.05);与美多芭组比较,水木和宁方组PC12细胞α-syn蛋白明显下调(P<0.05),TH、UCH-L1、ubiquitin蛋白表达均明显上调(P<0.05)。(见图5、表3)

图5 各组PC12 细胞α-syn、TH、泛素化相关蛋白表达Westem blotting图
表3 各组PC12 细胞α-syn、TH、泛素化相关蛋白表达比较(,n=3)
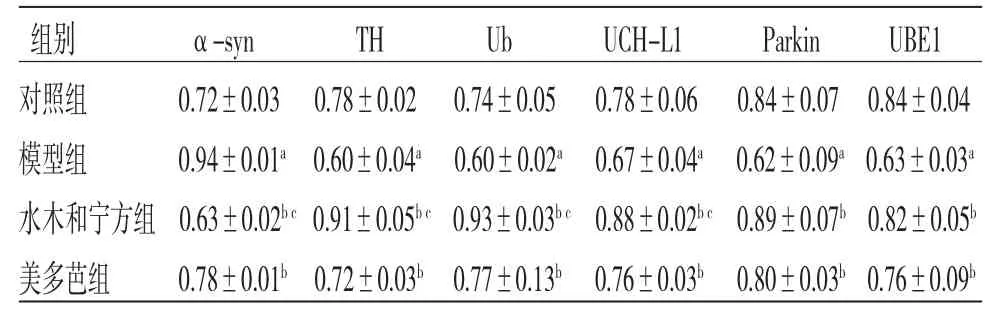
表3 各组PC12 细胞α-syn、TH、泛素化相关蛋白表达比较(,n=3)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与美多芭组比较,cP<0.05
4 讨论
UPP是体内重要的蛋白质降解途径,是保护细胞免受错误折叠蛋白质毒性作用的重要的机制之一,多项研究结果表明UPP与神经退行性疾病密切相关[16]。UPP通过泛素、泛素相关酶、蛋白酶体等调控特定蛋白的降解,调节细胞周期、免疫及炎症反应、细胞凋亡等[17]。氧化应激、内质网应激、细胞老化可导致蛋白错误折叠,导致损害蛋白的积聚。当损害蛋白异常聚集超过了UPP的降解能力时,可导致泛素化损害蛋白的积聚,进而影响神经元功能障碍甚至死亡[18-19]。越来越多的遗传、病理和实验证据表明,家族性和散发性帕金森病的神经变性可能与UPP清除蛋白质缺陷有关,导致蛋白质积累、聚集和细胞毒性[20]。
UPP在PD的发生发展过程中扮演着重要的角色,尤其是清除Lewy小体内积聚的α-syn、Parkin蛋白等。研究发现α-syn、Parkin和UCH-L1是3种与UPP功能障碍密切相关的突变基因[21]。其中α-syn是UPP主要底物蛋白,大量聚集会导致线粒体损伤诱发细胞凋亡[22]。在氧化应激、环境毒性损害或老化等外部因素作用下,α-syn的异常积聚通过刺激免疫反应、影响自噬、破坏DA的存储与释放等,最终导致DA能神经元细胞凋亡。UCH-L1具有泛素水解酶、连接酶活性,能维持泛素单体稳定,对神经元具有抗氧化保护作用。研究发现,UCH-L1与α-syn共聚集,其家族突变与帕金森病和其他神经退行性疾病相关[23]。UCH-L1的某些翻译后修饰可能促进细胞质的UCH-L1(C)转变为膜相关的UCH-L1(M)形式,在α-突触核蛋白病的形成中发挥了作用[24]。Parkin作为E3泛素连接酶,能参与细胞周期调控、线粒体动态平衡和能量代谢,调节泛素化过程及细胞自噬,在蛋白质分解代谢中发挥着重要作用,这些或许都作为Parkin预防PD的基础[25]。研究表明,TH是催化生物体自身合成左旋多巴胺系列反应中第一步反应的限速酶,在DA合成中发挥重要作用,其含量变化与PD的发生、发展有着重要联系[26]。
本研究从细胞层面验证水木和宁方通过调节UPP功能对PD的影响,并采用MPP+诱导PD体外细胞模型。本研究发现造模后UPP功能异常,TH、UB、UBE1、Parkin和UCH-L1蛋白和mRNA表达明显降低,α-Syn蛋白和mRNA表达明显升高,考虑可能是MPP+抑制了UPP中蛋白酶体的功能,抑制了蛋白降解通路。水木和宁方干预后,TH、UB、UBE1、Parkin和UCH-L1蛋白表达明显升高,α-Syn蛋白表达明显降低,提示水木和宁方可促进蛋白质降解,改善UPP功能。与美多芭组比较,水木和宁方组α-syn蛋白明显降低,TH、UCH-L1、ubiquitin蛋白表达明显升高。本实验结果与本课题组前期动物实验结果一致,由此可见水木和宁方可以通过调控UPP功能,抑制α-Syn蛋白的聚集,从而促进蛋白质的降解,具有良好的保护DA能神经元的作用。
水木和宁方由生地黄、肉苁蓉、狗脊、麦冬等31味药物组成[10]。研究表明生地黄主要是通过豆甾醇作用于MAOA、ADRA1B、ADRA1A等靶点,从多个途径发挥治疗帕金森病的作用[27]。现代药理研究也表明方中多种成分,如肉苁蓉多糖、远志皂苷、牛膝多肽等可以抑制神经元凋亡,抗氧化应激损伤,具有保护多巴胺能神经元的作用[28-31]。鉴于帕金森病发病时间长,“久病入络,久病及肾”及结合自身临床经验,霍青提出了帕金森病以“肝肾亏虚为本,痰浊瘀血为发病之标”的发病机制,并制定了滋补肝肾、活血通络、祛瘀化痰的治疗方法,同时应治标与治本相结合,灵活应用,充分发挥中医药多靶点、整体调节优势。本研究在前期动物实验的基础上,从细胞层面证实水木和宁方能通过提高UPP活性,清除异常蛋白,促进蛋白质降解,从而减轻DA能神经元细胞损伤,为水木和宁方治疗PD提供了理论依据和实验支持,也为PD中西医结合治疗提供了新思路。
