近红外H2S荧光探针研究进展
2022-11-07宋江涛袁跃华朱永军王玉珍田茂忠
宋江涛,袁跃华,朱永军,王玉珍,田茂忠,冯 锋
山西大同大学化学与化工学院,化学生物传感山西省重点实验室,山西 大同 037009
引 言
硫化氢(hydrogen sulfide,H2S)是活性硫家族的成员之一,它在调节细胞内氧化还原状态和其他参与人类健康和疾病的基本信号传导过程中发挥重要作用。比如H2S可以调节免疫系统、 内分泌、 神经、 介导炎症、 细胞凋亡、 血管扩张和胃肠系统等,但其代谢异常又会导致许多疾病:如亨廷顿病,帕金森病和阿尔茨海默氏病等。内源性H2S一般可在三种不同酶的作用下由L-半胱氨酸产生:胱硫醚β-合成酶(CBS),胱硫醚γ-裂合酶(CSE)和3-巯基丙酮酸磺基转移酶(3-MST),酶的催化使得在不同组织和细胞中产生的H2S含量不同。H2S作为一种重要的信号分子,已引起人们对其与生理和病理相关的分子机制的关注,这也导致准确检测H2S浓度的迫切需求和重要性。目前,检测硫化氢的主要方法有: 比色法、 电化学法、 气相色谱、 金属诱导硫沉淀法等,相比较而言,荧光分子探针及成像技术具有灵敏度高、 分辨率高、 非放射性、 价格低、 实时、 对生物体无损伤等优点[1]。为了更好地检测细胞和生物体内H2S浓度,很多科学家开发了近红外荧光探针(发射波长在650~1 700 nm),与短波长激发的荧光探针相比,NIR荧光探针背景干扰少,可以穿透更深层次的组织,并且具有更高的信噪比,对细胞损伤也更小。
近年来,文献报道的近红外型H2S荧光探针主要识别机理[2]包括:(1)基于H2S亲核取代反应;(2)基于H2S还原反应;(3)基于二硫键反应;(4)基于加成反应。本文综述了近三年近红外荧光探针对H2S的识别机理、 探针的性能及其在细胞或生物体中的荧光成像应用,并展望了近红外H2S荧光探针的发展趋势和应用前景。
1 近红外H2S荧光探针
1.1 基于亲核取代反应的近红外H2S荧光探针
硫化氢(H2S)在水溶液中依次水解成HS-和S2-,在生理pH下主要以阴离子状态存在。HS-和S2-是强亲核试剂,这提供了选择性检测H2S的可能性。基于亲核取代反应的H2S荧光探针的识别基团多为强吸电子基团,这些识别基团具有易修饰,响应快,选择性好等优点,故被广泛用于构建近红外H2S荧光探针。
1.1.1 基于2,4-二硝基苯醚(DNP)硫解的近红外H2S荧光探针
2,4-二硝基苯本身带有强吸电子的硝基,因此2,4-二硝基苯基探针一般呈猝灭荧光态,本身荧光量子产率低;但在和H2S反应后,2,4-二硝基苯离去,探针荧光恢复。基于易于制备的二氰基异佛尔酮荧光团,Qian等[3]设计合成了一种在生物系统中使用的邻甲醛基辅助硫解DNP醚NIR荧光探针[图1(a)]。此探针对H2S具有高灵敏度和选择性,加入H2S后,荧光增强160倍,响应时间15 min,检测限(LOD)为58.797 nmol·L-1,斯托克斯位移(Stokes)为170 nm。该探针成功应用于生物系统(活细胞、 组织和小鼠)中H2S荧光成像。

图1 基于DNP的H2S荧光探针结构Fig.1 Chemical structures of DNP-based fluorescent probes for H2S
采用花菁染料,Lin等[4]研制出一种新型高水溶性硫化氢NIR荧光探针[图1(b)]。此探针对H2S的快速响应时间为2 min,在PBS缓冲水溶液中对H2S的LOD为11 nmol·L-1,具有大的斯托克斯位移(90 nm),对H2S检测具有高选择性,无需有机溶剂或表面活性剂的辅助。当和H2S反应后,光诱导电子转移(PET)过程被阻断,探针在680 nm处荧光增强了115倍。在纯生物环境中此探针快速检测有利于体内和体外样品中H2S的监测。探针具有溶酶体靶向性,能够检测酶促/非酶促生物合成H2S。该探针已成功用于活体小鼠H2S检测。
Zhao等[5]选择具有良好化学稳定性的长沙近红外染料CS-OH作为荧光团设计合成了一种新的线粒体靶向NIR硫化氢荧光探针[图1(c)]。在PBS缓冲液(pH 7.4,包含1%DMSO作为溶剂)中加入H2S,探针在660 nm处出现一个新的荧光发射峰;碱性条件下(670 nm激发),在720 nm处出现新的荧光发射峰,这分别归因于CS-OH的酚形式和酚酸根离子形成。该探针化学稳定性好,对H2S响应快速,可高灵敏、 高选择检测H2S,LOD为89.3 nmol·L-1。此探针还成功实现了对活HeLa细胞中外源性与内源性H2S荧光成像。
亚氨基香豆素苯并噻唑(ICBT)荧光团因其高光稳定性和高荧光量子产率而备受关注,2020年,基于HS-引发的两步串联反应(硫解和环化反应)形成ICBT骨架导致荧光增强机理,Zhong等[6]报道了一种NIR硫化氢荧光探针[图1(d)]。在PBS和THF的混合溶液中(10 mmol·L-1,pH 7.4,30%THF),探针本身不发荧光,当加入10当量的HS-时,用562 nm波长的光激发下,该探针发出红色荧光,652 nm处荧光强度增强了200倍。该探针具有大斯托克斯位移(126 nm),对H2S表现出优异的选择性,其LOD为38.3 nmol·L-1。应用研究表明,此探针可以灵敏地检测红酒、 天然水、 活细胞中的H2S,并且可以用于定性检测H2S试纸条。
1.1.2 基于硝基苯并噁二唑(NBD)亲核取代的近红外H2S荧光探针
以NBD醚为反应位点Gong等[7]设计合成了一种新型NIR硫化氢荧光探针[图2(a)],该探针在37 ℃的Tris-HCl缓冲液(含20%THF)中可以选择性识别H2S,可对H2S快速响应(小于3 min),具有大Stokes位移(166 nm)和高灵敏度(LOD: 26 nmol·L-1)。随着H2S的加入,探针在744 nm处形成一个新的荧光发射峰,荧光强度增大40倍。该探针已成功应用于活细胞中外源性和内源性H2S的荧光成像以及活小鼠中H2S的快速成像。
基于双氰基异佛尔酮Huang等[8]开发了一种NIR硫化氢荧光探针[图2(b)]。H2S可以特异性诱导NBD胺键硫解,从探针上裂解NBD部分,从而释放出双氰基异佛尔酮基团。在PBS溶液中,随着Na2S浓度(0~100 μmol·L-1)的不断增加,探针7在670 nm处的荧光明显增强,斯托克斯位移为186 nm,对H2S的LOD为0.03 μmol·L-1。该探针对H2S具有很高的选择性,已成功应用于不同肿瘤细胞和肝组织中的内源性H2S成像。
以香豆素类荧光团为受体,4-氨基-硝基苯并噁二唑和1,8-萘二甲酰亚胺作为能量供体,Zhang等[9]报道了两种基于荧光共振能量转移(FRET)的比率H2S荧光探针[图2(c, d)]。探针识别机理是HS-和酰亚胺碳的亲核加成破坏了花菁荧光团的大共轭体系,导致其近红外吸收的急剧减弱,阻断了FRET过程,绿色荧光增强。在PBS水溶液中,随着NaHS量增加,探针[图2(c)]在665 nm处的荧光强度明显减弱,而530 nm处的荧光强度明显增强,当H2S的浓度从0增加到200 μmol·L-1时,荧光强度比F530/F665从0.75增加到7.6,量子产率从0.6%增大到5.0%,该探针的LOD约为0.5 μmol·L-1,并已成功应用于HepG-2细胞中外源性和内源性H2S的荧光成像。探针[图2(d)]的FRET效率较低,LOD约为1.0 μmol·L-1,加入H2S后,F540/F660从2.6增加到7.8,量子产率从0.3%增大到1.5%。
2020年,基于亚甲蓝荧光团Wei等[10]开发了一种NIR硫化氢荧光探针[图2(e)]。在C2H5OH∶PBS缓冲水溶液中,加入H2S后,NBD基团裂解离去,684 nm处的荧光强度增强,显示出强红色荧光,其荧光强度增大约60倍,检测H2S的LOD为4.3×10-7mol·L-1。该探针可用于细胞荧光成像,还可作为解硫化物中毒的药物。
1.1.3 基于2,4-二硝基苯磺酰(DNBS)的近红外H2S荧光探针
使用BODIPY衍生的三苯胺作为荧光团,Li等[11]构建了一种用于H2S检测的新型NIR荧光探针[图3(a)],该探针在THF和PBS缓冲液的混合溶液中,加入H2S后,探针在716 nm处荧光强度明显增强。探针具有以下优点:对H2S响应迅速(<150 s),灵敏度高(LOD为6.74 nmol·L-1),近红外发射(716 nm),选择性好。该探针已成功用于HCT116细胞内源H2S的荧光成像。
基于具有优异性能的二氰基异佛尔酮荧光染料,Hong等[12]设计合成了一种新型NIR硫化氢荧光探针[图3(b)],该探针引入DNBS,首次利用磺酰胺作为H2S的反应位点,更重要的是它对H2S具有快速(响应时间小于1 min)、 高选择性和高灵敏度(LOD:6 nmol·L-1)响应,具有明亮的近红外荧光输出(荧光增强大于130倍),具有显著的大Stokes位移(221 nm)。而且,它具有较低的细胞毒性,已成功用于活HeLa细胞和活鼠体内H2S的跟踪和成像。
基于四氢喹喔啉亚胺香豆素Feng等[13]开发了一种NIR硫化氢荧光探针[图3(c)]。该探针具有快速、 明显的近红外荧光开启检测H2S的过程,具有很高的选择性和灵敏度(LOD为10 nmol·L-1)。加入NaHS后,在2 min内探针在652 nm处的荧光强度增大约35倍。此外,该探针具有显著的大Stokes位移(128 nm)和低细胞毒性,已成功用于活HeLa细胞外源性H2S和活RAW264.7细胞内源性H2S的荧光成像,同时,此探针也成功用于活鼠实时成像。

图2 基于NBD的H2S荧光探针结构Fig.2 Chemical structures of NBD-based fluorescent probes for H2S
1.1.4 其他基于亲核取代反应的近红外H2S荧光探针
可激活近红外二区(NIR-Ⅱ)荧光探针在深层组织成像中应用前景广阔。Dou等[14]提出了一种灵活的策略来调节NIR-Ⅱ荧光探针的发射波长,基于D-π-A分子骨架设计合成了四种NIR-Ⅱ的H2S荧光探针[图4(a—c)]。通过延长BODIPY荧光团π共轭体系和增强供体的供电子能力,这些探针被H2S激活时的最大荧光发射峰可以从925 nm红移至1 205 nm。经过光物理性能评价,探针[图4(c)]在H2S激活后表现出高灵敏度(LOD为51 nmol·L-1)和高选择性,斯托克斯位移大(>215 nm)、 快速响应和长波段NIR-Ⅱ荧光发射(最大荧光发射峰在1 140 nm)的理想组合,该探针已成功应用于荷瘤小鼠内源性H2S生成和波动的实时监测。此外,通过荧光成像发现H2S浓度与肿瘤进展呈正相关。
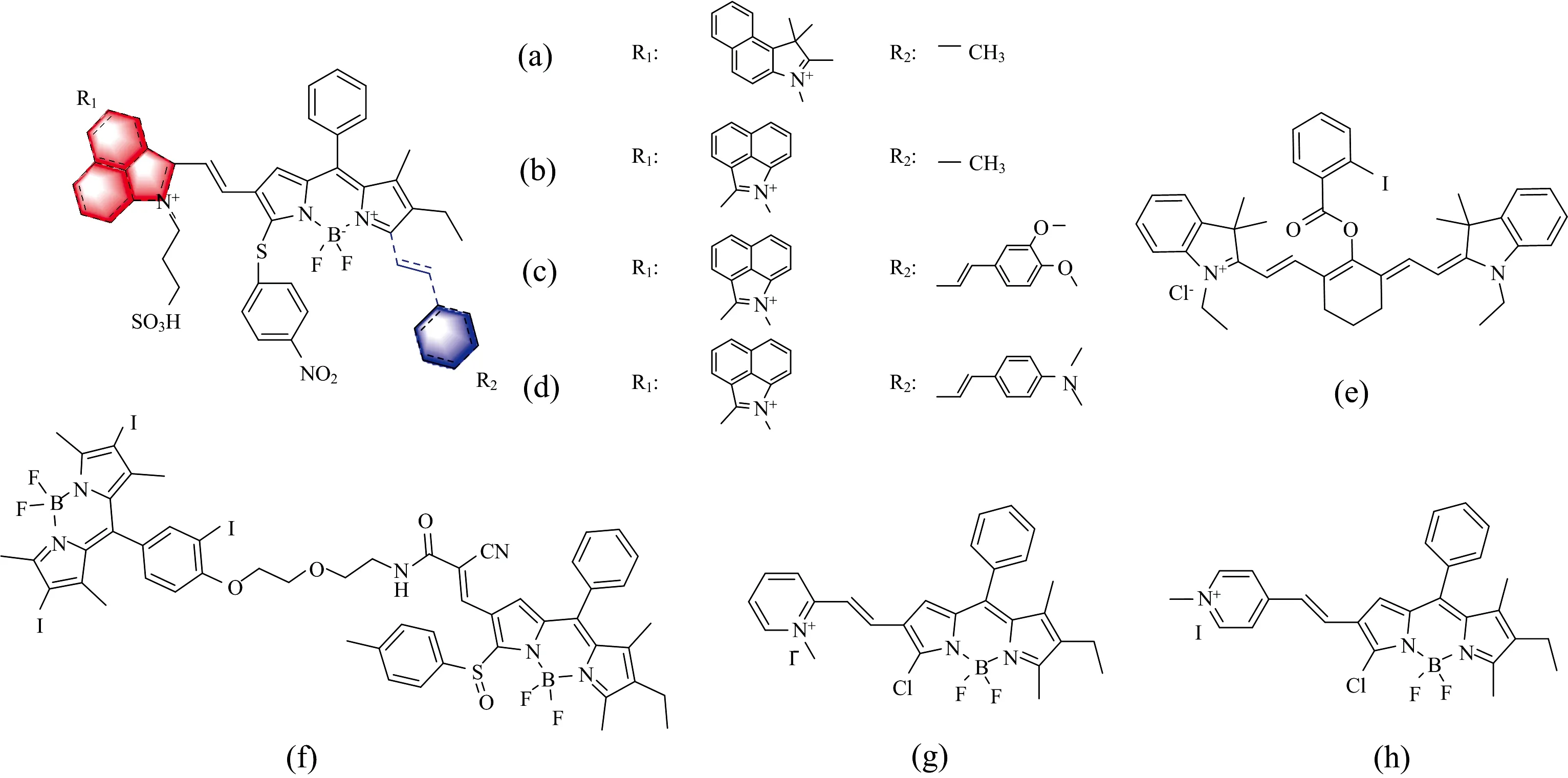
图4 其他基于亲核反应H2S荧光探针结构Fig.4 Chemical structures of other H2S fluorescent probes based on nucleophilic attack
通过荧光成像和光声成像优势互补,Chen等[15]报道了比率光学/PA双模态H2S探针[图4(e)],该探针通过苯甲酰氯与中位羟基取代七甲川菁染料反应合成,识别H2S是基于酮-烯醇异构化传感机理。在HEPES缓冲溶液中,探针的最大荧光发射峰在805 nm处,随着H2S浓度的增加,其630 nm处的荧光强度逐渐增强,805 nm处的荧光强度随之减弱,发射比F630/F805呈线性增强,荧光强度增大183倍,对H2S的LOD为0.5 μmol·L-1,该探针选择性好。通过光学/PA双模成像证实了s-腺苷-甲硫氨酸刺激的内源性H2S在肝脏中增强,证明比率光学/PA双模成像是追踪活鼠和组织中信号小分子浓度增大的有效方法,这将预示光学和PA成像结合起来具有广阔的应用前景。
Wang等[16]研制了一个由H2S激活荧光成像探针[图4(f)]。在PBS缓冲液中,加入100 μmol·L-1H2S,500 nm处的吸收峰强度明显下降,同时655 nm处出现了新的吸收峰,探针红移155 nm,在712 nm处荧光增强137倍。该探针对H2S的检测灵敏度高,NIR荧光随H2S浓度(0~20 μmol·L-1)呈线性增加,LOD为21 nmol·L-1。所设计的探针具有H2S引发近红外荧光点亮与有效生成1O2的优点,能够选择性地可视化富含H2S的癌症。这种可控的光动力抗癌治疗使治疗效率最大化,副作用最小化。值得注意的是,纳米封装的设计加速了探针对于H2S的响应反应。报道说该项工作将促进在癌症的精确诊断和治疗方面的明显进步。
2020年,Wang等[17]报道开发出对H2S聚集增强响应的NIR小分子探针[图4(g,h)],其可用于体内富含H2S癌症的靶向成像。探针设计引入的N-乙基吡啶对亲水性和亲脂性平衡的微妙调节使这些探针具有在生理条件下自发自组装成纳米探针的能力。处于聚集态而不是分子溶解态的这种探针在H2S特异性激活时显示近红外荧光,光声信号打开,根据体内H2S含量差异实现癌症的可视化和分化。在CH3CN/Tris-HCl缓冲体系中,加入H2S后,探针和H2S发生反应,在718 nm处的荧光明显增强,聚集态的探针[图4(g)]对H2S的LOD为60 nmol·L-1,该探针已成功应用于HCT116细胞和荷瘤小鼠中内源性H2S的成像,且可用于区分癌症细胞和正常细胞,此外,在对探针的识别机理探究中发现探针的正电荷密度对HS-富集有重要影响,它可以诱导和加快反应速度。当探针[图4(h)]在FW(80%~100%)缓冲体系中时出现聚集状态,该聚集态探针可对H2S进行特异性识别,744 nm的NIR吸收峰明显增强,探针在聚集态下对H2S的LOD为760 nmol·L-1。
1.2 基于还原反应的近红外H2S荧光探针
H2S是一种强的还原剂,叠氮基与硝基都会被H2S还原,还原成氨基后,其电子性质有明显不同,此外,荧光母体上易引入叠氮基与硝基官能团,因此,一些基于还原反应的近红外H2S荧光探针已被成功构建。
1.2.1 基于叠氮化物还原的近红外H2S荧光探针
为了确定细胞内Ca2+在H2S体内平衡中的作用,Wen等[18]制备了一种NIR硫化氢荧光探针[图5(a)],该探针由4-氨基苯甲醇和NaN3合成了4-叠氮基苯甲醇,然后,利用4-叠氮基苯甲醇与亚甲基蓝的氨基甲酰氯衍生物之间的缩合反应获得探针。5 μmol·L-1的探针在DMSO/PBS缓冲水溶液中没有明显的荧光。加入160 μmol·L-1Na2S后,探针在687 nm处的荧光明显增强,与H2S反应后,探针的荧光量子产率从0.02增加到0.13,探针对H2S的 LOD为0.32 μmol·L-1,响应时间为60 min。使用该探针,他们对Ca2+触发HeLa细胞中过量的H2S水平进行了成像,并研究了它们之间的依赖效应。此外,报道还提供了一个Ca2+介导的活细胞H2S浓度剧增的潜在途径,为活细胞复杂的信号转导提供了新的见解。
用NIR花箐染料作为荧光团Zhou等[19]设计合成了一种新的基于PET的线粒体靶向NIR硫化氢荧光探针[图5(b)]。在HEPES/乙醇缓冲水溶液中,当加入H2S后,探针在736 nm处发射强荧光,其荧光量子产率由0.002增大到0.05,LOD为20 nmol·L-1, 响应时间为30min。在0~40 μmol·L-1范围内,736 nm处的荧光强度与Na2S浓度之间呈现很好的线性关系。该探针不受各种氨基酸和阴离子的干扰,检测H2S选择性好。其具有较低的细胞毒性、 良好的膜通透性和近红外发射优点,已成功应用于活细胞线粒体和体内H2S的成像。
Yao[20]等制备了基于叠氮基的一种高灵敏度和高选择性的NIR荧光探针[图5(c)],该探针具有良好的稳定性、 低LOD和生物安全性。探针的叠氮基提供了HS-的识别位点,质子进一步诱导中间体分解生成荧光染料。在pH 7.4的PBS缓冲液中加入NaHS,625 nm处的吸收峰强度降低,而710 nm处的新吸收峰稳步增强,溶液颜色由蓝色变为绿色,同时,735 nm处的荧光强度增大。该探针735 nm处的荧光强度与NaHS浓度(1~14当量)之间存在线性关系,LOD为26.0 nmol·L-1,响应时间为30 min。重要的是,该探针能够监测药物在活细胞和小动物体内释放的H2S。
1.2.2 基于硝基还原为胺的近红外H2S荧光探针
基于ICT机理,Wu等[21]制备了一种基于异佛尔酮的NIR比率H2S荧光探针[图6(a)]。在pH 7.4的PBS缓冲溶液中加入H2S,探针在565 nm处的荧光强度减弱,650 nm处出现新的荧光发射峰且荧光强度明显增强,溶液颜色由黄色变为红色。该探针检测H2S的灵敏度高(LOD为1.08 nmol·L-1)和响应速度快(<120 s)。此外,MTT结果显示,该探针具有低毒性,其可以对活癌细胞中H2S进行荧光成像且已成功应用于小鼠成像。
Kumar等[22]设计并合成了含有NO2和丙炔氧基两个不同识别官能团的苝二酰亚胺类H2S和Pd0双分析NIR荧光探针[图6(b)]。此探针具有高灵敏度和高选择性,对H2S的LOD为1.21 nmol·L-1(紫外),6.6 nmol·L-1(荧光)。此外,该探针在血清、 尿液和活A549细胞中检测H2S和Pd0的实际应用已得到证实。
1.3 基于二硫键反应的近红外H2S荧光探针
当H2S在硫中心发生亲核进攻之后,生成的中间体也是一种硫醇,这种硫醇可以进行第二次亲核加成。这种双亲核性质是H2S所特有的,一些基于二硫键反应的近红外H2S荧光探针已被成功开发。
基于亲核取代环化反应Men等[23]制备了新型近红外H2S荧光探针[图7(a)]。在DMSO-PBS缓冲水溶液中,当加入S2-的浓度为20 μmol·L-1时,探针的荧光强度达到最大,680 nm处的荧光强度与H2S浓度(0~10 μmol·L-1)呈线性关系,探针对H2S的LOD为1.1 nmol·L-1。此探针在没有H2S存在下对pH不敏感(pH 5.0~10.0)。该探针生物相容性较好,已成功应用于活HeLa细胞中H2S的荧光成像。
基于“连续”亲核取代反应Wang等[24]开发了新型近红外H2S荧光探针[图7(b)]。加入H2S,探针荧光强度增大22倍(639 nm),对H2S的LOD为36 nmol·L-1。此探针可以用于靶向线粒体,可用于检测HeLa细胞中外源性和内源性H2S含量,由于其信噪比高,也适用于小鼠H2S的荧光成像。
1.4 基于加成反应近红外H2S荧光探针
HS-作为良好的亲核试剂,可以加成到荧光分子缺电的碳碳双键上,导致探针分子的π共轭体系破坏,引起荧光发射波长位移,此方法已被用于近红外H2S荧光探针的开发。
基于亲核加成反应Ma等[25]制备出具有优异H2S传感性能的新型NIR荧光探针[图7(c)]。此探针对其他生物相关的阴离子、 阳离子、 活性硫和小分子具有很强的选择性,加入S2-,在655 nm处荧光强度逐渐降低,伴随产生一个新的、 中心在595 nm处荧光强度逐渐增加的发射带,两个发射带的强度比F595/F655从0.37增加到3.43。对H2S有较低的LOD(7.33 nmol·L-1)。此外,探针对H2S响应快(反应在20 s内完成),裸眼观察其颜色由深蓝色变为浅绿色。研究发现该探针具有线粒体靶向能力,对HeLa细胞具有较低的细胞毒性,并已成功用于活细胞和斑马鱼体内的H2S荧光成像与检测。
基于激发态分子内质子转移机理,Du等[26]设计合成了一种新型的近红外线粒体靶向荧光探针[图7(d)]。加入H2S后,探针和H2S发生亲核加成反应导致共轭骨架被破坏,最大发射峰从658 nm蓝移至470 nm。该探针具有响应快(<30 s)、 选择性好和斯托克斯位移大(188 nm)等优点。此探针已成功用于HepG2细胞线粒体中外源性H2S荧光成像。

图7 基于二硫键反应(a和b)与加成反应(c和d)的H2S荧光探针结构Fig.7 Chemical structures of H2S fluorescent probes based on disulfideexchange (a and b) and addition reaction (c and d)
1.5 纳米近红外H2S荧光探针
将有机染料小分子引入纳米粒子内,不仅大大提高了被包裹荧光染料的光稳定性,而且可以防止染料泄露,降低对细胞的毒性,更重要的是,可实现荧光信号放大。基于此已成功设计开发了一些纳米近红外H2S荧光探针。
基于亲核取代反应Shi[27]等开发了一种肿瘤生物标志物激活的光热传感器作为按需释放药物的纳米探针(图8),其特点是硫化氢介导原位产生近红外光热剂,用于成像引导和光控药物释放。用热敏性纳米材料将染料InTBOD-Cl与药物CPT-11封装包裹起来。在CH3CN和PBS的混合溶液中,加入NaHS后,InTBOD-Cl和NaHS发生反应,生成InTBOD-SH,在808 nm光激发下,InTBOD-SH产生明亮的NIR-Ⅱ荧光,而在592 nm处的荧光被猝灭,纳米探针可以高灵敏、 高特异性识别H2S,对富含H2S癌症是一种很有前途的诊断工具,纳米探针的NIR-Ⅱ荧光强度与0~50 mmol·L-1范围NaHS浓度具有好的线性关系,LOD为79 nmol·L-1。该探针已成功应用于HCT116小鼠的肿瘤测试。
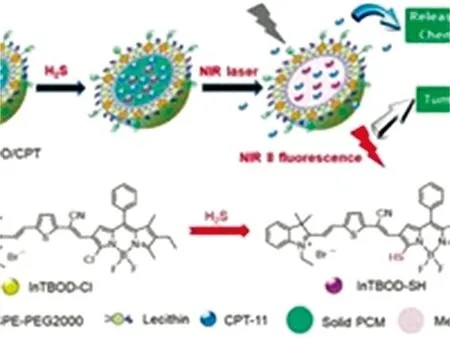
图8 H2S纳米探针(NPs@BOD/CPT)示意图[27]Fig.8 Schematic illustration of nanoprobe (NPs@BOD/CPT) for H2S[28]
Li等[28]研制了一种基于酸激活策略的激发波长为980 nm比率上转换发光(UCL)纳米探针(图9),用于溶酶体辅助线粒体靶向H2S的检测和生物成像。将菁染料衍生物探针(TPAMC)改性的上转化纳米荧光粉UCNP(NaYF4: 20% Yb, 2% Er, 0.2% Tm)作为靶标和响应组分,UCNPs和TPAMC之间的强烈发光共振能量转移(LRET)效应使得可以通过比率UCL信号灵敏地检测H2S。为提高纳米探针在血液循环中的空间位阻稳定性,用对pH敏感的聚乙二醇把TPAMC-UCNP包裹起来。此探针不仅成功用于活细胞中线粒体产生H2S的UCL比率成像,通过NIR-UCL成像定位HCT116(人结直肠癌细胞系)肿瘤,而且也可以用于监测结肠癌小鼠模型中线粒体H2S水平。
基于电致变色材料Wu等[29]报道了一种基于有机π电子结构的EM 12+作为H2S响应发色团,通过掺杂到半导体聚合物纳米颗粒(SPNs)开发出H2S激活NIR荧光探针(图10)。
在PBS缓冲液中,加入H2S,探针在830 nm处荧光明显增强,LOD为0.7 μmol·L-1。探针在830 nm的近红外荧光可以提供更深的成像穿透,提高了非侵入性实时检测小鼠肝脏H2S水平的灵敏度,有助于研究H2S相关的体内肝脏功能障碍。通过方便的荧光成像,提供了高灵敏度、 特异性和快速动力学,可以准确测量人血浆中内源性H2S浓度,此外在小鼠体内注射探针和近红外光照射后,基于H2S相关肿瘤的荧光成像实现了可激活光动力治疗(PDT),提高了肿瘤治疗的特异性和疗效。
Xu等[30]通过将H2S响应的荧光探针ZX-NIR和一种内参比惰性染料aza-BOD封装到核壳硅纳米复合材料的疏水内部开发了H2S近红外二区纳米探针(图11)。该探针具有H2S激活的比率荧光和900~1 300 nm的NIR-Ⅱ发光。在CH3CN/PBS缓冲液中,加入H2S,5 min内600 nm处探针的荧光完全猝灭,但是,当激发波长为780 nm时,H2S激活了一个新的NIR-Ⅱ发射峰,最大发射峰为900 nm。比率检测H2S灵敏度高,LOD为37 nmol·L-1。探针通过双色成像方式可以选择性鉴定富含H2S的结肠癌细胞。此外,论文进一步探索了H2S触发的探针NIR-Ⅱ成像,显示了增强的深层组织穿透和空间分辨率。
为了开发内源性H2S激活的光学探针用于特异性诊断结直肠癌,Deng等[31]研发了一种基于Ag-鸡蛋清(Ag-CEW)复合物的H2S可激活NIR-Ⅱ发射纳米探针(图12)。所设计的Ag-CEW配合物通过内源性H2S诱导的原位化学反应形成Ag2S量子点,在1 090 nm附近有一个很强的NIR-Ⅱ发射峰。通过检测得到LOD为35 nmol·L-1。设计的Ag-CEW配合物具有良好的光稳定性和生物相容性,通过内源性H2S激活,成功用于NIR-Ⅱ成像引导下的HCT-116细胞荧光成像与结直肠癌特异性可视化和精确定位。

图9 H2S纳米探针(TPAMC-UCNPs@PEG)示意图[28]Fig.9 Schematic illustration of nanoprobe (TPAMC-UCNPs@PEG) for H2S[28]

图11 多波长H2S纳米探针结构示意图[30]Fig.11 Schematic illustration of multi-wavelength nanoprobe for H2S[30]
2 结论与展望
H2S是一种具有重要生理功能的内源性气体,为了更好地探索H2S在生理和病理中的动态作用,近红外荧光探针技术发展迅速。本文综述了近三年近红外H2S荧光探针的研究进展,文中例子证明其已取得了很大进步。很多探针已能用于细胞和生物体内H2S荧光成像,但由于细胞与生物体内环境复杂,检测时干扰因素多,开发高性能生物用近红外H2S荧光探针仍具有很大挑战。多数报道的近红外H2S有机小分子荧光探针检测H2S时都需要加入有机助剂,而且多数探针响应H2S时间较长。为了实现近红外探针在细胞与生物体内对H2S的无毒、 实时检测应用,科学家开始研制纳米近红外探针。一般情况下H2S纳米探针的水溶性好、 检测速度快、 LOD低,具有更好光物理性质和更高靶向性,更有利于在生物方面的应用,因此开发对H2S具有优异识别性能的NIR纳米荧光探针也是目前研究的热点课题之一。此外,生物体内有很多其他物种,比如,生物硫醇、 其他气体信号分子一氧化氮和一氧化碳等,很多生理与病理过程受到H2S与它们相互作用“crosstalk”的影响,所以,设计开发NIR荧光探针对它们相互作用进行原位、 实时、 动态的可视化检测具有重要意义。期望此综述将有助于设计高性能近红外荧光探针来检测活细胞与活体中的H2S。

图12 Ag-CEW纳米探针合成过程示意图和内源性H2S触发的结肠癌高特异性可视化[31]
