miR-4324与Talin2在乳腺癌中高表达
2022-11-03朱海涛裴文浩许培海丁勇兴
高 鹏,朱海涛,裴文浩,许培海,丁勇兴
1蚌埠医学院附属蚌埠市第三人民医院普外科,安徽 蚌埠 233099;2蚌埠医学院癌症转化医学安徽省重点实验室,安徽 蚌埠233030
2020年全球女性乳腺癌发病人数226.1万例,占全部恶性肿瘤的24.5%,致死率也高达15.5%,均位列首位[1]。临床上乳腺癌首选手术治疗,跟据个体差异选择增加内分泌治疗及放化疗等。但部分患者发现不及时,导致复发和转移,预后较差[2]。因此,早发现并及时给予临床干预是改善预后的积极手段。
miRNA是一种内生性、非编码的小分子RNA,长约19~25个nt[3]。miRNA可通过靶基因的表达,从而影响细胞增殖、凋亡和侵袭等生物学活性[4]。研究发现miR-4324通过靶向抑制RacGTP酶激活蛋白1基因在RCC细胞(肾细胞癌)中的表达,从而抑制RCC细胞的增殖[5];通过调控靶基因瓣膜特异性核酸内切酶1(FEN1),抑制卵巢癌细胞生长,增加其凋亡率[6]。经Targetscan 分析发现,Talin2 与miR-4324 存在结合位点,可能为其潜在的靶基因之一。踝蛋白(Talin)是一类大的、多结构域的胞膜蛋白,参与合成粘着斑[7]。Talin2表达的上调可以显著增加乳腺癌细胞的转移与侵袭力[8]。
目前对于miR-4324及Talin2在乳腺癌组织中的表达以及与乳腺癌临床病理之间的相关性尚无报道。本研究通过分析miR-4324和Talin2在乳腺癌组织和癌旁乳腺组织中的表达情况,结合病理资料分析临床意义,为乳腺癌的早期诊断及预后评估提供相关标志物。
1 资料和方法
1.1 标本来源
本研究所选标本均来自蚌埠医学院附属蚌埠第三人民医院普外科及蚌埠医学院第一附属医院甲乳外科2020年10月~2021年12月通过手术治疗的15例乳腺浸润性导管癌的癌组织(BCT)及其癌旁组织(PCBT)的新鲜标本(PCBT需距离肿瘤组织边缘>5 cm)。纳入标准:经病理学检查确诊为乳腺癌的患者。排除标准:有其他恶性肿瘤史;有长期服用相关抗肿瘤药物史;有远处转移;有任何放化疗等相关治疗史。患者同意本研究方案并签署知情同意书,并经蚌埠医学院伦理委员会审批(伦科批字:2020第69号)。
1.2 标本处理
术中摘除组织后,用0.9%的生理盐水冲净血渍,于无菌操作下剖开组织,仔细确认后切取部分肿瘤组织及癌旁乳腺组织,两者大小1.0 cm×1.0 cm×0.5 cm;放入10 mL无酶离心管中,并注入能没过组织的RNA保护液;将离心管放入液氮罐或冰盒中运输,后在-80 ℃的条件下保存。收集的手术标本分成两份,其中15例样本用于术后的病理及免疫组化检查,符合样本要求的13例用于qRT-PCR检测miR-4324的表达。
1.3 一般资料与临床病理特征
收集的乳腺浸润癌患者均为女性,年龄43~87岁。标本的病理结果已被两所医院的病理科确认。根据美国肿瘤联合会第8版乳腺癌分期标准(TNM法),其中临床分期为Ⅰ~Ⅱ期的患者共13人,Ⅲ期共2人。淋巴结(+)5人,淋巴结(-)10人。
1.4 实验材料
SKBR-3(中科院细胞研究所);miR-4324 mimics(上海吉玛);新生胎牛血清(FBS)购自LONSA;DMEM培养基(Gibco);TRIzol试剂(Invitrogen);PCR试剂盒(Vazyme);Transwell 小室(Corning);pmirGLO 载体(GenePharma);焦碳酸二乙酯(DEPC)购自Sigma;兔抗人Talin2一抗(abclonal)。
1.5 实验步骤
1.5.1 免疫组化 将取到15例的乳腺组织进行石蜡包埋,后用机器切成约4 μm厚的石蜡切片;将切片脱蜡至水化,加入3%的H2O2,室温孵育20 min;用磷酸盐缓冲液(PBS)冲洗3遍,修复抗原;37 ℃条件下孵育一抗2 h,PBS冲洗3遍;相同条件孵育二抗1 h,清洗3遍;使用二氨基联苯胺(DAB)进行显色处理,镜下观察并拍照。Talin2染色结果的判定:当细胞膜、胞浆出现黄褐色、棕黄色颗粒时为判定依据,未着色、低于10%的细胞着色者记0分,高于10%则代表Talin2染色阳性,其中着色弱且无连续性记1分,着色中等、着色部分不连续记2分,着色强且连续性佳记3分。0~1分视为Talin2低表达,2~3分视为Talin2高表达。
1.5.2 细胞培养 人乳腺癌细胞SKBR-3置于10%灭活胎牛血清的DMEM培养基中,5%CO2和37 ℃细胞培养箱中培养;细胞融合度在90%左右时进行传代处理;根据具体生长情况予以换液或消化。
1.5.3 细胞转染 人乳腺癌细胞株(SKBR-3)体外培养,分为Control对照组(正常培养)及相关转染组(转染相关片段):miR-4324 mimics组;miR-4324 inhibitor组;miR-4324 NC组;si-Talin2组;miR-4324 inhibitor+si-Talin2组。在六孔板中接种SKBR-3细胞;配比转染试剂:A液为250 μL 无血清培养基+5 μL Lipo 2000,B液为250 μL 无血清培养基+5 μL mimics,A、B液混合均匀后静置一段时间即可;细胞融合度达在50%~60%时,根据分组,加入转染试剂和1.5 mL无血清培养基,轻轻摇匀后放入细胞培养箱中培养;6 h后,予以换液,加入10%灭活胎牛血清的DMEM培养基2 mL。
1.5.4 RNA的提取 细胞处理:采用0.25%-EDTA胰酶进行细胞消化,将得到的悬液于1500 g离心5 min,得到细胞沉淀;加入苯酚试剂(TRIzol)1 mL,静置20 min。组织处理:取出装有组织的离心管,解冻后将组织剪成适宜大小,将其与2~4颗钢珠球一起加入1.5 mL的无酶Ep管中,加入苯酚试剂1 mL,研磨,冰上10 min。提取RNA:将制备好装有细胞和组织的Ep管加入0.2 mL的三氯甲烷,震荡直至乳状,冰上5 min;12 000g,4 ℃离心15 min;上清吸至新的Ep管中,加入0.5 mL异丙醇,相同条件下离心10 min,得到RNA沉淀;加入1.0 mL 75%乙醇洗涤沉淀,7600 g,4 ℃离心5 min;沉淀中加入DEPC水溶解,-80 ℃保存。
1.5.5 qRT-PCR检测 利用SYBR荧光染料法检测miR-4324的表达,miR-4324 RQ(相对表达量)的计算公式为:RQ=2-ΔΔCT,其中ΔΔCT=(CTmiR-4324-CTU6RNA)BCT-(CTmiR-4324-CTU6RNA)PCBT的均值。qRT-PCR检测Talin2 表达量。根据试剂盒指示进行逆转录合成cDNA后进行PCR扩增。
1.5.6 细胞增殖实验 胰酶消化对数生长期的SKBR-3细胞,接种在96孔板,密度为2×103/孔;细胞融合达60%左右时予以转染,继续培养;分别与24、48、72、96 h时加入10 μL的CCK-8溶液,孵育1 h;酶标仪测定细胞的吸光度值A450nm。
1.5.7 细胞凋亡检测 将处于对数生长期的细胞用胰酶消化,接种于6孔板内,37 ℃细胞培养箱内培养;当细胞生长至60%~70%左右时按分组处理,继续培养24 h;加入无EDTA胰酶消化5~10 min,终止消化;1500 r/min离心3~5 min,弃上清,1%FBS调整细胞浓度;加入异硫氰酸荧光素(FITC)和藻红蛋白(PE),避光孵育30 min;上机检测。
1.5.8 细胞迁移实验(划痕实验)对数生长期的SKBR-3细胞调整至适宜浓度;培养24 h后移液枪头垂直划痕,显微镜观察并拍照;继续培养48 h,观察并记录SKBR-3细胞的迁移活动情况。
1.5.9 Transwell细胞侵袭、迁移实验 带有基质胶预涂的24孔Transwell小室(迁移实验不铺胶)下室加入无血清含10%胎牛血清的培养基600 μL;消化各组SKBR-3细胞,无血清DMEM培养基重悬,调整细胞浓度,取细胞悬液100 μL加入transwell上室;培养箱中孵育24 h后,取出小室弃上清液,用棉签擦去小室内残余细胞;4%的多聚甲醛溶液固定;吉姆萨染色,倒置显微镜下(100×)随机计数5个视野中穿膜细胞数并拍照。
1.5.10 荧光素酶活性检测 合成含有miR-4324 靶点的Talin2 野生型(WT)或突变型(MUT)片段,并克隆入pmirGLO载体,构建pmir-GLO-Talin2-WT和pmir-GLO-Talin2-MUT 荧光素酶报告载体;用Lipofectamine 2000将荧光素酶报告载体和miR-4324模拟物/miR-4324 阴性对照组(NC)共转染SKBR-3细胞;转染48 h后,用双荧光素酶检测试剂盒分别检测萤火虫酶活性和海肾荧光活性。
1.5.11 Western blot检测蛋白表达 将对数生长期的细胞消化、离心、洗涤后加入蛋白裂解液(裂解液∶PMSF=100∶1),置于冰面50 min 4 ℃,12 000g离心15 min,取上清检测蛋白浓度;配置BCA工作液(A液∶B液=50∶1);将0、1、2、4、8、12、16、20 μL的蛋白标准品与2 μL的待测样品分别加到96孔板中,并用PBS液补足至20 μL,再加入200 μL的BCA工作液,37 ℃孵育30 min;酶标仪测A562nm值,做蛋白标准曲线,计算待测蛋白浓度;SDSPAGE电泳、转膜后,一抗孵育过夜,TBST缓冲液洗膜3次,20 min/次;二抗(稀释度1∶5000)37 ℃孵育2 h,洗膜,凝胶成像系统拍照并记录。
1.6 统计学分析
SPSS 21.0软件统计分析,使用Fisher确切概率法、配对t检验,Graphpad 8.3.0软件作图,均数±标准差表示计量资料,t检验表示两样本均数间差异,P<0.05时认为差异具有统计学意义。所有相关实验均独立进行3次。
2 结果
2.1 Talin2在乳腺癌组织中高表达
用石蜡包埋的BCT及PCBT行免疫组化法来测定Talin2的表达水平。结果发现,Talin2在BCT中主要表达呈阳性,PCBT中表达为阴性(图1)。
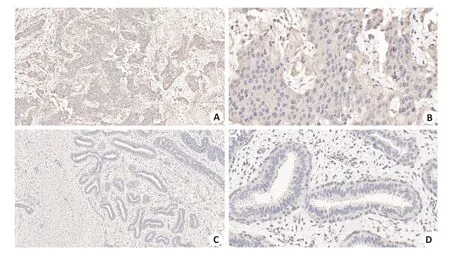
图1 免疫组化检测BCT及其PCBT中Talin2的表达Fig.1 Immunohistochemical detection of Talin2 expression in breast cancer tissues(A,B)and adjacent tissues(C,D)(Original magnification:A,C:×10;B,D:×40).
2.2 乳腺癌患者中Talin2表达与临床病理特征的相关性分析
结合相关病理资料,用统计学方法分析相关性,结果发现Talin2的表达在年龄、组织学分级、临床分期、ER和PR 表达差异等病理参数中的差异无统计学意义(P>0.05),而在淋巴结转移、HER-2的表达差异有统计学意义(P<0.05,表1)。
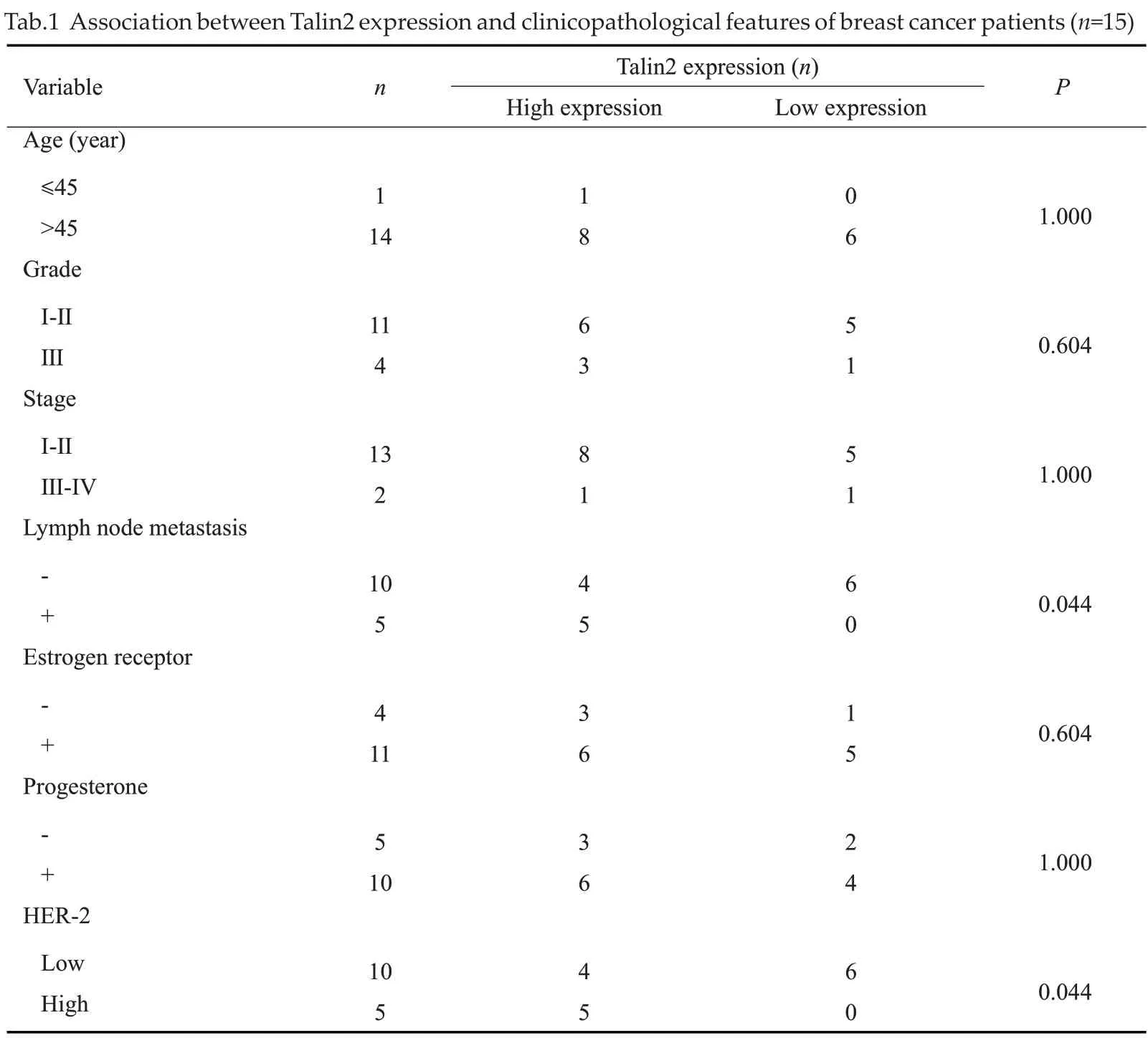
表1 Talin2表达与乳腺癌患者临床病理间的关联
2.3 miR-4324在乳腺癌组织中表达下调
利用qRT-PCR 检测乳腺癌组织(BCT)和癌旁组织(PCBT)中miR-4324的差异表达。结果发现,相对于PCBT,miR-4324在BCT中的表达下调-10.27±1.66vs-6.64±2.49(P<0.01,图2)。
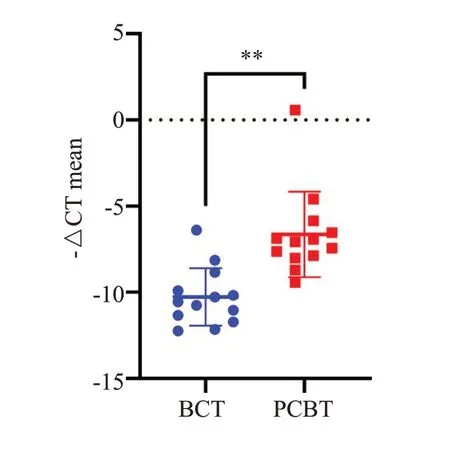
图2 miR-4324在乳腺癌组织(BCT)和癌旁组织(PCBT)的表达情况Fig.2 miR-4324 expression in breast cancer tissues (BCT) and adjacent tissues (PCBT)detected by qRT-PCR.**P<0.01 BCT vs PCBT.
2.4 miR-4324抑制SKBR-3细胞的增殖能力
SKBR-3 细胞中转染miR-4324 mimics 后,利用qRT-PCR技术检测miR-4324的表达,结果发现,相对于对照组(Control),miR-4324 阴性对照组(Negative control NC)miR-4324 的表达差异无统计学意义,miR-4324 mimics组差异有统计学意义119.04±19.23vs1.00±0.00(P<0.01)。利用CCK-8 实验检测miR-4324对细胞增殖的影响,结果发现,相对于Control组,miR-4324 mimics后吸光度值明显降低,24、48、72、96 h时,Control组与miR-4324 mimics组的吸光度值分别为:0.28±0.04vs0.25±0.03;0.64±0.01vs0.44±0.02;1.02±0.01vs0.65±0.03;1.14±0.03vs0.81±0.02,差异具有统计学意义(P<0.01,图3)。
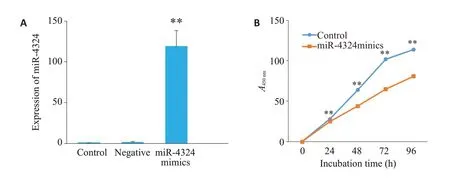
图3 miR-4324 mimics对SKBR-3细胞增殖的影响Fig.3 Effect of miR-4324 mimics on proliferation of SKBR-3 cells.A:qRT-PCR to verify the transfection efficiency of miR-4324 mimics.B: Effect of miR-4324 mimics on proliferation of SKBR-3 cells detected by CCK-8 assay.**P<0.01 vs control group.
2.5 miR-4324诱导SKBR-3细胞的凋亡
利用流式细胞术检测miR-4324对细胞凋亡的影响,结果发现,相对于Control组,miR-4324 mimics组中SKBR-3 细胞的凋亡增加(13.78±1.15)%vs(3.85±0.64)%(P<0.01,图4)。
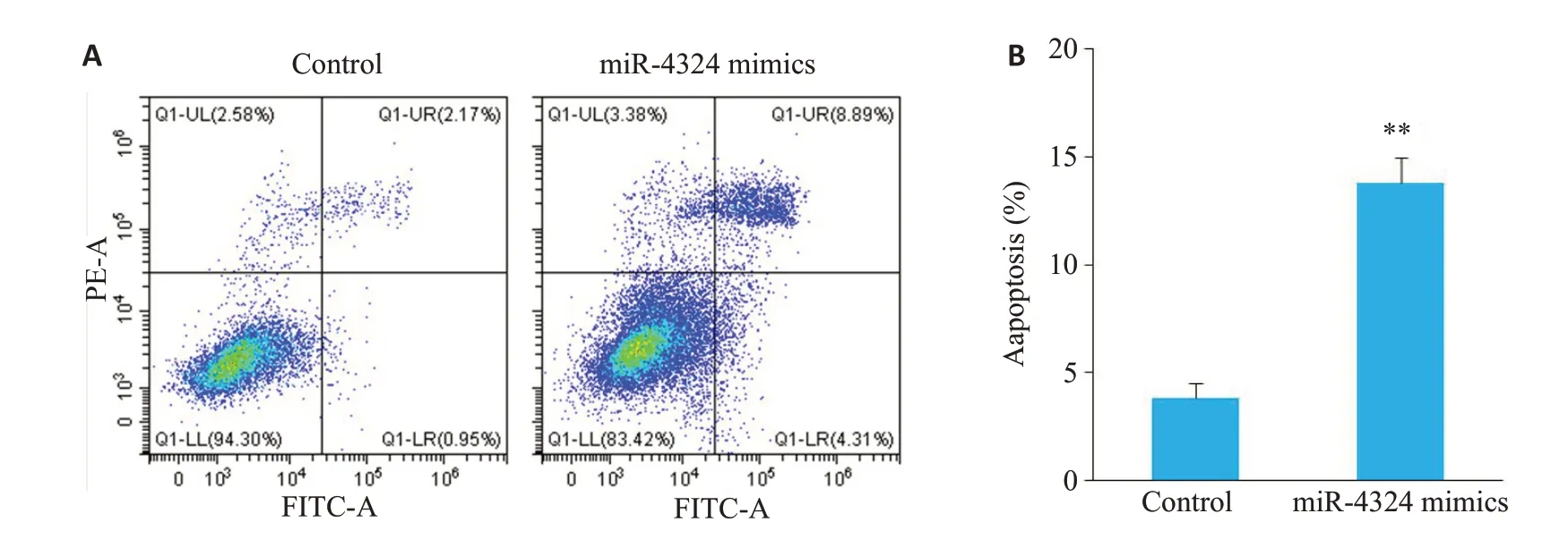
图4 miR-4324 mimics诱导SKBR-3细胞的凋亡图4 Effect of miR-4324 mimics on apoptosis of SKBR-3 cells.A:Effect of miR-4324 on apoptosis detected by flow cytometry;B:Quantitative analysis of the results.**P<0.01.
2.6 miR-4324抑制SKBR-3细胞的迁移和侵袭能力
划痕与侵袭实验结果显示,48 h时,相对于对照组(Control),miR-4324 mimics 组中SKBR-3 细胞的迁移能力(7.73±1.60)%vs(31.9±2.82)%(P<0.01,图5)和侵袭能力均下降81.33±30.83vs174.00±64.09(P<0.05,图6)。

图5 miR-4324 mimics对SKBR-3细胞迁移能力的影响Fig.5 Effect of miR-4324 mimics on the migration capacity of SKBR-3 cells.A:Scratch experiments(×100).B:Quantitative analysis of the results.**P<0.01.
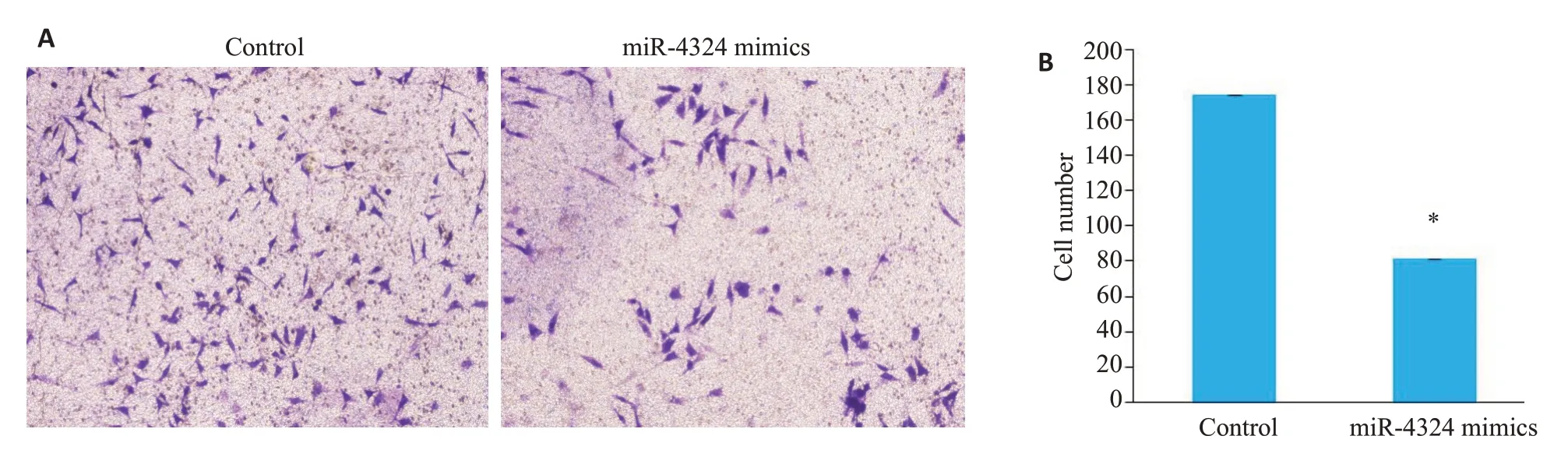
图6 miR-4324 mimics对SKBR-3细胞侵袭能力的影响Fig.6 Effect of miR-4324 mimics on invasive ability of SKBR-3 cells.A:Invasion experiments(×100).B:Quantitative analysis of the results.*P<0.05.
2.7 miR-4324 mimics靶向抑制Talin2的表达
为了确定miR-4324的潜在靶基因,经TargetScan分析,表明Talin2与miR-4324存在结合位点,可能为其潜在的靶点之一(图7)。构建含Talin2 3'-UTR与miR-4324结合位点野生型(WT)和突变型(MUT)的双荧光素酶基因报告载体(图8A),荧光素酶活性实验结果表明,相对于control组,miR-4324 mimics共转染可显著降低Talin2-3'-UTR WT 报告质粒的荧光素酶活性(1.00±0.04vs0.74±0.10,P<0.05),而Talin2-3'-UTR MUT报告质粒的荧光素酶活性未见统计学差异(1.02±0.03vs1.00±0.07,P>0.05,图8B);利用qRT-PCR 及Western blot技术检测miR-4324对Talin2表达的影响,结果发现,相对于control组,miR-4324 mimics组Talin2的mRNA(0.82±0.27vs1.00±0.00,P<0.05,图9A)和蛋白表达降低(0.68±0.12vs1.00±0.10,P<0.05,图9B、C)。

图7 TargetScan预测的miR-4324与Talin2互补结合位点图Fig.7 Complementary binding sites of miR-4324 and Talin2 predicted by TargetScan.
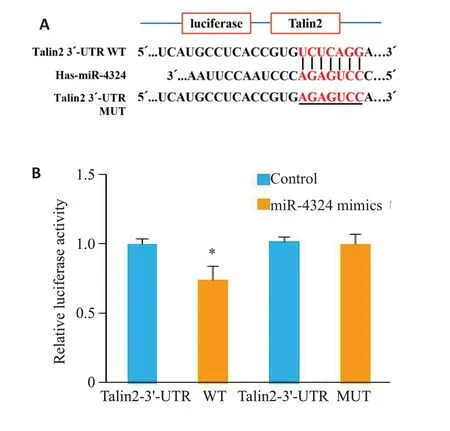
图8 荧光素酶活性实验验证miR-4324与Talin2的关系Fig.8 Luciferase activity assay for validating the relationship between miR-4324 and Talin2.A: Potential binding site between miR-4324 and the 3'-UTR region of Talin2.B:Dual luciferase reporter gene validation of miR-4324 target gene Talin2.*P<0.05.
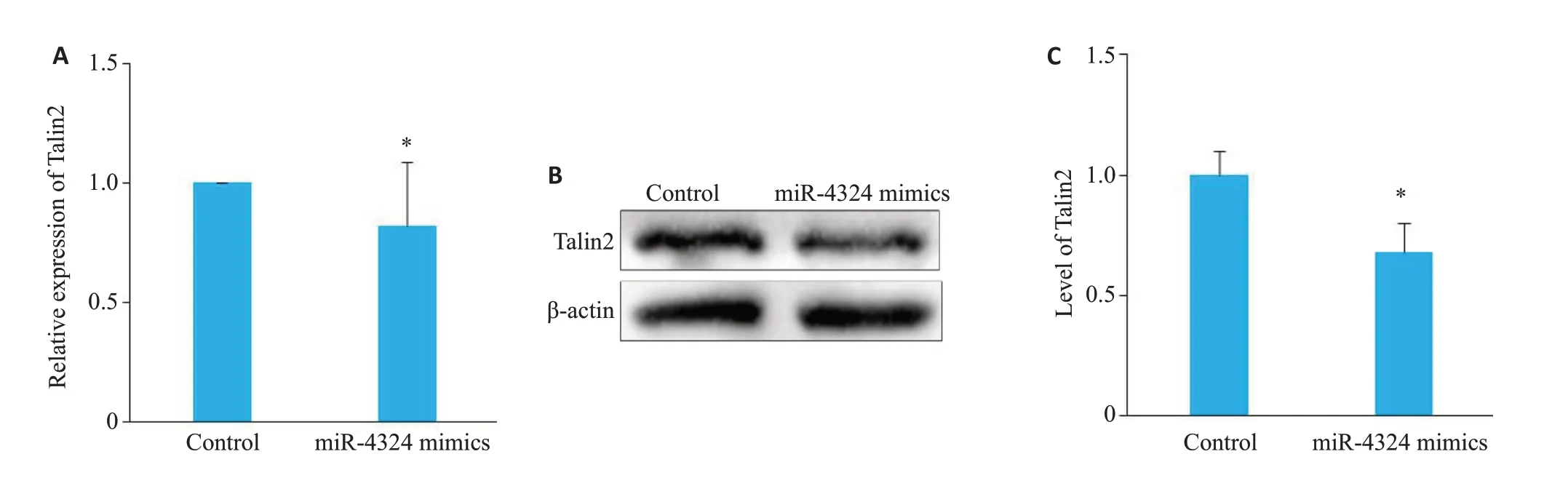
图9 通过Western-blot及qRT-PCR检测SKBR-3细胞中Talin2的表达水平Fig.9 Detection of Talin2 expression in SKBR-3 cells by qRT-PCR(A)and Western blotting(B).C:Quantitative analysis of the results of Western blotting.*P<0.05.
2.8 miR-4324通过靶向抑制Talin2来抑制乳腺癌细胞SKBR-3细胞的迁移能力
为了验证miR-4324影响乳腺癌细胞的迁移能力是通过Talin2 发挥作用,我们进行了Transwell 迁移实验。结果提示,相对于对照组(Control),miR-4324 inhibitor 组中SKBR-3 细胞的迁移能力增强(351.6±45.0vs271.3±68.8,P<0.01);si-Talin2组中SKBR-3细胞的迁移能力降低(151.2±18.2vs271.3±68.8,P<0.01);miR-4324 inhibitor+si-Talin2组中SKBR-3细胞的迁移能力居中(201.5±27.2vs271.3±68.8,P<0.05);(201.5±27.2vs351.6±45.0,P<0.01,图10A、B)
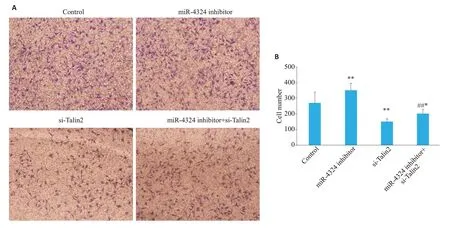
图10 miR-4324 inhibitor调控Talin2对SKBR-3细胞迁移的影响Fig.10 Effect of miR-4324 inhibitor-mediated regulation of Talin2 on migration of SKBR-3 cells.A:Transwell migration experiment(×100).B:Quantitative analysis of the results.*P<0.05,**P<0.01 vs control group;##P<0.01 vs miR-4324 inhibitor group.
3 讨论
乳腺癌是一种分布广泛,且致死率偏高的恶性肿瘤[9]。临床上急切需求新的诊断方法与治疗方案,提高乳腺癌早期检出率,以及尽可能降低治疗损伤及副作用,达到“精准治疗”[10]。乳腺癌相关病理生理是一个极为复杂的过程,涉及到多种基因表达的差异以及信号通路的变化[11],因此尚需寻找关键的调控因子。
目前研究发现,miRNA在肿瘤的发生发展、耐药机制以及早期诊断方面的发挥关键的作用[12]。miRNA的异常表达可以直接参与肿瘤细胞的增殖、迁移、免疫以及细胞凋亡等生理过程[13-15]。研究表明,miRNA可通过与特定的靶点相结合来调控靶基因的表达,从而参与肿瘤细胞生物学活性的调控[16]。癌基因P-21激活激酶1(PAK1)是miR-494的直接靶点,乳腺癌中miR-494表达下调,导致PAK1的表达增加,从而诱导乳腺癌细胞的增殖、转移和侵袭[17];miR-4443高表达可通过抑制其靶基因磷脂酰乙醇胺结合蛋白1的表达来诱导乳腺癌的转移[18]。因此,miRNA有望成为乳腺癌诊断及治疗中的关键靶点。研究发现过表达miR-4324抑制Rac-GTP酶激活蛋白1,拮抗膀胱癌的生长[19];食管鳞癌细胞中,miR-4324可通过降低内粘着斑激酶(FAK)的表达,抑制食管癌细胞的侵袭等能力[20]。乳腺癌中,通过临床样本横断面研究,发现乳腺癌组织中miR-4324表达下调[21]。在三阴乳腺癌中,发现PTEN缺失与miR-4324、miR-125b、miR-145和miR136等表达下调与乳腺癌转移相关,可预测不良预后[22]。本研究发现miR-4324在乳腺癌组织中的表达明显低于癌旁组织,过表达miR-4324可抑制细胞的增殖、侵袭和迁移能力,并诱导凋亡,表明在乳腺癌中miR-4324可能作为一个潜在的抑癌基因发挥作用。但关于miRNA-4324在乳腺癌中的作用及相关靶蛋白尚未见报道。利用Targetscan数据库分析,发现Talin2与miR-4324存在潜在的结合位点,预测Talin2是miR-4324的靶基因之一。
Talin2在肿瘤的发生发展中发挥着重要作用[23-25],可影响肿瘤细胞的侵袭、血管生成,以及转移等,从而加速肿瘤细胞轴突树突的形成、运动以及通过血管渗入组织导致肺转移[26];阻断乳腺癌细胞中Talin2的表达后,细胞核与染色质明显缩小,且形态学也发生明显改变,表明低表达Talin2诱导肿瘤细胞凋亡,并抑制细胞的转移和侵袭力[27]。
临床上,肿瘤组织的病理学特征可作为判断乳腺癌类型、临床分期、分子分型和预后等[28],其中淋巴结转移与术后复发关系密切,激素受体的表达及HER-2受体表达水平是确定内分泌及靶向治疗的关键指标[29]。本研究发现,在miR-4324低表达的乳腺癌组织中,Talin2表达呈阳性,而对应的癌旁组织表达几乎为阴性,表明Talin2在乳腺癌中的表达增高,且miR-4324与Talin2成负相关,过表达miR-4324可靶向抑制Talin2的表达。通过临床病理特征的相关性分析,发现Talin2与淋巴结的转移、HER-2的高表达呈正相关。Transwell的回复实验证明了miR-4324通过靶向调控Talin2抑制乳腺癌细胞SKBR-3细胞的迁移能力。Wen[30]等也证实Talin2表达的上调可以显著增加乳腺癌肿瘤细胞的侵袭及转移能力。
综上所述,本研究证实在乳腺癌中,miR-4324低表达而Talin2表达上调,与乳腺癌患者的淋巴结转移和HER-2表达呈正相关;过表达miR-4324可抑制乳腺癌细胞的增殖、侵袭与迁移,并诱导凋亡;miR-4324通过靶向抑制Talin2来抑制乳腺癌细胞SKBR-3细胞的迁移能力。进一步阐明miR-4324及其靶基因Talin2的作用机制,可为乳腺癌患者的早期诊断以及个体化、精准化治疗提供理论依据和分子标志物。
