奥贝胆酸对DEHP亚急性暴露导致小鼠胆汁淤积的保护作用
2022-11-03屈明超张佳怡王建青
屈明超,赵 凡,张 程,张佳怡,叶 露,张 伦,余 芸,王建青
胆汁淤积是由各种原因引起的胆汁合成、分泌及排泄障碍而导致胆汁过度堆积的过程[1]。已知胆汁淤积的发生涉及雌激素、遗传及环境等多种因素。邻苯二甲酸二(2-乙基己基)酯[di(2-ethylhexyl) phthalate,DEHP]是邻苯二甲酸酯(phthalates, PAEs)中应用最广泛的增塑剂,生活中被广泛应用于各种塑料制品中[2-3]。已知DEHP可通过氧化应激和炎症反应等对肝脏产生毒性作用[4],另有临床研究[5]表明使用含有DEHP的输液管可显著增加胆汁淤积发生率。针对胆汁淤积性肝损伤,目前临床治疗上仍无特效药物,主要使用的有熊去氧胆酸(ursodeoxychofic acid,UDCA)和腺苷蛋氨酸等[6],然而对于部分胆汁淤积患者并没有很好的治疗效果。奥贝胆酸(obeticholic acid,OCA)是一种选择性法尼醇X受体(farnesoid X receptor,FXR)激动剂,在调节胆汁酸代谢中发挥着重要的作用[7]。该研究旨在探究DEHP暴露与胆汁淤积的关系,以及OCA后处理的保护作用。
1 材料与方法
1.1 材料
1.1.1实验动物 雌性ICR小鼠,8周龄,26~30 g,SPF级,购于北京维通利华实验动物技术有限公司。小鼠饲养在适宜的环境中:温度保持在(25±1)℃,湿度保持在(55±5)%,实验开始前将小鼠适应性饲养7 d。本研究所使用的动物实验均已通过安徽医科大学动物伦理委员会审查并批准(编号:20200523)。
1.1.2主要试剂 天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、总胆汁酸(total bile acid,TBA)试剂盒购于浙江伊利康生物技术有限公司;DEHP购于美国默克公司;OCA购于美国MedChemExpress公司;FXR抗体购于英国Abcam公司。
1.1.3主要仪器 超纯水仪(型号:Cascada TM I)购于美国颇尔公司;多功能酶标仪(型号:SENERGY 2)购于美国伯腾仪器公司;荧光定量PCR仪(型号:Light Cycle®480 Ⅱ)购于瑞士罗氏公司;全自动生化分析仪(型号:CS-T300)购于长春迪瑞医疗科技股份有限公司;GSY-8电热恒温水浴锅(型号:ALLEGRA X-15 R)购于北京市医疗设备厂;高速冷冻离心机(型号:5427 R)购于德国艾本德股份公司;正置多功能荧光显微镜(型号:BX 53+DP 80+Cellsens)购于日本奥林巴斯公司。
1.2 方法
1.2.1动物分组与处理 实验一:将雌性ICR小鼠随机分为对照组、DEHP低剂量组[50 mg/(kg·d)]、DEHP高剂量组[200 mg/(kg·d)],每组10只,共灌胃18 d。所有小鼠在剖杀取材前禁食6 h,收集血液和肝脏组织用于后续实验。实验二:将雌性ICR小鼠随机分为对照组、OCA单独干预组(5 mg/kg)、DEHP模型组[200 mg/(kg·d)]、DEHP+OCA组,每组10只,共灌胃18 d。DEHP灌胃时间为每天早上9点,OCA单独干预组和DEHP+OCA组中OCA灌胃时间为第12~18天每天早上7点,在最后一次DEHP灌胃结束后禁食6 h剖杀取材,收集血液和肝脏组织用于后续实验。
1.2.2血清生化检测 使用生化分析仪检测血清中ALT、AST、TBA含量。
1.2.3肝脏组织TBA测定 准确称量100 mg小鼠肝脏组织,加入1 ml 75%乙醇溶液进行组织匀浆,之后将组织匀浆液50 ℃水浴2 h,然后用离心机以9 000 r/min离心10 min,吸取上清液,用生化分析仪检测。
1.2.4Western blot检测蛋白表达 称取小鼠肝脏组织50 mg,加入500 μl 裂解液低温研磨后放入4 ℃冰箱裂解30 min,离心获得总蛋白,使用酶标仪测定蛋白浓度并进行定量。总蛋白经SDS-PAGE电泳分离,转膜到 PVDF膜上,用5%脱脂牛奶封闭1 h,室温孵育一抗[FXR一抗浓度1 ∶2 000,2 h;GAPDH一抗浓度1 ∶5 000,1 h],再用相应二抗(1 ∶40 000)室温孵育2 h。使用 ECL化学发光试剂盒在显影仪上显影,用Image J软件分析蛋白条带,计算蛋白表达量。
1.2.5RT-PCR检测相关基因 采用TRlzol法提取肝脏RNA,将所有提取的RNA样品的浓度定量在500 ng/μl,逆转录成cDNA,之后进行扩增反应,选取18S作为内参基因,计算FXR、小异二聚体伴侣(small heterodimer partner,SHP)和18S核糖体RNA(18S ribosomal RNA,18S)基因的相对表达水平。基因的引物序列见表1。
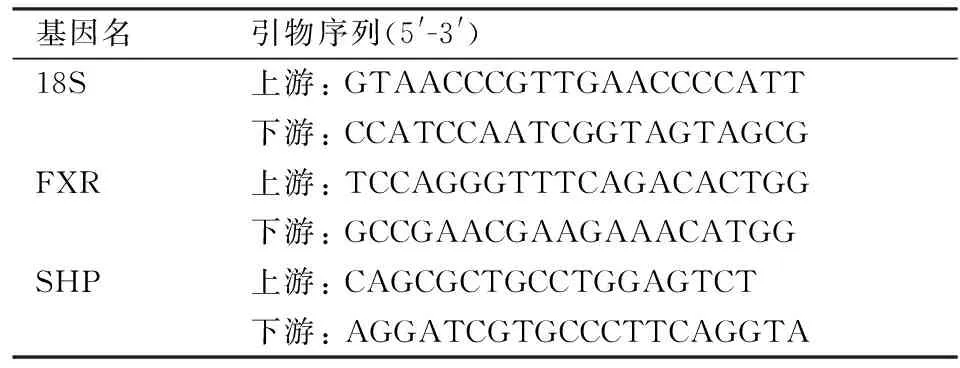
表1 基因的引物序列
1.2.6肝脏组织病理学观察 将小鼠新鲜肝脏组织放入4%多聚甲醛溶液中浸泡处理,室温放置摇床固定24 h。进行脱水包埋并切片固定后,再用苏木精-伊红(HE)染色,在显微镜下观察并拍照。

2 结果
2.1 DEHP暴露对小鼠肝脏质量及肝重指数的影响如图1所示:在实验一中,与对照组相比,DEHP低剂量组小鼠肝脏质量及肝重指数无明显变化,差异无统计学意义(P>0.05),DEHP高剂量组小鼠肝脏质量及肝重指数增加,差异有统计学意义(P<0.01)。
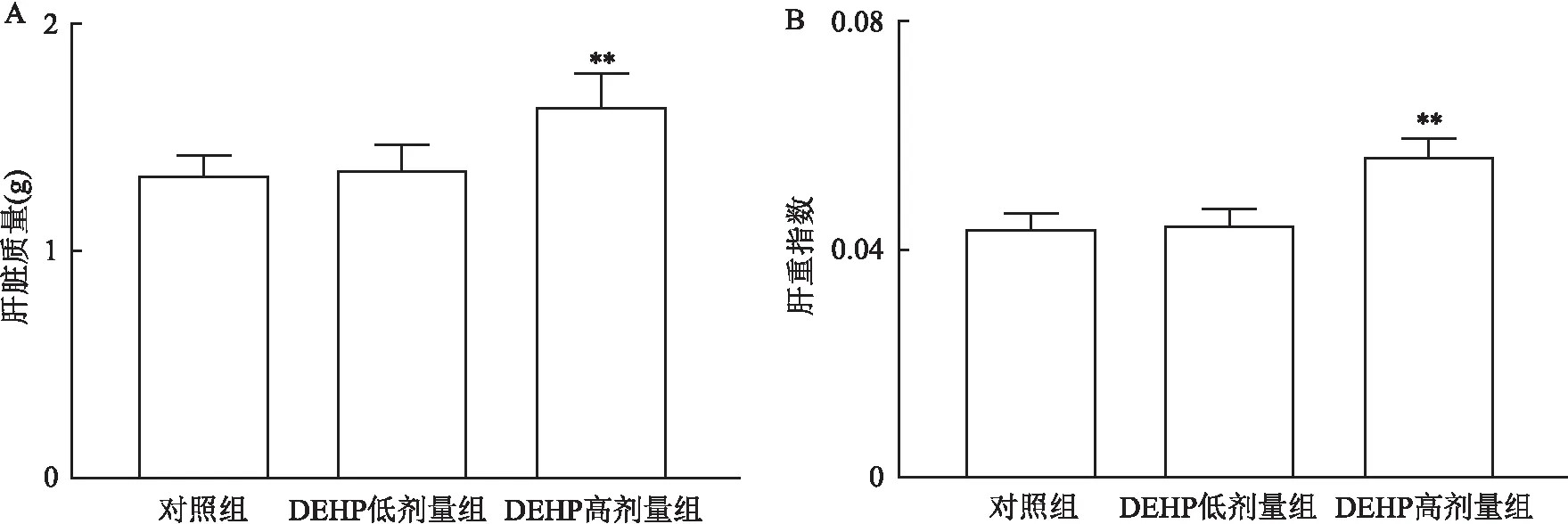
图1 各组小鼠肝脏质量及肝重指数A:肝脏质量;B:肝重指数;与对照组比较:**P<0.01
2.2 DEHP暴露对各组小鼠血清及肝脏组织生化结果的影响如表2所示:在实验一中,与对照组相比,DEHP低剂量组小鼠血清中ALT、AST、TBA和肝脏组织中TBA水平有轻微升高,但差异均无统计学意义(P>0.05);与对照组相比,DEHP高剂量组小鼠血清中ALT、AST水平也轻微增加,但差异无统计学意义(P>0.05);与对照组相比,DEHP高剂量组中小鼠血清与肝脏组织中TBA水平均显著升高,血清与肝脏组织中TBA分别升高了3倍和2倍左右,差异有统计学意义(P<0.05)。

表2 各组小鼠血清及肝脏组织生化指标
2.3 DEHP暴露对各组小鼠肝组织病理学的影响情况如图2所示:在实验一中,对照组中小鼠肝组织结构完整,DEHP低剂量组小鼠肝组织结构也无明显改变,DEHP高剂量组小鼠肝组织中可见汇管区扩大,胆管变形以及胆管增生,胆管周围并伴有少量炎性细胞浸润。

图2 各组小鼠肝脏组织病理变化 HE×400A: 对照组;B: DEHP 低剂量组;C: DEHP 高剂量组
2.4 OCA后处理对各组小鼠肝脏质量及肝重指数的影响如图3所示:在实验二中,与对照组相比,DEHP模型组小鼠肝脏质量和肝重指数增加,差异有统计学意义(P<0.01);与DEHP模型组相比,DEHP+OCA组小鼠肝脏质量和肝重指数降低,差异有统计学意义(P<0.05)。

图3 OCA后处理对各组小鼠肝脏质量及肝重指数A: 肝脏质量;B: 肝重指数;a: 对照组;b: OCA单独干预组;c: DEHP模型组;d: DEHP+OCA组;与对照组比较: **P<0.01;与DEHP模型组比较: #P<0.05
2.5 OCA后处理对各组小鼠血清及肝脏组织生化结果的影响如表3所示:在实验二中,与对照组相比,DEHP模型组小鼠血清中ALT、AST水平轻微增加,差异无统计学意义(P>0.05),但其血清和肝脏中TBA水平明显升高,血清与肝脏组织中TBA均升高了2倍多,差异有统计学意义(P<0.05,P<0.01);与DEHP模型组相比,DEHP+OCA组小鼠血清和肝脏中TBA水平降低,差异有统计学意义(P<0.05,P<0.01)。

表3 OCA处理后各组小鼠血清及肝脏组织生化指标
2.6 OCA后处理对各组小鼠肝组织病理学的影响情况如图4所示:在实验二中,对照组与OCA单独干预组小鼠肝组织结构完整,DEHP模型组小鼠肝组织中可见汇管区扩大,胆管变形以及胆管增生,胆管周围伴有少量炎性细胞浸润,DEHP+OCA组小鼠肝脏形态结构显著改善。
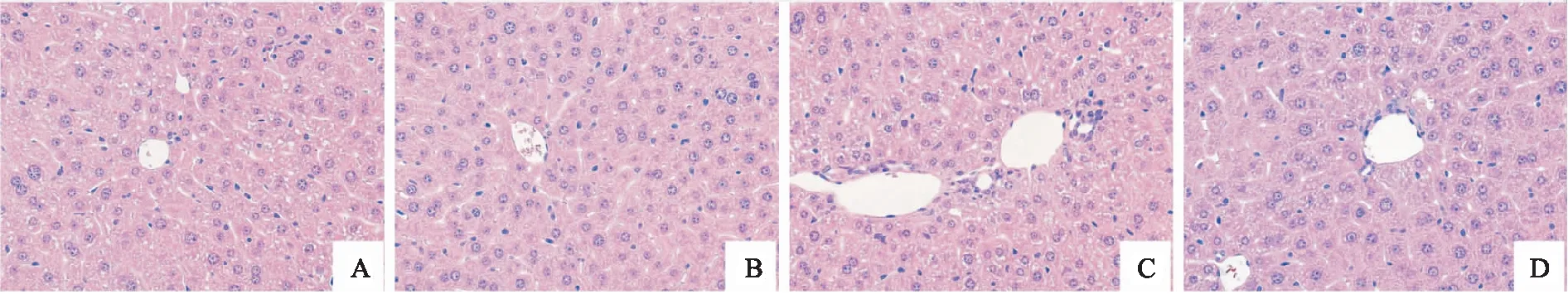
图4 各组小鼠肝脏组织病理变化 HE×400A: 对照组;B: OCA单独干预组;C: DEHP模型组;D: DEHP+OCA组
2.7 OCA缓解DEHP暴露对肝脏中FXR的抑制作用如图5所示:在实验二中,与对照组相比,DEHP[200 mg/(kg·d)]暴露后显著抑制小鼠肝脏组织FXR蛋白表达,差异有统计学意义(P<0.01);与DEHP模型组相比,DEHP+OCA组小鼠肝脏组织FXR蛋白表达水平升高,差异有统计学意义(P<0.05)。且与对照组相比,DEHP[200 mg/(kg·d)]暴露后小鼠肝脏组织中FXR及其靶基因SHP的mRNA水平均降低;与DEHP模型组相比,DEHP+OCA组小鼠肝脏组织中FXR、SHP的mRNA水平升高,差异有统计学意义(P<0.05)。

图5 OCA后处理激活FXR/SHP信号轴A:Western blot检测各组小鼠肝脏组织中FXR蛋白水平;B:FXR蛋白相对表达水平;C:各组小鼠肝脏组织中FXR mRNA水平;D:各组小鼠肝脏组织中SHP mRNA水平;a:对照组;b:OCA单独干预组;c: DEHP模型组;d: DEHP+OCA组;与对照组比较:*P<0.05,**P<0.01;与DEHP模型组比较:#P<0.05
3 讨论
胆汁淤积是一种常见的消化系统疾病,目前实验胆汁淤积动物模型的构建方法主要有药物诱导、胆管结扎手术和肠外营养法三类[8]。针对胆汁淤积模型并无特别统一的评定标准,主要依据血清生化结果和组织形态学检查来判断是否发生胆汁淤积,而血清胆汁酸浓度升高是诊断的必要条件之一,其中TBA>10 μmol/L可作为胆汁淤积的诊断标准[9]。
DEHP可通过多种暴露途径进入人体中,包括口、静脉输液、皮肤吸收等。DEHP经口摄入主要是通过食物进入人体,其皮肤吸收来自化妆品等个人护理产品。在一些特殊工作人群中,如塑料厂工人和油漆工人等以及大量使用化妆品的女性朋友中,DEHP 的暴露剂量已经远远超出了国家规定的安全剂量。DEHP作为一种环境内分泌干扰物长期暴露会影响人体内分泌系统、生殖系统、神经发育、哮喘、自闭症以及肝、肺、甲状腺和肾脏等多个器官的毒性[10-11]。在体内积累大量DEHP及其代谢产物时,肝脏是最大的解毒器官[12]。因此,建立DEHP诱导胆汁淤积动物模型对于深入研究环境因素与胆汁淤积性肝病之间的关系具有重要意义。本研究选择DEHP暴露于雌性ICR小鼠,发现DEHP暴露后导致小鼠胆汁淤积的发生。该研究中首先选择了DEHP 50、200 mg/(kg·d)两种暴露剂量[13],结果发现DEHP 暴露剂量为200 mg/(kg·d)时,小鼠肝脏质量及肝重指数均升高,以及血清与肝脏组织胆汁酸均显著升高,其中血清TBA水平相比于对照组升高了3倍左右,结合病理结果,提示DEHP[200 mg/(kg·d)]暴露后导致小鼠胆汁淤积的发生,表明造模成功。
目前OCA主要作为针对单用UDCA效果不佳或不耐受的成年原发性胆汁性肝硬化(primary biliary cirrhosis, PBC)的患者,有临床研究[14]表明OCA可改善PBC患者的胆汁酸排泄。本研究中再给予OCA处理后,发现DEHP+OCA组小鼠的肝脏质量、肝重指数、血清与肝脏组织中的TBA水平均显著降低,包括其肝脏组织病理结果均明显好转,表明OCA后处理对DEHP[200 mg/(kg·d)]暴露诱导的胆汁淤积有显著的保护作用。而FXR是机体胆汁酸代谢调控中的关键调节剂,FXR及其靶基因SHP在胆汁酸的合成、分解以及转运过程中均起到关键的调节作用,FXR在这些过程中的调节缺陷可能会导致胆汁淤积和随后的病理变化[15]。本研究结果显示DEHP[200 mg/(kg·d)]处理后小鼠肝脏组织中FXR蛋白及其mRNA的表达均降低,且OCA处理后FXR的蛋白表达水平和FXR及其靶基因SHP的mRNA表达量均明显升高,表明DEHP[200 mg/(kg·d)]暴露后导致胆汁淤积的发生可能与抑制FXR表达有关,而OCA的后处理可通过激活FXR及其靶基因SHP的表达,从而调控胆汁酸的代谢,对DEHP诱导的胆汁淤积起到保护作用。
本研究在动物模型中发现了DEHP暴露后导致小鼠胆汁淤积的发生,且OCA后处理对DEHP暴露导致胆汁淤积起到治疗作用。此研究有助于对日常生活中塑化剂的使用做好预防工作以及针对胆汁淤积的治疗提供新的思路,但DEHP暴露后导致鼠胆汁淤积具体机制还需进一步探讨。
