干旱胁迫对东北红豆杉野生种与栽培种生理与次生代谢的影响
2022-11-02王丹丹李晓红张彦文刘丹梅
王丹丹,李晓红,张彦文,刘丹梅
(辽东学院 农学院,辽宁丹东 118000)
东北红豆杉(Taxus cuspidataSieb.et Zucc.)又名紫杉、赤柏松,隶属于红豆杉科(Taxaceae)红豆杉属(Taxus)植物,属于国家Ⅰ级珍稀保护植物,耐寒能力极强,喜荫、冷湿肥沃排水性好的环境,林下乔木或灌木,为第三纪孑遗植物,被称为 植物“活化石”。雌雄异株,风媒授粉;原产于中国东北长白山脉、朝鲜半岛、日本等地。但由于东北红豆杉是东北地区唯一的极小种群,生境狭小且分布地不连接,种群竞争力差;其树皮、枝叶含抗癌物质紫杉醇,对治疗乳腺癌、皮肤癌、卵巢癌和肺癌具有特殊的疗效,木材可加工高质量家具或工艺品,实生苗木具有较高的观赏价值,因而导致野生红豆杉资源被过度砍伐而生境恶化,种群萎缩、遗传多样性降低,现已处于濒危状态[1]。因此,加大东北红豆杉人工驯化栽培种的研究具有十分重要的意义。
干旱抑制植物生长发育,如抑制细胞有丝分裂,降低细胞膨压,减弱细胞伸长及扩张能力,导致植株生长速度慢、植株矮细小、抽芽量少、叶面积减小、叶片枯黄皱缩以及根系发育不良等。可见,干旱胁迫造成植物不可逆的生理损伤[2]。根系是吸收水分的主要器官,干旱胁迫下,根系首先接收干旱信号,通过根系肉质化、变厚根皮、加强侧根数量及向下深扎程度及提高根冠比来广泛吸收土壤深层水分等方式响应干旱胁迫,之后信号传递到其他器官。此外,干旱胁迫会影响植物的渗透调节、营养代谢、呼吸作用与光合作用等,尤其是叶片形态特征及生理特性,如细胞壁变厚、叶片皱缩变小、气孔下陷以及栅栏组织与海绵组织比值降低等;生殖阶段干旱胁迫影响种子数量、大小和组成,而且花数、结荚率、结实率等指标均显著下降[3]。此外,植物体内很多基因直接参与对干旱胁迫的抵御,通过该类基因的表达或调控来减缓胁迫伤害,进而维持植物的正常生理代谢,主要包括ABRE结合蛋白/ABRE结合因子(AREB/ABFs)、脱水反应元件结合蛋白(DREB)、AP2转录因子、WRKY转录因子、N-乙酰-L-半胱氨酸(NAC)和碱性亮氨酸拉链(bZIP);信号转导相关蛋白,如钙依赖性蛋白激酶(CDPKs);抗氧化酶,如超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX))、抗坏血酸-谷胱甘肽(As A-GSH)循环系统中的酶,如还原型谷胱甘肽酶(GSH)、抗坏血酸酶(As A)、谷胱甘肽还原酶(GR)等;主要影响能量代谢过程中一些关键酶,如葡萄糖激酶(Glucokinase,GCK)、磷酸果糖激酶(Phosphofructokinase,PFK)、细胞色素c(Cytochrome c,Cyt c)、丙酮酸激酶(Pyruvate kinase,PK)、乳酸脱氢酶(Lactate dehydrogenase,LDH)与柠檬酸合酶(Citroyl synthetase,CS)等[4]均在干旱胁迫中发挥至关重要的作用。
由于东北红豆杉生长缓慢,种子单生且发芽率极低,繁殖周期长(种子发芽需2 a,人工根插繁育需2~3个月,第一年生长较慢),而二萜类物质紫杉醇等的需求量日益增加,严重地制约着东北红豆杉的工业化生产,所以从野生东北红豆杉培育栽培种是必然趋势。目前,对东北红豆杉的研究主要集中于紫杉醇生物合成途径及其栽培技术,而对东北红豆杉抗旱代谢物的动态变化研究较少,如氨基酸类、糖类化合物等,且对其干旱机制及抗旱代谢物与相关基因的研究相对薄弱[5]。此外,干旱胁迫对东北红豆杉生长发育的影响远远超出其他胁迫,并在发育完成后继续影响其营养运输、吸收、光合作用与呼吸作用等生理代谢过程;从野生东北红豆杉培育栽培种显著提高了植株性状,但对逆境胁迫下,野生种与栽培种的抗逆性及次生代谢物差异的研究尚未见报道。综上所述,本研究则对干旱胁迫下东北红豆杉野生种与栽培品种的植株生理指标(叶片相对含水量、可溶性糖、可溶性蛋白、叶绿素、类胡萝卜素以及光合参数)、体内次生代谢物含量(LDH、GCK、Cyt c、精氨酸、鸟氨酸转氨酶、脯氨酸,丙二醛、天冬氨酸)以及紫杉烷-C13-侧链-N-苯甲酰转移酶(Tc-DBTNBT),转录因子AP2,脱水反应元件结合蛋白(DREB)以及光合作用光系统Ⅰ亚基X蛋白(Psa K)的表达量差异进行分析,为深入开展野生东北红豆杉种质资源的保护及栽培种的培育与开发利用提供理论依据。
1 材料与方法
1.1 试验材料
选取10 a生健康无病且生长势一致的野生东北红豆杉与栽培种‘丹紫1号’(品种权号:20210592)为试验材料(材料取自丹东科技生态园),采用盆栽控水法,将红豆杉裸株栽培于直径60 cm×60 cm(直径×高)盆钵中,土壤为沙熟土∶腐叶土∶菌根菌生物有机肥∶粗砂∶泥炭=1∶1∶1∶1∶1,一钵一株红豆杉,生境和栽培管理措施一致,置于露地养护。干旱处理前将植株浇透水,后将野生种与栽培种分为两组,分别在处理后的第0、8、16、24、32、40、48天采集红豆杉中下部外围针叶检测生理指标、次生代谢物及基因表达分析[6],各组每个时间段采用2盆红豆杉植株为1次重复,每个试验均做3次生物学重复。
1.2 方法
1.2.1 生理指标检测 采用烘干称重法测定红豆杉叶片相对含水量[7]。可溶性糖和可溶性蛋白检测分别采用可溶性糖试剂盒与可溶性蛋白试剂盒(生工生物工程(上海)股份有限公司,中国);每天9:00采用便携式光合荧光测量系统(LI-6800,LI-COR公司,美国)内置光源[光照强度1 500 μmol/(m2·s)]对红豆杉中下部外围针叶(每个处理采用相同部位叶片)测定光合速率(Pn),蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)值[8],每个处理重复3次取平均值。
1.2.2 次生代谢产物检测 采用ELISA试剂盒(生工生物工程(上海)股份有限公司上海,中国)说明书操作并检测干旱胁迫下东北红豆杉野生种与栽培种相关酶(LDH、GCK和Cyt c)的酶活性以及精氨酸(Arg)含量[9];采用GSH检测试剂盒和As A检测试剂盒(北京索莱宝科技有限公司,中国)测定As A-GSH循环系统酶活性[10]。
采用叶绿素试剂盒和胡萝卜素试剂盒测定色素含量(合肥莱尔生物科技有限公司,中国);采用磺基水杨酸法提取、测定红豆杉针叶脯氨酸(Pro)的含量;采用硫代巴比妥酸(TAB)法提取、测定红豆杉针叶丙二醛(MDA)含量[11];采用鸟氨酸转氨酶试剂盒(江苏连云港生物科技有限责任公司)提取鸟氨酸转氨酶的含量;采用富马酸法提取、测定天冬氨酸(Asp)的含量[12]。
1.2.3 东北红豆杉野生种Tc DBTNBT基因RACE克隆 以曼地亚红豆杉(Taxus×media)DBTNBT基因序列(GenBank:AY563629.1)设计引物(表1)。按RNA提取试剂盒(EZ-10 Total RNA Mini-Preps Kit)说明书提取总RNA,以总RNA为模板,按AMV第一链c DNA合成试剂盒(AMV First Strand cDNA Synthesis Kit)合成红豆杉cDNA第一链,-20℃保存,用于克隆DBTNBT核心序列,反应体系20μL,包含0.8 μL cDNA,1μL d NTP Mix,0.6μL 10μmol/L上下游引物,(10×)AdvantagePCR缓冲液2.0μL,(50×)Advantage聚合酶混合液0.5 μL,加dd H2O至20μL;反应程序:95℃预变性4 min;94℃变性45 s,55~58℃退火50 s,72℃延伸60 s,30个循环;72℃延伸10 min;回收PCR产物,将筛选的阳性克隆送至生工生物工程(上海)公司测序[13]。采用RACE试剂盒(SMARTer RACE cDNA Amlification Kit试剂盒)快速扩增、拼接Tc DBTNBT基因,测序验证[14]。共克隆6个东北红豆杉干旱胁迫相关基因,以Tc-DBTNBT克隆为例。
1.2.4 表达分析 选择东北红豆杉干旱应答元件结合蛋白DREB与光合作用光系统Ⅰ亚基X蛋白(Psa K),以及紫杉醇生物合成相转录因子AP2和关键酶Tc DBTNBT进行实时荧光定量PCR(qRT-PCR),检测上述蛋白于干旱胁迫下的表达情况(引物见表1)。qRT-PCR反应体系(25 μL),SYBR Premix ExTaqⅡ(2×)5.0μL,10 μmol/L上下游引物各1.5μL,ROX参比染料(50×)0.8μL,cDNA模板2.0μL,加dd H2O至25μL;反应程序:95℃预变性2 min;95℃变性50 s,56~60℃退火45 s,72℃延伸50 s,40个循环;每个样品3次生物学重复取平均值,采用2-△△Ct法进行上述蛋白表达水平的分析计算[15]。

表1 引物信息Table 1 Information of primers
1.2.5 数据统计与分析 采用Excel 2016和DPS 7.05软件进行试验数据与差异显著性分析,采用SPASS 21.0与SAS/STAT进行方差分析,采用Duncan氏多重极差检验(P<0.05)。所有试验均采用完全随机设计,生物学重复3次,取平均值。
2 结果与分析
2.1 干旱胁迫对东北红豆杉野生种与栽培种叶片相对含水量的影响
叶片是对干旱胁迫应答最敏感的器官之一(图1),干旱胁迫下,红豆杉叶片相对含水量由干旱胁迫开始逐渐呈下降趋势,其中野生东北红豆杉叶片相对含水量始终低于栽培种,在干旱胁迫的第24天~40天,下降趋势显著,至第48天时,野生种叶片相对含水量不足20%,而栽培种叶片相对含水量为30%,是野生种的1.58倍。

图1 干旱胁迫下东北红豆杉野生种与栽培种叶片相对含水量Fig.1 Relative water content in leaves of wild and cultivated species of Taxus cuspidata under drought stress
2.2 干旱胁迫对东北红豆杉野生种与栽培种叶片可溶性糖和可溶性蛋白含量的影响
可溶性糖与可溶性蛋白属于渗透调节物质,在持续干旱胁迫下,红豆杉可通过提高二者含量来调控自身含水量,达到维持植株正常生长发育的目的。干旱胁迫促使东北红豆杉野生种与栽培种叶片可溶性糖含量增加,曲线趋势基本一致(图2-A),红豆杉栽培种可溶性糖含量显著高于野生种,干旱胁迫初期二者差异不显著,第24天栽培种可溶性糖含量显著增加,至第32天栽培种叶片可溶性糖含量已为野生种的1.28倍。干旱胁迫下,东北红豆杉野生种与栽培种叶片可溶性蛋白含量在干旱胁迫初期呈现明显的上升趋势,而后逐渐下降(图2-B),干旱处理前及胁迫初期野生种可溶性蛋白含量明显高于栽培种,随着胁迫时间的延长(第16天),野生种可溶性蛋白的含量显著低于栽培种,干旱胁迫第32天时,栽培种可溶性蛋白含量上升达峰值且为野生种的1.41倍,而后呈显著下降趋势,至第48天时,野生种下降至栽培种的75%,但二者始终高于干旱胁迫前。

图2 干旱胁迫下东北红豆杉野生种与栽培种叶片可溶性糖(A)和可溶性蛋白(B)含量Fig.2 Soluble sugar(A)and soluble protein(B)content in leaves of wild and cultivated species of Taxus cuspidata under drought stress
2.3 干旱胁迫对东北红豆杉野生种与栽培种叶片光合参数的影响
与干旱胁迫前相比,持续干旱胁迫抑制红豆杉叶片的净光合速率(Pn)、蒸腾速率(Tr)和气孔导度(Gs)3个光合参数,均呈下降趋势(图3)。干旱胁迫下,东北红豆杉野生种叶片Pn、Tr和Gs均显著高于栽培种,曲线基本一致,其中野生种Pn值在叶片光和参数中显著高于栽培种且差值最大,干旱胁迫前约为栽培种的1.41倍,至第48天时已为栽培种的1.69倍,而栽培种Gs在干旱胁迫初期显著高于野生种,但在第24天后则低于野生种,至第48天时约为野生种的44.1%;而细胞间隙CO2浓度(Ci)变化趋势则与上述3项指标差异较大,呈显著上升趋势,干旱胁迫初期野生种Ci值略低于栽培种,持续干旱胁迫至第24天后逐渐上升且显著高于栽培种,第48天指标约为栽培种的1.32倍。
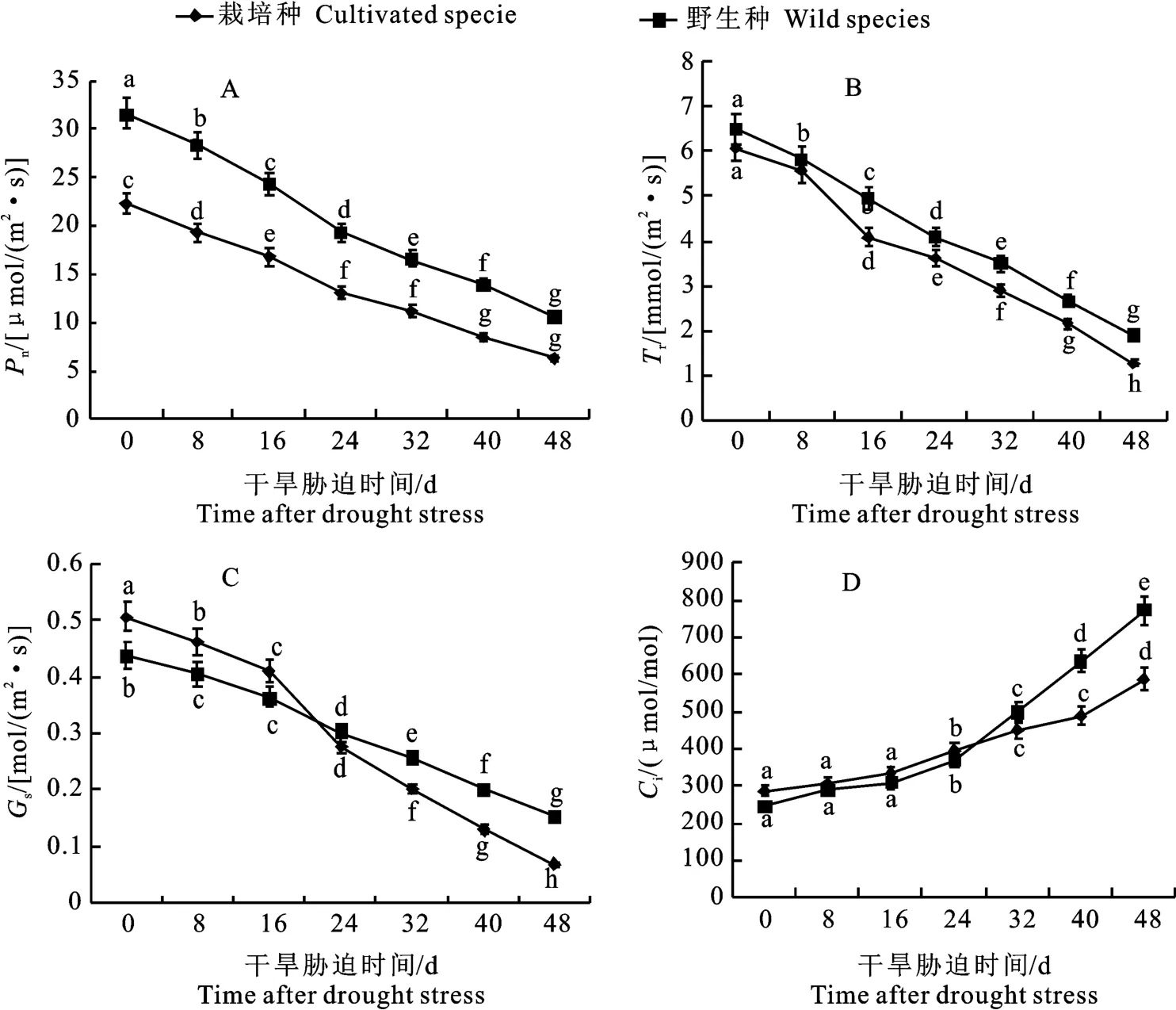
图3 干旱胁迫下东北红豆杉野生种与栽培种叶片光合特性Fig.3 Leaves photosynthetic characteristics of wild and cultivated species of Taxus cuspidata under drought stress
2.4 干旱胁迫对东北红豆杉野生种与栽培种叶片色素含量的影响
干旱胁迫对植物光合作用影响较大,由于干旱胁迫促使植物进行光合作用时叶片的气孔导度(Gs)下降,CO2进入叶片受阻,致使光合效率降低,加之叶绿体中类囊体膜及其超微结构均受损伤,最终导致红豆杉光合色素的合成发生变化。如图4-A所示,干旱胁迫下,红豆杉野生种与栽培种叶片的叶绿素含量下降且显著高于栽培种,至第48天时约为栽培种的2.23倍;而类胡萝卜素含量上调(图4-B),干旱胁迫初期野生种类胡萝卜素的含量高于栽培种,第8天后栽培种含量急剧升高且显著高于野生种,至第48天时约为野生种的1.44倍。

图4 干旱胁迫下红豆杉野生种与栽培种叶片色素含量Fig.4 Leaves pigment of wild and cultivated species of Taxus cuspidata under drought stress
2.5 干旱胁迫对东北红豆杉野生种与栽培种次生代谢物的影响
脯氨酸(Pro)为渗透调节物质,在植物抵御干旱胁迫过程中发挥重要作用,与植物代谢以及水分吸收密切相关;丙二醛(MDA)是植物在逆境条件下膜脂过氧化的重要产物之一,能够反映细胞膜的过氧化程度与植物抗逆能力,干旱胁迫下Pro和MDA在红豆杉体内会大量积累呈稳定上升趋势,且野生种显著低于栽培种。干旱胁迫前,野生种Pro含量略高于栽培种(图5-A),随着持续干旱胁迫,野生种Pro含量显著低于栽培种,约为栽培种的1.1倍;而干旱胁迫初期,野生种MDA含量与栽培种基本一致(图5-B),至第24天时急剧上升,至第48天时约为栽培种的1.36倍;谷胱甘肽(GSH)在干旱胁迫下呈先上升后下降趋势(图5-C),但下降趋势较为平缓,栽培种在第32天达到峰值,约为野生种的1.15倍,而后呈下降趋势,至第48天时约为野生种的1.14倍,野生种在第40天达到峰值,约为栽培种的91.6%,后呈下降趋势;而干旱胁迫下,类黄酮的含量均有不同程度的升高(图5-D),且栽培种显著高于野生种,干旱胁迫初期野生种类黄酮含量略高于栽培种,至第48天时,栽培种其含量约为野生种的1.05倍。
干旱胁迫下野生东北红豆杉与栽培种相关酶(LDH、GCK和Cyt c)的酶活性均呈显著上调趋势(图5-E,5-F,5-G),野生种的3种酶活性均始终高于栽培种,如LDH酶活性在干旱胁迫初期,野生种与栽培种无明显差异,但在第24天后野生种LDH酶活性急剧上升为栽培种的1.24倍,至第48天时约为栽培种的1.37倍。东北红豆杉野生种与栽培种的精氨酸和鸟氨酸转氨酶含量随干旱胁迫时间的延长均呈上升趋势(图5-H,5-I),干旱胁迫初期,野生种与栽培种二者含量基本一致,但第16天左右,栽培种的精氨酸和鸟氨酸转氨酶含量急剧上升,分别为野生种的1.05倍和1.19倍,而栽培种的天冬氨酸含量在第16天~40天时急剧上升且显著高于野生种(图5-J),在第24天达到峰值,约为野生种的1.07倍,而后逐渐下降,至第48天时,约为野生种的97.28%。

图5 干旱胁迫下红豆杉野生种与栽培种次生代谢物的含量Fig.5 Secondary metabolites content in wild and cultivated species of Taxus cuspidata under drought stress
2.6 干旱胁迫对东北红豆杉野生种与栽培种相关蛋白表达的影响
植物抗旱性是多信号转导途径以及多基因偶联控制的复杂应答反应,在分子水平上探究红豆杉抗旱相关基因的表达调控模式,可更加明确东北红豆杉野生种与栽培种的抗旱机制以及野生种与栽培种的差异,分析二者干旱应答、光合响应蛋白以及紫杉醇生物合成相关基因表达水平的变化(图6),野生种与栽培种的干旱应答元件结合蛋白DREB表达量升高(图6-A),曲线基本一致,野生种干旱胁迫初期DREB表达量略高于栽培种,第8天后显著低于栽培种,栽培种DREB表达量于第40天达到峰值,约为野生种的1.28倍;紫杉醇生物合成途径中转录因子AP2与关键酶TcDBTNBT的表达量随干旱胁迫时间而呈显著下降趋势,二者曲线基本一致,其中野生种AP2基因与Tc DBTNBT基因表达量始终高于栽培种;干旱胁迫后,Psa K表达水平上调,干旱胁迫初期野生种与栽培种Psa K的表达量差异不大,干旱胁迫第8天后野生种光合基因的表达水平较栽培种呈显著上调趋势,在第24天时野生种的表达量急剧升高,约为栽培种的1.57倍,这与之前光和参数变化基本一致。
3 讨论
东北红豆杉是耐旱能力较强的植物,干旱胁迫下其形态与组织结构、干旱相关基因的表达等均有不同程度改变[16]。本研究表明,东北红豆杉栽培种的大部分次级代谢产物含量高于野生种,如干旱胁迫下东北红豆杉叶片含水量降低,其野生种叶片相对含水量始终低于栽培种。此外,干旱胁迫虽能引起东北红豆杉形态结构、生理指标和代谢产物的改变,但东北红豆杉本身为预防、降低或自我修复应答干旱带来的损伤也会发生生理代谢的连锁反应,以维持正常的生理状态,并且东北红豆杉野生种与栽培种之间存在显著差异,其中作为渗透调节物质的可溶性糖与可溶性蛋白含量受干旱胁迫的影响较大,野生种与栽培种可溶性糖含量持续增加且曲线基本一致,干旱胁迫初期二者差异不明显,第16天后栽培种显著高于野生种,增强了红豆杉栽培种的渗透调节作用,可消除或修复栽培种因干旱引起的应激损伤,这与干旱胁迫下金露梅等植物可溶性糖积累趋势一致[17]。而东北红豆杉叶片可溶性蛋白含量呈先升高后降低的趋势,野生种可溶性蛋白的含量显著低于栽培种,可能由于可溶性蛋白多为生物代谢的酶类,干旱胁迫初期,由于东北红豆杉产生应激反应而使体内代谢酶的含量增加、酶活性提高,致使东北红豆杉叶片可溶性蛋白含量增加,后期由于持续干旱胁迫抑制了红豆杉体内相关蛋白质的合成,加之酶快速降解等因素导致红豆杉可溶性蛋白含量先增加后降低;细胞内渗透物质增加是引起渗透势下降的关键因素之一,体内积累渗透调节物质以维持细胞含水量和膨压势,保证细胞生长、气孔开放和光合等生理过程的进行,除可溶性糖与可溶性蛋白外,Pro亦为东北红豆杉细胞质的主要渗透物质,Pro亲水性极强,干旱胁迫下其含量显著增加,可稳定原生质及细胞内的代谢过程,干旱胁迫下蛋白质合成减慢,导致Pro参与蛋白质合成量减少,Pro积累急剧升高,保持胞质内溶胶与环境的渗透平衡,防止细胞失水,增强蛋白质的可溶性以及降低可溶性蛋白的沉淀,保护这些生物大分子结构和功能的稳定。此外,干旱胁迫产生的氨亦可形成Pro,起到解毒作用[18];而MDA具有很强的毒性,是膜脂过氧化物作用的主要产物之一,是膜系统受伤害的重要标志,干旱胁迫下它能与膜上的氨基酸残基或核酸反应生成shiff碱,增加膜透性,干旱胁迫下MDA在东北红豆杉体内会大量积累呈稳定上升趋势,且野生种MDA含量明显低于栽培种。为防止ROS积累造成的细胞损害,植物进化出保护酶系统As A-GSH酶循环系统等抗氧化防御系统,通过增加酶活性来清除体内积累的ROS,干旱胁迫下,GSH呈先上升后下降趋势,但下降趋势较为平缓,栽培种在第32天达到峰值约为野生种1.15倍,而后呈下降趋势,这可能是由于干旱初期GSH可以正常合成,但持续干旱破坏了GSH合成酶的结构,造成GSH生物合成量降低,这与Wada等[19]的研究结果一致。此外,糖代谢也是植物代谢的重要途径之一,糖代谢与植物对逆环境下的抗逆性应答以及植物体生长有关,干旱胁迫下东北红豆杉野生种与栽培种LDH、GCK和Cyt c的酶活性均呈显著上调趋势,且野生种始终高于栽培种,说明能量代谢方面野生东北红豆杉显著优于栽培种,这可能与野生东北红豆杉所处东北地区的地理环境以及气温急剧变化有关;氨基酸为植物体内主要抗逆物质之一,干旱胁迫下大部分糖类和氨基酸显著增加,说明东北红豆杉通过糖类、氨基酸的显著增加来抵御干旱胁迫,其中戊糖磷酸途径是植物体内干旱应答重要的葡萄糖代谢途径之一[20]。精氨酸和天冬氨酸代谢可以减轻干旱胁迫对东北红豆杉的损伤,具有维护东北红豆杉稳态的作用,说明东北红豆杉通过精氨酸和天冬氨酸代谢通路调控干旱胁迫对红豆杉的有害影响,增加东北红豆杉对干旱胁迫的抵抗性和适应性。本试验精氨酸和天冬氨酸的含量在胁迫初期时明显高于栽培种,但随着干旱胁迫时间的延长,第16天~40天内,栽培种应激反应产生的精氨酸和鸟氨酸转氨酶含量显著高于野生种,抗旱基因DREB表达量与之结果一致,可见,从应激代谢方面分析,东北红豆杉栽培种对干旱胁迫的适应性和抵抗性更强。
植物光合参数会由于干旱胁迫生物量分配的变化而变化,如干旱胁迫初期,红豆杉叶片Pn、Tr、Gs整体变化趋势一致,而持续干旱胁迫导致Pn、Tr、和Gs均呈下降趋势,且野生种均高于栽培种,可见红豆杉叶片Gs降低,偶联Pn和Tr均降低来抵御干旱胁迫;细胞间隙CO2浓度(Ci)变化趋势与上述3项指标差异显著,均呈显著上升趋势,干旱胁迫初期野生种Ci值略低于栽培种,第24天后逐渐上升且显著高于栽培种,第48天指标约为栽培种的1.32倍,其原因可能是干旱胁迫初期,气孔开度降低但仍可消耗CO2进行光合作用,但持续胁迫致使气孔关闭,光合作用停止,红豆杉叶片中CO2含量则剧烈积累增加,这与竹柳Ci变化趋势一致[21]。干旱胁迫下红豆杉叶片光合作用相关的蛋白Psa K表达量显著上升且野生种明显高于栽培种,表明干旱胁迫损伤了红豆杉叶片叶绿体,减弱了光合作用,但野生种抵御胁迫的能力强于栽培种,这与之前光和参数的结果相一致,从光合参数分析可见,栽培种抵御干旱胁迫的能力不及野生东北红豆杉。植株通过提高光合作用相关基因的表达水平以维持正常生长发育,光合色素含量亦可直接影响红豆杉的光合能力[22-23],干旱胁迫下由于活性氧(ROS)代谢失衡,叶绿素分解加速导致叶绿素含量呈线性下降,野生种始终高于栽培种,而红豆杉叶片类胡萝卜素和类黄酮含量增加,栽培种二者含量显著高于野生种,如干旱胁迫初期野生种类胡萝卜素的含量高于栽培种,第8天后栽培种含量急剧升高且显著高于野生种,至第48天时约为野生种的1.44倍,类胡萝卜素可降低干旱胁迫叶绿素的伤害,增加红豆杉叶片的抗性;紫杉醇生物合成途径中相关转录因子AP2与关键酶Tc DBTNBT的表达量随干旱胁迫时间而呈显著下降趋势,其中野生种表达量始终高于栽培种,说明干旱胁迫降低了红豆杉紫杉醇的生物合成量,但野生种紫杉醇的合成量高于栽培种。
综上所述,干旱胁迫对东北红豆杉野生种与栽培种植株的表型特征、生理特性、光合特性、次级代谢物以及相关基因的表达水平等影响较为显著,且干旱胁迫程度不同,东北红豆杉野生种与栽培种植株抗旱响应度亦存在较大差异,如栽培种干旱胁迫应答的次级代谢产物如类黄酮等含量显著高于野生种。东北红豆杉栽培种在干旱应答中大部分氨基酸和有机酸的积累比例高于野生种,栽培种拥有更多抗氧化性物质和缓解逆境胁迫的调节物质,可以更快的缓解和消除逆境胁迫所带来的伤害和影响,更好地保护植物组织和细胞,所以,栽培种对胁迫逆境下具有更强抗性和适应性;而从能量代谢、光合参数以及紫杉醇合成量方面分析,东北红豆杉野生种显著优于栽培种,可通过野生种与栽培种的种间杂交将野生种的优势转育到栽培种,以丰富和改善现有栽培种的遗传特性或创造新的优异种质材料供育种利用,尤其是培育紫杉醇含量较高的栽培种,以减少对野生东北红豆杉的过度砍伐,此外,东北红豆杉野生种亟需更多的保护,为进一步研究东北红豆杉的抗逆性及保护野生东北红豆杉奠定基础。
