氮添加对青藏高原高寒沼泽草甸土壤细菌群落的影响
2022-11-02曾红丽房佳辰商光烈
曾红丽,白 炜,房佳辰,徐 磊,商光烈
(兰州交通大学 环境与市政工程学院,兰州 730070)
由于工业生产、畜牧业发展及氮肥施用等,大气氮沉降量大幅提高[1]。在过去的100多年间(1860—1995),全球氮沉降量增加近3倍,预计到2050年将达到2×1011kg·a-1[2]。中国2010年氮沉降量高达21.1 kg·hm-2·a-1[3],是全球高氮沉降区域之一。大气氮沉降水平的持续升高引发了诸多生态环境问题,如土壤酸化[4]、改变土壤原有的氮磷平衡[5]、降低生物多样性和凋落物分解[6]等,驱动了生态系统结构和功能的改变。草地是中国面积最大的陆地生态系统[7],具有碳氮循环、水土保持和气候调节等生态服务功能[8-9],且大部分位于生态脆弱带上。在草地生态系统中,土壤养分相对贫乏,氮是主要的限制因素,即使是较低水平的长期氮沉降,也可能对该生态系统带来负面影响[10],进而影响到土壤微生物特征及土壤氮转化,在对全球变化敏感的高寒地区更是如此。因此,有关氮沉降对高寒草地土壤微生物的影响引发了研究者的广泛关注,逐渐成为生态学领域的研究热点。
土壤微生物是土壤系统中的重要组成部分,在凋落物分解和氮素转化中起着极其重要的作用[11]。氮沉降增加会引起土壤p H、氮有效性、C/N和根系生物量等发生改变[12-13],进一步影响土壤微生物数量、群落组成和土壤呼吸[14]。王长庭等[15]对海北高寒沼泽化草甸的氮添加处理发现,氮添加对细菌丰富度的影响存在土层梯度效应,氮添加增加了0~10 cm土层土壤细菌PLFAs丰富度,在10~20 cm土层表现为降低。杨越[16]通过对海北高寒草地生态系统的氮添加研究发现,氮添加没有明显改变土壤微生物群落结构。徐润宏等[17]发现,在青藏高原高寒湿地进行氮添加试验,显著改变了细菌和真菌的相对丰度。氮添加对土壤微生物的影响由于受众多因子的影响,不同研究之间氮添加时间、土壤水热条件、海拔梯度以及植被类型等因素存在差异,并且生态系统功能和过程对氮沉降增加通常呈现非线性变化[18],使得研究结果存在很大的不确定性。
青藏高原是世界上中低纬度地区海拔最高、面积最大的多年冻土分布区[19],该地区草地面积约为1.65×106km2[20],是研究高寒草地生态系统格局与过程的天然实验室。高寒沼泽草甸作为高寒生态系统主要的草地类型之一,对氮添加极其敏感[21]。土壤细菌作为土壤环境中大量存在的微生物,对氮沉降的响应更加明显[22]。因此,本研究以青藏高原高寒沼泽草甸为研究对象,以外源氮素添加的方式模拟自然氮沉降,运用高通量测序技术,分析不同土壤深度(0~10 cm、10~20 cm、20~30 cm)细菌群落结构及多样性对氮添加的响应特征,并通过相关性分析阐明土壤理化指标对细菌群落的调控作用,以期为氮沉降增加背景下的土壤养分循环和高寒生态区保护提供理论依据。
1 材料与方法
1.1 研究区概况
研究区位于青藏高原风火山地区,海拔4 610~5 323 m,属于北麓河流域,年均气温为-5.3℃,年平均地温为-1.5~4.0℃。地下埋藏着50~120 m多年冻土,冻土活动层为0.8~2.5 m[23]。年均降水量为269.7 mm,年均蒸发量1 477.9 mm。高寒沼泽草甸是该地区典型的草地类型之一,主要分布于山间盆地、蝶形洼地和平缓滩地等处。5月至9月为植被生长季,优势物种为藏嵩草(Kobresia tibetica),伴生种有青藏苔草(Carex atrofusca)和矮火绒草(Leontopodium nanum)等[24]。草群覆盖度达85%以上[25]。
1.2 试验设计
2015年5月在风火山高寒沼泽草甸围栏样地 内(34°43′57.5″N,92°53′22.5″E,海 拔4 759 m)设置氮添加试验小区,采用完全随机区组设计,共设置3个氮添加水平:对照(CK,0 g·m-2·a-1)、低氮(N1,5 g·m-2·a-1)和高氮(N2,10 g·m-2·a-1)。每个处理3个重复,共计9个1 m×1 m的小区,小区间设2 m作为缓冲带。以NH4NO3(分析纯)为氮源,每年的氮添加量平均分为4次施入,分别于每年的6月至9月(每月1次)添加。每次施氮时按照不同施氮水平,称取相应量的NH4NO3,溶解于200 m L水中,用喷雾器均匀喷洒,在CK喷洒相同体积的水。
1.3 研究方法
1.3.1 土壤样品 采集于2019年9月采集土壤样品。每个小区取5个点作为重复,除去地表凋落物后,使用灭菌后的不锈钢土钻采集0~10 cm、10~20 cm和20~30 cm土层的土样,同一土层5个点的土样混合,组成1个混合土样。去除石块、植物根系等杂物后,各土样均分为3份:一份自然风干后用来测定土壤理化性质;一份鲜样在4℃的条件下储存,用于土壤微生物量碳、氮测定;一份鲜样于-80℃的条件下储存,用于细菌测序分析。
样品以氮添加水平为前缀,土层为后缀进行标记(0~10 cm用a表示,10~20 cm用b表示,20~30 cm用c表示,如CK.a代表对照0~10 cm土样)。
1.3.2 土壤理化性质及微生物量碳氮的测定p H用PHS-3C型酸度计测定;土壤含水量(SWC)采用恒重法测定;全氮(TN)采用半微量凯氏定氮法测定;有机碳(SOC)采用重铬酸钾容量法-外加热法测定;土壤铵态氮(NH+4-N)和硝态氮(NO-3-N)的测定均用氯化钾浸提后采用Smart Chen 200(AMS-Systea,Rome,Italy)元素分析仪测定;微生物量碳(MBC)和微生物量氮(MBN)均采用氯仿熏蒸浸提法测定。
1.3.3 DNA提取和高通量测序 采用Magnetic Soil And Stool DNA Kit试剂盒(TIANGEN BIOTECH,北京)提取土样基因组DNA,提取后用10 g·L-1的琼脂糖凝胶电泳检测DNA质量。
选用 带 有Barcode信 息 的 引 物341F(5′-CCTAYGGGRBGCASCAG-3′)和806R(5′-GGACTACNNGGGTATCTAAT-3′)对 细 菌16S r DNA的V3~V4区进行扩增。高保真酶PhusionHigh-Fidelity PCR Master Mix with GC Buffer(New England Biolabs,美国)用于PCR扩增。30μL PCR反应体系为:15μL Phusion Master Mix(2×),引物Primer(2μmol·L-1)各1.5μL,DNA模板(1 ng·μL-1)10μL,超纯水2μL。PCR反应条件为:98℃预变性1 min;98℃变 性10 s,50℃退 火30 s,72℃延 伸30 s,进行30个循环;72℃延伸5 min。使用20 g·L-1的琼脂糖凝胶对PCR产物进行电泳检测回收,用GeneJET胶回收试剂盒(Thermo Scientific,美国)进行纯化。使用TruSeq DNA PCRFree Library Preparation Kit建库试剂盒构建文库,构建好的文库经过Qubit定量和文库检测合格后,使用NovaSeq6000测序平台(诺禾致源生物信息科技有限公司,北京)进行上机测序。
使用FLASH(V1.2.7)对每个样本的reads进行拼接,过滤处理,进一步去除嵌合体序列后得到有效数据。利用Uparse软件(v7.0.1001)以97%的相似性将序列聚类成为OTUs。用Mothur方法对OTUs代表序列进行物种注释,与SILVA132的SSUr RNA数据库进行比对,获得各OTU的分类学信息。
1.4 数据处理
用Excel 2016对数据进行初步整理,并绘图做进一步分析。使用R(Version 2.15.3)软件的vegan软件包,基于Bray-Curtis距离算法,绘制NMDS图分析不同样本间的差异程度。使用Qiime软件(Version 1.9.1)计算Shannon、Simpson和Chao1等指数。运用SPSS 21.0软件进行方差分析(One-way ANOVA)和相关性分析。
2 结果与分析
2.1 氮添加对土壤理化性质的影响
高寒沼泽草甸各处理土壤理化性质如图1所示。土壤p H为8.05~8.20,在各处理中均表现为随着土壤深度的增加而增加,N2处理与CK在0~10 cm土层存在显著差异(P<0.05)。N1和N2处理土壤NH+4-N相比对照,在0~10 cm和10~20 cm土层均显著降低(P<0.05)。N1处理土壤NO-3-N相比对照,在0~10 cm和10~20 cm土层显著降低,N2处理土壤NO-3-N在10~20 cm土层相比对照显著降低(P<0.05)。N1和N2处理均显著降低0~10 cm和10~20 cm土层SOC(P<0.05),且10~20 cm和20~30 cm土层N1处理SOC含量 最 低。N1处 理TN相比对照,在10~20 cm土层显著降低,N2处理TN在0~10 cm土层相比对照显著降低(P<0.05)。N2处理SWC相比对照,在0~10 cm和10~20 cm土 层 均 显 著 降 低,N1处 理SWC相比对照,在10~20 cm土层显著降低(P<0.05)。以上结果表明,氮添加对土壤理化性质影响明显。

图1 不同处理下土壤理化性质Fig.1 Physicochemical characteristic of soil under different treatments
2.2 氮添加对土壤微生物量碳氮的影响
由图2可知,MBC在表层取得最大值,相比对照,N1处理显著增加10~20 cm和20~30 cm土层MBC,N2处理MBC相比对照,在10~20 cm土层显著增加(P<0.05)。N1处理MBN在10~20 cm和20~30 cm土层相比对照显著降低(P<0.05),N2处理MBN相比对照,在各土层均无显著性差异。表明随着氮添加量的增加,微生物量碳呈增加趋势,微生物量氮则表现为先降低后增加的趋势。

图2 不同处理下土壤微生物量碳氮Fig.2 Soil microbial biomass carbon and nitrogen under different treatments
2.3 氮添加对土壤细菌物种组成的影响
通过高通量测序共得到544 463条优质序列,序列长度为414~421 bp,对聚类后的3种氮添加处理土壤样品OTU依次进行不同等级信息分析,共得到54个门、62个纲、126个目、225个科、489个属。
土壤细菌优势菌群为变形菌门(Proteobacteria,41.136%~51.099%)、酸杆菌门(Acidobacteria,14.606%~24.105%)、放线菌门(Actinobacteria,7.726%~13.603%)、芽单胞菌门(Gemmatimonadetes,4.341%~9.868%)和厚壁菌门(Firmicutes,1.811%~11.977%)(图3)。变形菌门相对丰度在CK.a取得最大值51.099,氮添加处理下相对丰度相比对照,呈先降低后升高趋势。N1和N2处理酸杆菌门相对丰度相比CK,在0~10 cm和10~20 cm土层均增加,在20~30 cm土层均减少。N1和N2处理放线菌门相对丰度,在0~10 cm和10~20 cm土层相比CK均减少。N1和N2处理厚壁菌门,相比对照,其相对丰度在0~10 cm土层增加,10~20 cm土层减少。氮添加后各土层芽单胞菌门相对丰度表现为增加趋势。

图3 不同处理下土壤细菌门水平相对丰度Fig.3 Relative abundance of soil bacterial phyla under different treatments
科水平土壤细菌相对丰度对氮添加的响应分析结果表明(图4),相比对照,N1和N2处理梨单孢菌科相对丰度在0~10 cm和10~20 cm土层呈增加趋势,在20~30 cm土层呈降低趋势。N1和N2处理亚硝化单胞菌科相对丰度相比对照,在0~10 cm土层均降低,在10~20 cm和20~30 cm土层均增加。相比对照,氮添加处理使各土层芽单胞菌科相对丰度均表现为增加趋势。20~30 cm土层Unidentified_Deltaproteobacteria相对丰度在N1和N2处理下,相比对照有明显的增加。氮添加条件下,Unidentified_Rhodospirillales的相对丰度相比对照,在0~10 cm土层均增加,在10~20 cm土层和20~30 cm土层均减小。氮添加处理后,鞘脂单胞菌科、Unidentified_Rhizobiales和嗜氢菌科的相对丰度在各土层均降低。N1和N2处理链球菌科相对丰度相比对照,在10~20 cm土层和20~30 cm土层均明显减小。相比对照,N1和N2处理葡萄球菌科相对丰度在10~20 cm土层均减少。表明氮添加对科水平优势细菌相对丰度影响较大。
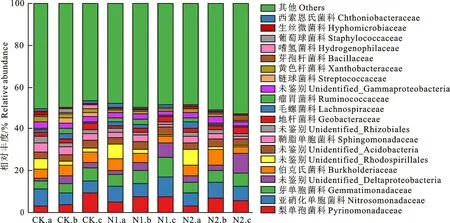
图4 不同处理下土壤细菌科水平相对丰度Fig.4 Relative abundance of soil bacterial family levels under different treatments
2.4 氮添加对土壤细菌群落结构的影响
由NMDS分析结果可以看出(图5),低氮添加对土壤细菌群落结构的影响大于高氮添加,但N1和N2处理均没有显著影响土壤细菌群落结构。图中N1.b和N2.b距离较近,说明这两个样点的物种组成较为相似。

图5 土壤细菌的NMDS分析Fig.5 Soil bacterial community structure under different treatments
2.5 氮添加对土壤细菌α多样性的影响
不同氮添加处理测序样品OTUs数量为2 018~2 378,测序覆盖率在0.99以上。对土壤细菌α多样性指数进行分析(表1),各土层N1和N2处理Shannon指数相比对照,均表现为降低趋势,且 在N2.b和N2.c处 显 著 降 低(P<0.05)。N1和N2处理Simpson指数相比对照,整体也表现为降低趋势,且在N1.c和N2.c处显著降低(P<0.05)。Chao1指数为2 056.150~2 413.727,最大值在N1.b处取得,相比对照,N1和N2处理土壤细菌丰富度指数(Chao1,Ace)整体呈降低趋势,其中,N2.b处两种丰富度指数显著降低(P<0.05)。表明氮添加能抑制细菌群落多样性,但整体差异不显著。

表1 不同处理下土壤细菌α多样性指数Table 1 Alpha diversity indexes of soil bacterial under different treatments
2.6 土壤细菌与土壤理化性质及微生物量碳氮之间的关系
由相关性分析结果可知(表2),Ace指数和Chao1指数均与NH+4-N显著正相关(P<0.05)。Shannon指数与NH+4-N和SWC显著正相关(P<0.05),与p H显著负相关(P<0.05)。表明NH+4-N、p H和SWC是影响细菌多样性的关键土壤因子。
进一步分析土壤因子对细菌优势菌门的影响(表2),变形菌门与p H负相关(P<0.05),与MBC、MBN、NO-3-N、SOC、TN和SWC极显著正相关或显著正相关(P<0.01或P<0.05)。酸杆菌门与p H呈正相关(P<0.05),与NH+4-N、NO-3-N和SWC极显著负相关(P<0.01)。放线菌门与NH+4-N显著正相关(P<0.05)。芽单胞菌门与MBN、NO-3-N、SOC、TN和SWC均显著负相关(P<0.05)。
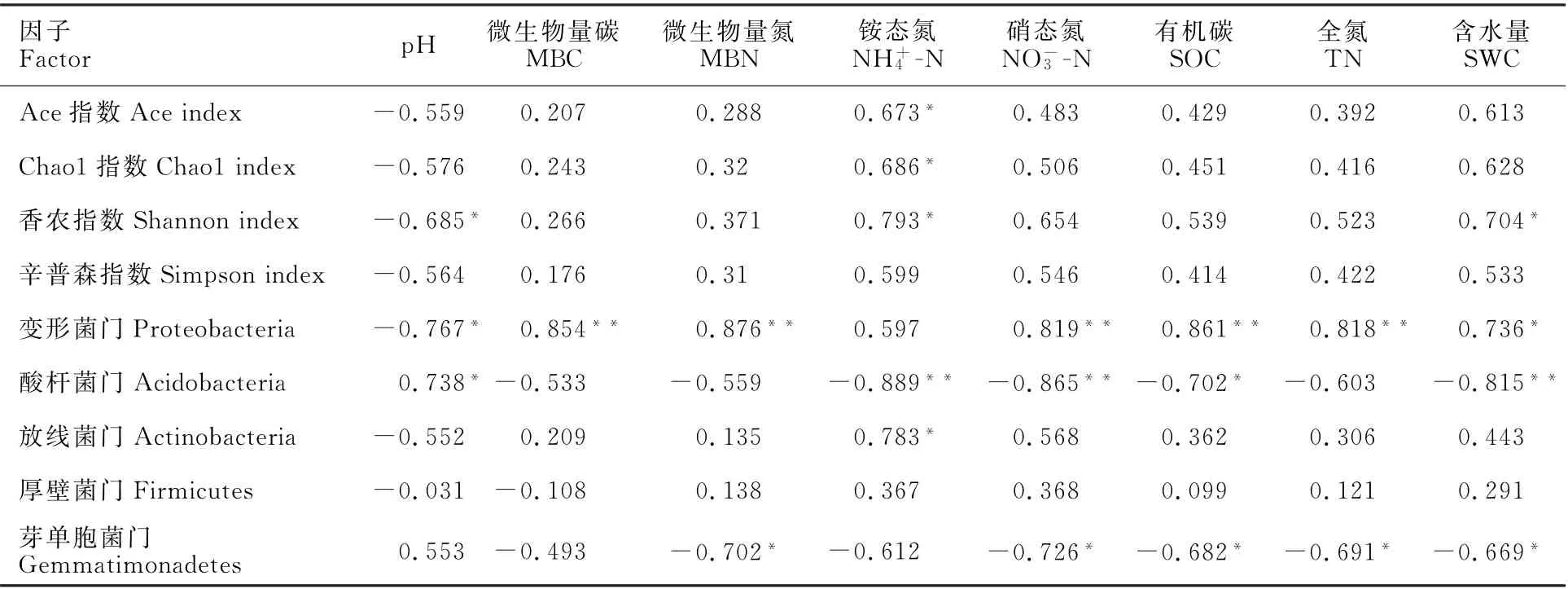
表2 土壤因子与细菌的相关性Table 2 Correlation analysis between soil factors andbacterial community
3 讨论
3.1 氮添加对细菌群落结构的影响
本研究对青藏高原高寒沼泽草甸进行氮添加处理,NMDS分析结果表明,氮添加没有对土壤细菌群落结构产生显著性影响,可能是因为本研究氮添加试验时间和氮添加量尚未达到明显改变细菌群落结构的阈值。变形菌门、酸杆菌门、放线菌门、厚壁菌门和芽单胞菌门是该地区土壤细菌主要菌群。各优势菌群相对丰度对氮添加表现出不同的响应趋势。本研究样地变形菌门在土壤细菌当中占比最高,其相对丰度在各土层随着施氮浓度的增加,均表现为先降低后升高趋势,表明氮添加对变形菌门的影响存在阈值限制,与李成一等[26]的研究结果相似。N1和N2处理酸杆菌门相对丰度相比对照,在0~10 cm土层和10~20 cm土层均增加,可能是由于该细菌属于寡营养类群,9月为植物生长枯黄期,氮添加使植物生长期延长,植物对养分的需求增加[21],微生物的养分获取受到限制,从而促进了该菌群的生长。研究认为放线菌属于富营养型细菌[27],能够降解纤维素和几丁质,产生种类繁多的胞外酶和次生代谢产物[28],是土壤养分供给的来源之一。氮添加使各土层放线菌门相对丰度表现为降低趋势,可能与本研究中氮添加条件下,土壤铵态氮和硝态氮有效性降低有关。氮添加增加各土层芽单胞菌门相对丰度,表明氮添加会促进芽单胞菌门的生长。氮添加后0~10 cm土层厚壁菌门相对丰度相比对照增加,而在10~20 cm土层相比对照减少,这可能与厚壁菌门属于固氮菌,氮添加引起各土层土壤氮含量发生改变有关。
3.2 氮添加对细菌群落多样性的影响
土壤微生物多样性是土壤生物多样性的重要组成部分,可指示土壤生态功能变化。氮添加可通过改变土壤环境条件(如土壤氮有效性和酸化)影响细菌多样性[29]。微生物多样性的降低会影响土壤氮循环[30],进一步影响生态环境稳定性。有研究表明施氮会直接影响土壤细菌丰富度[27]。杨越[16]以青藏高原高寒草地生态系统为研究对象,发现氮添加对土壤细菌多样性未产生显著影响。李成一等[26]以三江源区高寒草甸为研究对象,发现随氮添加量的增大,多样性指数呈先降低后增高趋势。本研究发现,氮添加处理下Shannon和Simpson指数均下降,N2处理Shannon指数在10~20 cm和20~30 cm土层相比对照明显降低,N1和N2处理Simpson指数相比对照,在20~30 cm土层显著降低。氮添加后Chao1和Ace指数也呈降低趋势,且N2处理两种丰富度指数在10~20 cm土层处显著降低。徐润宏等[17]的研究也表明,氮添加降低了高寒地区土壤细菌Simpson和Chao1指数,与本研究结论相似。说明氮添加影响了土壤细菌群落组成,降低了高寒沼泽草甸土壤细菌多样性。原因可能是高寒沼泽草甸土壤贫瘠,氮素匮乏,氮添加促进了地表植被生长[25],大部分土壤养分被植物所吸收,细菌用于自身生长繁殖的养分受到限制,抑制了细菌多样性。也可能是细菌类群竞争排斥的结果,即一些细菌对氮诱导的环境胁迫具有高度的适应能力[31],氮添加促进了这类细菌的迅速生长,改变了土壤原有细菌组成,影响细菌多样性。
3.3 氮添加条件下土壤因子对细菌群落的影响
土壤理化性质是影响细菌群落的重要因素。细菌菌群由于自身结构和功能的差异,对不同环境适应能力及养分需求有所不同,土壤p H、有机碳和含水量等升高或降低,会引起细菌群落组成和多样性的改变,土壤细菌群落结构的变化也会反过来影响土壤养分的有效性。本研究相关性分析表明,p H、NH+4-N和SWC是影响细菌群落多样性的关键环境因子,NO-3-N、SOC、SWC和MBN分别与特定细菌门显著相关。程亮等[32]在青藏高原地区的研究表明,土壤含水量和有机碳含量是影响细菌群落分布的主要环境因子,与本研究结果相似。刘红梅等[33]和杨山等[34]的研究中也有类似发现。Rousk等[35]研究发现土壤p H是影响细菌生长的主要因素。土壤p H的变化会影响微生物酶活性和碳氮元素利用率,改变微生物代谢功能[36],影响草地土壤细菌的多样性。但较高的土壤p H具有一定的酸缓冲能力,对氮添加引起的土壤酸化具有较强的抵抗力,使得土壤p H对氮输入的响应较小[37],对细菌的影响减弱。碳是微生物生长的必需元素,土壤有机碳含量被认为是土壤细菌动态的主要决定因素[38],通常认为土壤有机碳含量与细菌存在显著相关性。有研究发现,氮添加对土壤有机碳含量的影响存在阈值限制[16],与该研究结果类似,本研究中N1处理有机碳含量最低。这可能是因为氮添加促进了地表植被的生长,植物吸收土壤中的养分用于自身生长繁殖,低氮添加可能导致有机碳输出大于输入,使得土壤有机碳含量低于对照。当氮添加超过一定水平时,归还到土壤中的养分和凋落物量增加,有机碳含量较低,氮添加时升高。微生物量氮作为土壤有机质中最活跃的组分,对环境变化非常敏感,本研究发现微生物量氮随氮添加水平的升高表现为先降低后增加趋势,单文俊等[39]对长白山白桦山杨天然次生林土壤微生物量对氮添加的响应研究中也有类似发现。可能是因为低氮添加时,微生物在与植被竞争养分中处于劣势,微生物的生长受到抑制,微生物量氮降低,高氮添加增加了土壤中可利用氮含量,缓解了微生物与植被之间的养分竞争[4],微生物量氮增加。土壤铵态氮和硝态氮有效性会导致细菌丰富度发生变化[27]。土壤水分的变化则会导致土壤中的氧含量发生改变,进而影响细菌的分布[40]。除土壤理化性质外,根系分泌物、土壤酶和土壤团聚体也会影响细菌群落,因此,开展植被、细菌和土壤环境间的耦合关系研究,可以更好地了解氮添加对细菌群落的影响机制。
4 结论
通过对青藏高原高寒沼泽草甸土壤细菌群落对氮添加的响应研究,得出以下结论:氮添加对土壤优势菌群相对丰度均有不同程度的影响,但没有显著改变土壤细菌群落结构;氮添加抑制了土壤细菌多样性指数;土壤铵态氮、硝态氮、有机碳和含水量是影响细菌群落变化的关键土壤因子。长期氮添加可能会对青藏高原高寒沼泽草甸土壤细菌群落产生持续性影响,并对生态系统的稳定性构成严重威胁。因此,本研究区氮添加试验对土壤细菌的影响研究还需持续进行,以期为氮沉降增加影响下,高寒草地生态系统生物多样性维持机制提供理论依据。
