植物生长调节剂对赤豆鼓粒期光合特性及氮代谢的影响
2022-10-30丁凯鑫冯乃杰郑殿峰王立春田国奎王海艳李凤云
丁凯鑫 冯乃杰 郑殿峰 单 莹 王立春 田国奎 王海艳 李凤云
(1 黑龙江省农业科学院克山分院/农业农村部马铃薯生物学与遗传育种重点实验室,黑龙江 齐齐哈尔 161000; 2 广东海洋大学滨海农业学院,广东 湛江 524088)
赤豆(Vignaangularis)是短日照一年生小杂粮草本作物,外表椭圆深红,属于豆科豇豆属[1]。赤豆不仅富含人体所需的多种营养元素和微量元素,而且具有一定的药用价值[2]。随着人们对赤豆食用和药用特性的深入了解,其在我国居民饮食结构中的地位也逐年提高[3-4]。赤豆生产易受自然环境、栽培技术等方面影响,导致赤豆单株产量不稳定,籽粒品质下降,总产量不高[5]。在黑龙江省九三管理局的赤豆生产中,还存在以下多方面问题:主栽的赤豆品种自身生产潜力有限;栽种赤豆的地块耕层浅,整地质量差,后期土壤肥力不足;栽培措施落后,经常出现缺苗断垄现象;生长中后期赤豆发生倒伏现象严重;个别地区易发生赤豆病毒病和蚜虫等问题,极大地影响植株的生长发育,降低产量与品质。植物生长调节剂是由人工合成的与植物激素具有类似生理和生物学效应的物质,具备高效、广谱、快速的特性,可有效调控作物的生长发育,达到增加产量、改善品质等目的[6]。氮代谢是植物体内含氮化合物同化、转运和再利用的过程。植物氮同化主要在叶片内进行,需要光合作用提供碳源和能量,而氮素是叶片光合器官不可或缺的组成部分,并且叶片光合作用也需要氮代谢过程中产生的酶和光合色素等重要物质[7]。鼓粒期是赤豆籽粒发育和产量形成的关键时期,也是叶片光合作用和氮素同化、积累最复杂的阶段。在此时期,不仅通过叶片光合作用产生的新同化物向籽粒转移,在源器官中储存的同化物也向库器官中运输,此阶段叶片光合作用和氮代谢能力强弱将直接影响赤豆的最终产量[8]。因此,研究植物生长调节剂对赤豆鼓粒期光合特性和氮代谢变化的影响,对我国赤豆优质、高产、高效栽培具有重要意义。
有研究发现,外源褪黑素可增强高氮环境下大豆氮代谢过程中关键酶的活性,促进大豆根系及根瘤的发育[9],也可以调控植株对营养离子的吸收与代谢过程,协调不同器官间的养分分配状况,提高植株对环境的适应性[10-11]。2-N,N-二乙氨基乙基己酸酯(diethyl aminoethyl hexanoate, DTA-6)作为一种新型植物生长调节剂,对提高作物的产量和品质具有显著效果,在玉米、大豆、糜子等作物上已有广泛应用[12-13]。如对糜子施用不同浓度DTA-6浸种,可以增强叶片的光合作用,促使叶片蔗糖含量提高,进而促进了植株的生长[14]。马正波等[15]研究发现,施用矮壮素提高了玉米生育期内功能叶硝酸还原酶、谷氨酰胺合成酶、谷氨酸合成酶活性和可溶性蛋白含量,进而促进玉米氮代谢。屈春媛等[16]研究发现,外源脱落酸(abscisic acid, ABA)可缓解干旱胁迫下大豆硝酸还原酶、谷氨酰胺合成酶和谷氨酸合成酶活性的降低。项洪涛等[17]研究指出,喷施烯效唑可降低小豆淹水胁迫下叶片膜损伤,增加小豆叶片脯氨酸和可溶性蛋白含量,显著提高叶片的抗氧化酶活性,从而降低淹水胁迫对小豆生长的不利影响。综上,前人关于植物生长调节剂对作物调控的研究多集中于生理代谢及提高抗逆性等方面,而针对调节剂对赤豆鼓粒期叶片光合特性、氮同化和积累以及产量的调控效应仍鲜见报道。为此,本研究通过初花期叶面喷施促进型和延缓型两类植物生长调节剂,从赤豆鼓粒期植株形态、叶片光合参数、氮代谢等方面深入揭示调节剂促进赤豆生长发育以及增产的作用机理,以期为化控技术在农业生产上的推广应用提供科学依据。
1 材料与方法
1.1 试验材料
供试品种为龙垦2号,供试调节剂为2-N,N-二乙氨基乙基己酸酯(DTA-6)和烯效唑(uniconazole, S3307),均由黑龙江八一农垦大学化控研究室提供。
1.2 试验地概况
于2018和2019年进行田间试验。由于两年规律一致,本研究选用2019年数据进行分析。试验地点位于黑龙江省九三管理局鹤山农场,地处松嫩平原,属寒温带湿润季风气候区,位于第四积温带,年有效积温在2 100~2 300℃之间,无霜期115~120 d,年降雨量500~600 mm。土壤类型为黑土,土壤基本养分状况(0~20 cm耕层)为:碱解氮含量253 mg·kg-1、速效磷含量43 mg·kg-1、速效钾含量373 mg·kg-1、pH值7.2、有机质含量65 g·kg-1。
试验地两年气候条件如表1所示,2019年5—9月的日照时数、日均气温分别较2018年低119.2 h、3.7℃。2019年5—9月的降水量较2018年多157.7 mm,可见2018年光热条件更加充足,而两年降水量过大均会对赤豆的生长发育产生不利影响。
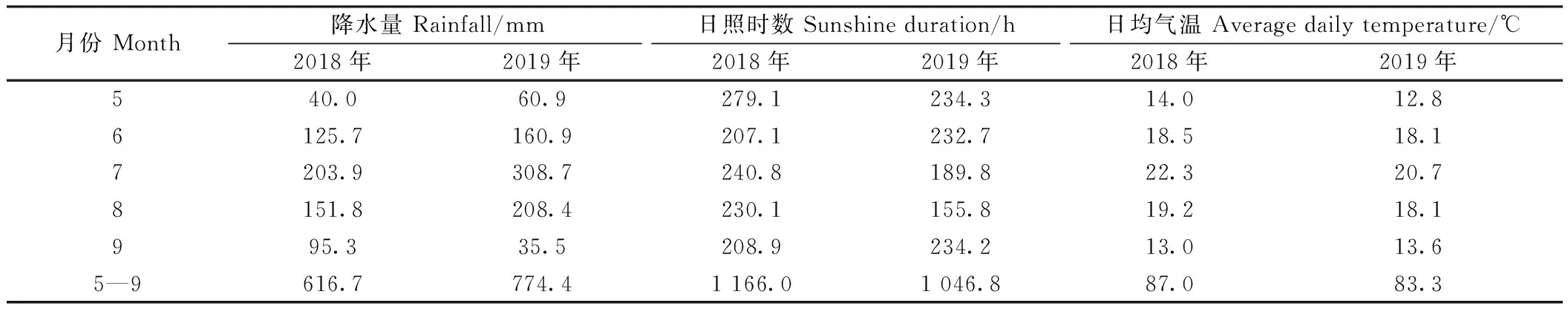
表1 试验地两年气象条件差异Table 1 Differences in meteorological conditions between the two years
1.3 试验设计
本试验采用随机区组设计,在赤豆初花期(7月20日)叶面喷施调节剂,设3个处理:喷施清水的对照(CK);喷施50 mg·L-1DTA-6;喷施50 mg·L-1S3307。每个处理4次重复,喷液量均为225 L·hm-2,两种调节剂浓度由前期调节剂浓度筛选试验选出[18-19]。小区行长设7 m,8行区,行距0.65 m,小区面积36.4 m2,播种密度为225 000 株·hm-2。在赤豆鼓粒期对各处理进行取样,用于相关指标的测定。
2018和2019年播种时间均为5月18日,两年收获时间分别为9月9日和9月10日,在整个生育期间,适时除草和防治病虫害,其他田间管理与当地常规生产一致。
1.4 测定项目与方法
1.4.1 赤豆株高和地上部单株干物质量的测定 在鼓粒期,各处理随机选取10株赤豆,采用常规方法测量赤豆的株高,然后将测量株高后的植株剪去根部,分为茎、叶和荚三部分,于105℃烘箱中杀青30 min,再调节温度至85℃烘干至恒重,用1/1 000天平称重,该样品烘干后用于地上部单株干物质量和含氮化合物的测定,茎、叶和荚三部分干物质量的总和即为地上部单株干物质量。
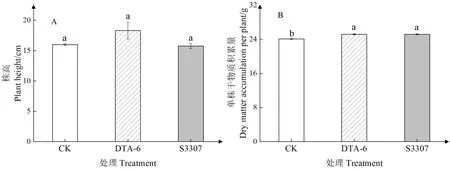
注:不同小写字母表示同一品种不同处理间差异显著(P<0.05)。下同。Note: Different lowercase letters indicate significant difference at 0.05 level among different treatments of the same cultivar. The same as following.图1 DTA-6和S3307对赤豆鼓粒期形态特征的影响Fig.1 Effect of DTA-6 and S3307 on the morphological characteristics of adzuki bean during seed filling stage
1.4.2 赤豆叶片光合参数的测定 选取晴朗天气,在上午9:00—11:00进行测定,于赤豆鼓粒期选择各处理生长一致的赤豆功能叶片(倒数第3片完全展开叶),采用CCM-200PLUS叶绿素测定仪(美国OPTI-science公司)测定叶片叶绿素含量(soil and plant analyzer develotrnent, SPAD)值,采用Li-6400便携式光合作用测定仪(美国Li-Cor公司)测定叶片的净光合速率(net photosynthetic rate, Pn)、气孔导度(stomatal conductance, Gs)和蒸腾速率(transpiration rate, Tr),每个处理测定4株,取平均值。
1.4.3 赤豆叶片光合主要产物的测定 在鼓粒期,各处理随机选取10株赤豆,取其功能叶片(倒三叶)用液氮速冻30 min后,置于-80℃超低温冰箱中保存。该样品用于测量叶片蔗糖含量[20]和可溶性糖含量[21]。
1.4.4 氮代谢相关指标的测定 在鼓粒期,各处理随机选取10株赤豆,取其功能叶片(倒三叶),一部分根据徐龙光[22]的方法测定硝酸还原酶(nitrate reductase, NR)活性,另一部分用液氮速冻30 min后,置于-80℃超低温冰箱中保存,用于测定谷氨酰胺合成酶(glutamine synthetase, GS)[23]、谷氨酸合成酶(glutamate synthase, GOGAT)[24]和谷氨酸脱氢酶(glutamate dehydrogenase, GDH)[25]的活性。根据Reguera等[26]的方法测定硝态氮含量。赤豆叶片全氮含量的测定采用凯氏定氮法[27],并按公式(1)计算赤豆叶片的氮素积累量:
植物各器官氮素积累量(g)=植物各器官生物量(g)×植物各器官氮含量(g·kg-1)
(1)。
1.4.5 产量及产量构成因素的测定 于赤豆成熟期,每小区取1 m2记录有效株数,从中选取具有代表性的10株进行单株荚数、单株粒数、单株粒重和百粒重的测定,按公式(2)计算产量:
产量(kg·hm-2)=(单株粒数 × 百粒重 × 每公顷株数)/100 000
(2)。
1.5 数据处理
采用Excel 2010和SPSS 19.0软件进行数据处理和统计分析,利用Origin 2019软件绘制图表。
2 结果与分析
2.1 DTA-6和S3307对赤豆鼓粒期形态特征的影响
由图1-A可知,DTA-6处理可增加赤豆鼓粒期株高,与对照相比提高了14.38%,而S3307处理的株高略低于对照,且两调节剂处理与对照相比均未达到差异显著水平。由图2-B可知,DTA-6和S3307处理均显著提高了赤豆鼓粒期的地上部单株干物质积累量,分别较对照提高了4.57%和4.70%,但两调节剂处理之间无显著差异。
2.2 DTA-6和S3307对赤豆鼓粒期叶片光合参数的影响
由图2可知,与对照相比,DTA-6和S3307处理对赤豆鼓粒期叶片的SPAD、Pn、Gs和Tr均有显著促进作用。两调节剂处理对赤豆鼓粒期叶片SPAD和Tr的调控效果均为DTA-6>S3307>CK,对Pn和GS的调控效果均为S3307>DTA-6>CK,其中S3307处理的Pn显著高于DTA-6处理,其他调节剂处理之间无显著差异。DTA-6和S3307处理的Pn分别较CK提高了26.96%、47.22%。
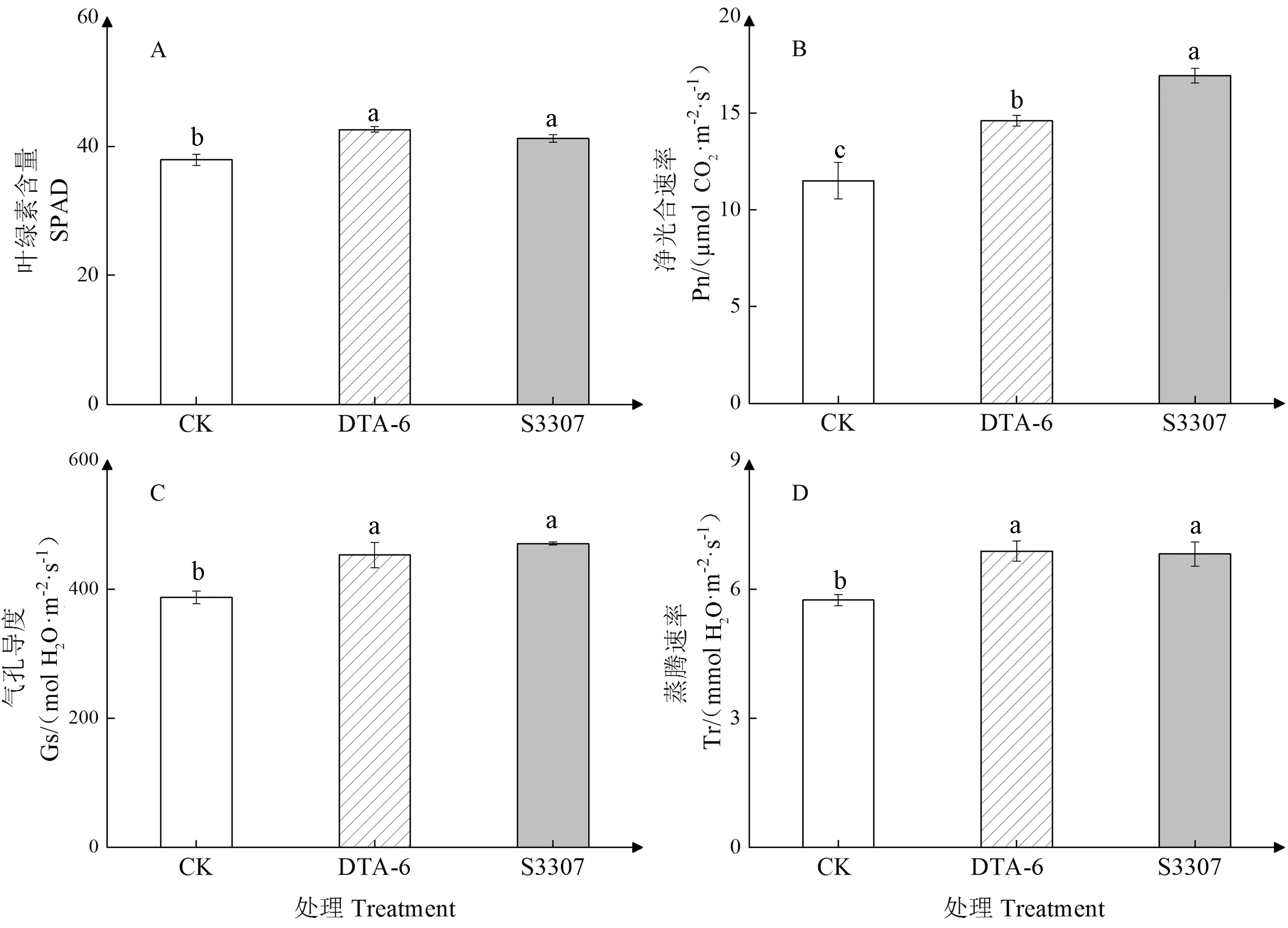
图2 DTA-6和S3307对赤豆鼓粒期叶片光合参数的影响Fig.2 Effect of DTA-6 and S3307 on photosynthetic parameters of adzuki bean leaves during seed filling stage
2.3 DTA-6和S3307对赤豆鼓粒期叶片主要光合产物的影响
由图3可知,DTA-6和S3307处理均提高了赤豆鼓粒期叶片蔗糖含量,分别较CK显著提高了16.42%和17.91%,两调节剂处理之间差异不显著。两调节剂处理对赤豆鼓粒期叶片可溶性糖含量的调控效果为DTA-6>S3307>CK,DTA-6和S3307处理的叶片可溶性糖含量分别较CK显著提高了21.33%、10.67%,且DTA-6处理的可溶性糖含量显著高于S3307处理。
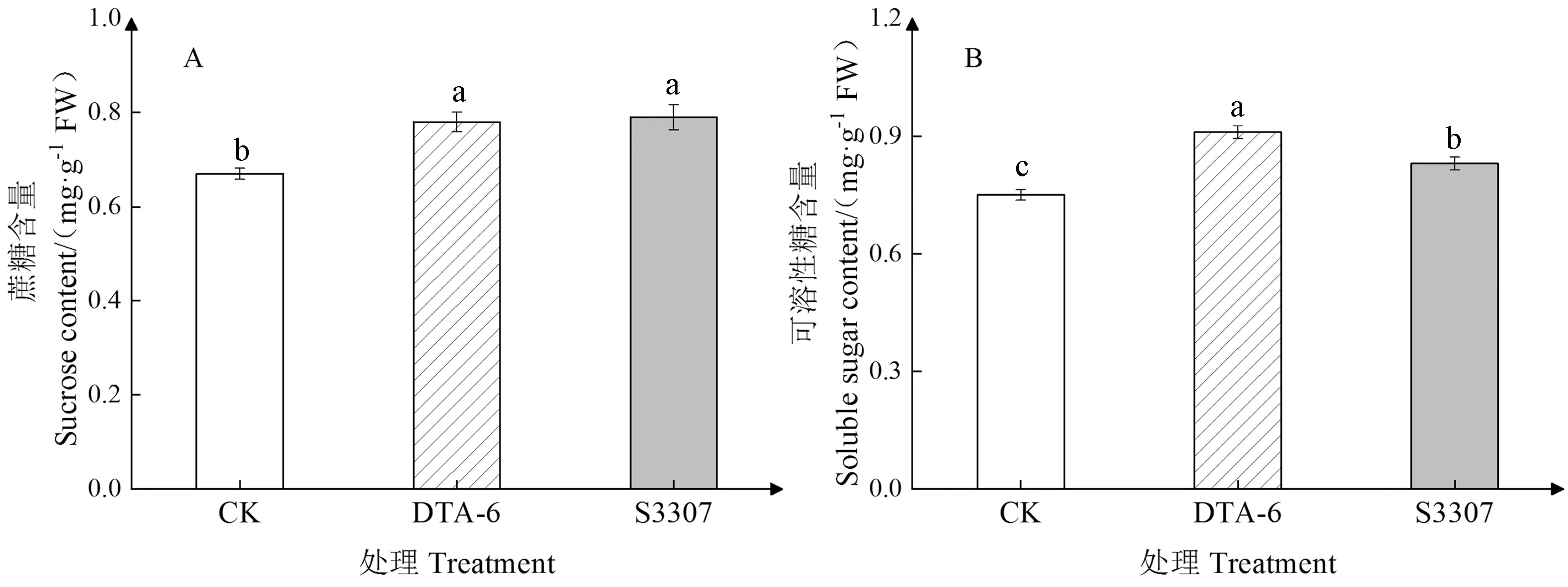
图3 DTA-6和S3307对赤豆鼓粒期叶片主要光合产物的影响Fig.3 Effect of DTA-6 and S3307 on the main photosynthetic products of adzuki bean leaves during seed filling stage
2.4 DTA-6和S3307对赤豆鼓粒期叶片氮同化关键酶活性的影响
由图4可知,与对照相比,S3307处理显著提高了赤豆鼓粒期叶片NR活性,较对照提高了24.46%。两调节剂处理及对照对赤豆鼓粒期叶片GS和GDH活性的调控效果均为S3307>DTA-6>CK,对GOGAT的调控效果为DTA-6>S3307>CK,两调节剂处理与对照之间均达到差异显著水平。DTA-6和S3307处理的叶片GDH活性分别较对照提高了14.36%和16.72%,且S3307处理的叶片GDH活性显著高于DTA-6,说明S3307处理可有效提高赤豆鼓粒期叶片的氮同化酶活性,从而促进氮代谢进程,且S3307处理作用效果优于DTA-6处理。
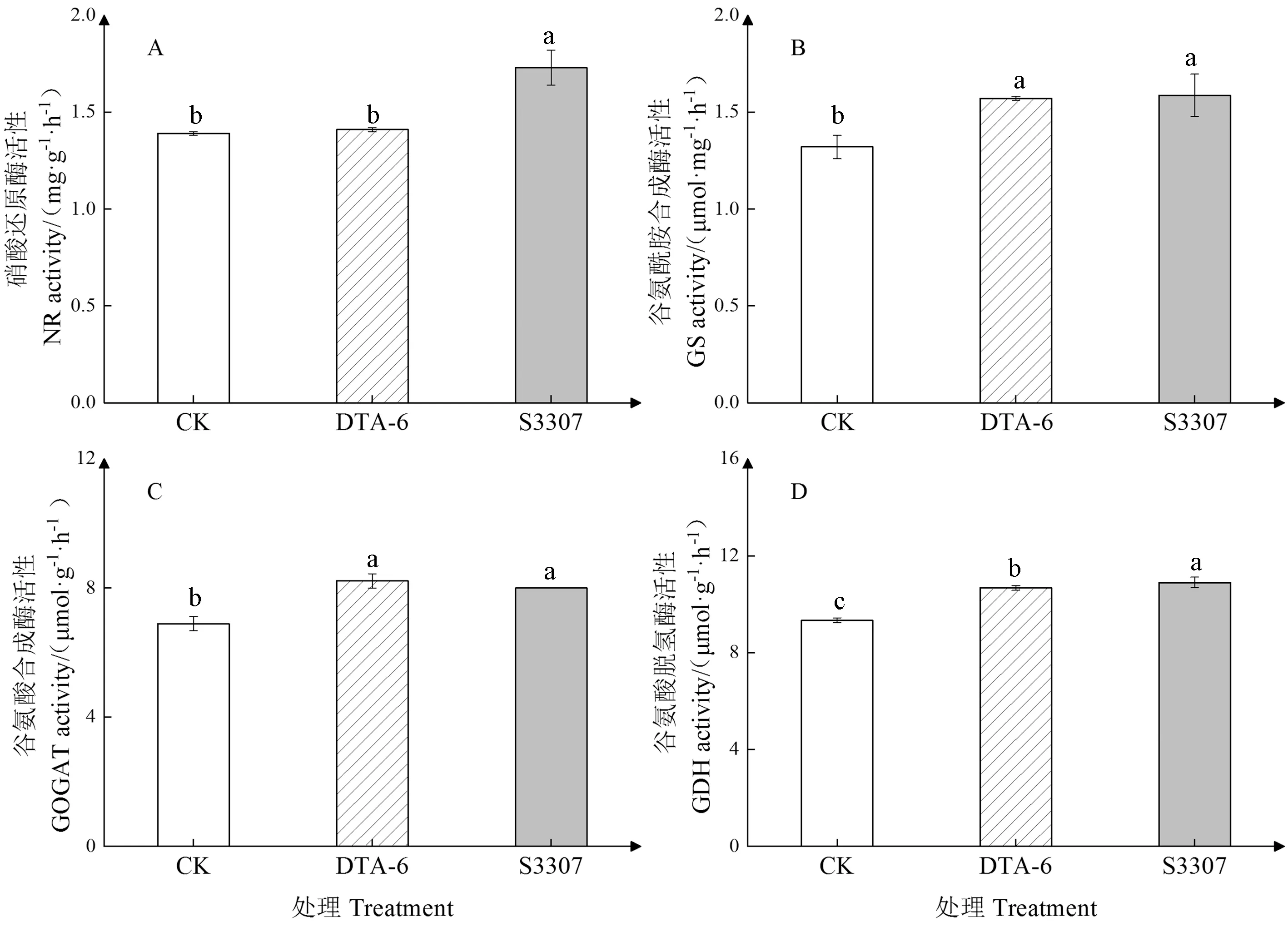
图4 DTA-6和S3307对赤豆鼓粒期叶片氮同化关键酶活性的影响Fig.4 Effect of DTA-6 and S3307 on the key enzyme activities of nitrogen assimilation in the leaves of adzuki bean during seed filling stage
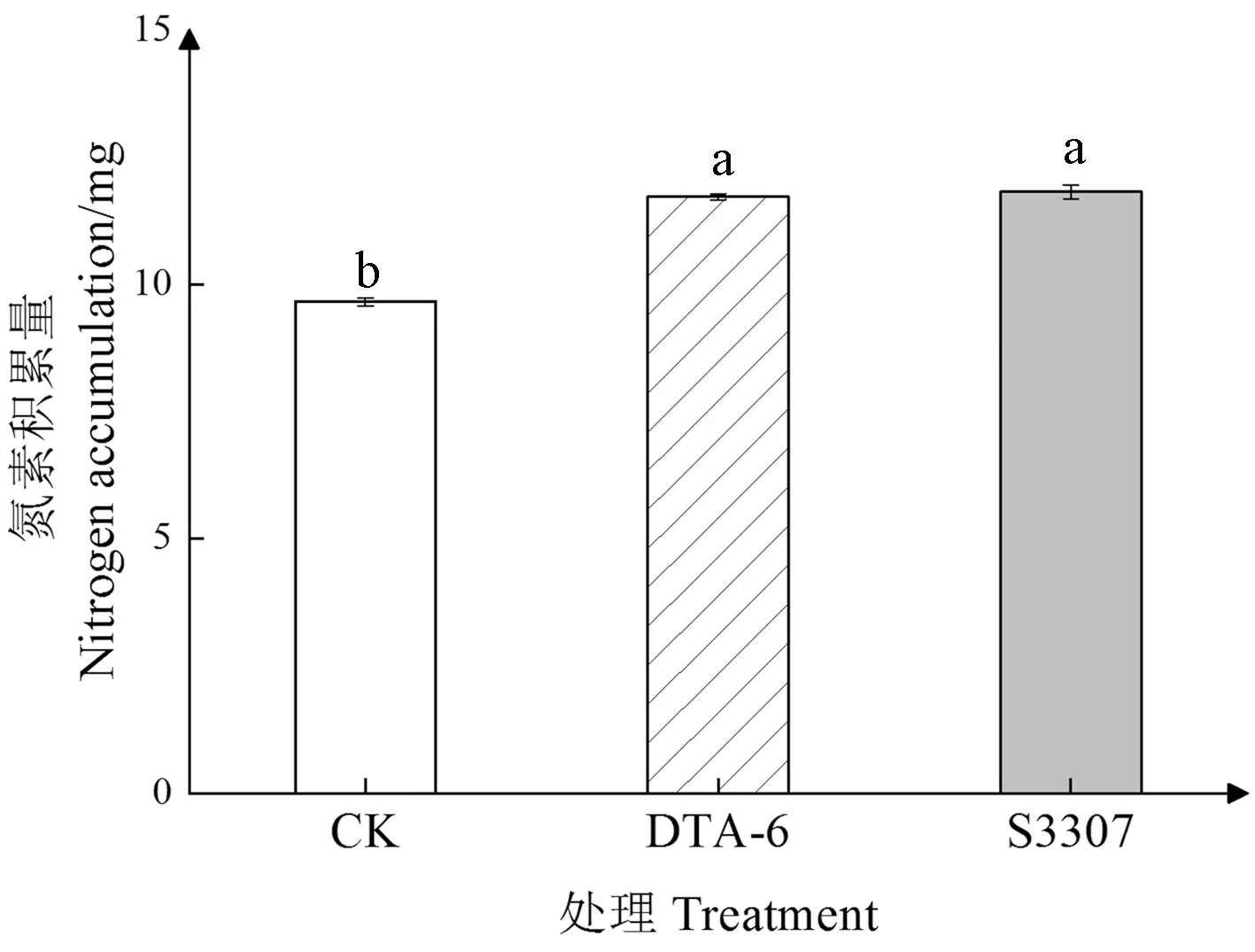
2.5 DTA-6和S3307对赤豆鼓粒期叶片主要含氮化合物及氮素积累量的影响
由图5-A可知,DTA-6和S3307处理的赤豆鼓粒期叶片硝态氮含量分别较对照显著提高了24.32%和14.86%,且DTA-6处理的叶片硝态氮含量显著高于S3307处理。由图5-B可知,DTA-6和S3307处理的叶片全氮含量均略低于对照,表现为DTA-6 图5 DTA-6和S3307对赤豆鼓粒期叶片主要含氮化合物的影响Fig.5 Effects of DTA-6 and S3307 on the main nitrogen compounds in the leaves of adzuki bean during seed filling stage 图6 DTA-6和S3307对赤豆鼓粒期叶片氮素积累量的影响Fig.6 Effect of DTA-6 and S3307 on nitrogen accumulation in leaves of adzuki bean during seed filling stage 由表2可知,两种植物生长调节剂均增加了赤豆单株荚数、单株粒数、单株粒重和百粒重。DTA-6和S3307处理的单株粒数、单株粒重和百粒重与对照相比,差异均达到显著水平。S3307处理对赤豆单株荚数调控效果最佳,显著高于DTA-6处理,DTA-6和S3307处理之间的其他产量因素差异不显著。喷施DTA-6和S3307后可显著增加赤豆产量。与对照相比,2018年DTA-6和S3307处理的产量分别显著增加了11.44%和12.61%;2019年DTA-6和S3307处理的产量分别显著增加了12.91%和9.34%,但两年间DTA-6和S3307处理之间无显著差异。 表2 DTA-6和S3307对赤豆产量及产量构成因素的影响Table 2 Effects of S3307 and DTA-6 on yield and yield components of adzuki bean 光合作用是作物生长发育过程中最基本的物质代谢和能量代谢过程。鼓粒期光合作用的强弱对赤豆的结实率和产量具有潜移默化的影响。植物生长调节剂作为一种可被植物自身降解的内源代谢产物,对植物的光合作用、碳代谢等方面均有一定的调控作用[28-29]。已有研究证实,喷施烯效唑和胺鲜酯对大豆生长过程中关键时期的水分利用效率、净光合速率、SPAD、蔗糖与淀粉含量均有促进作用,同时也有效调控了盛花期和盛荚期的气孔导度和蒸腾速率[30]。对糜子播种前施用S3307和DTA-6浸种,可提高拔节期和灌浆初期叶片叶绿素相对含量、气孔导度、蒸腾速率和净光合速率[31]。也有研究指出,对芸豆和小豆施用DTA-6,能够促进两种食用豆的光合作用,并且显著提高芸豆和小豆鼓粒期荚分配率,达到增产效果[32]。本研究发现,喷施植物生长调节剂后,在鼓粒期,DTA-6处理叶片的SPAD值和蒸腾速率均优于S3307处理,并且施用DTA-6处理使赤豆叶片的可溶性糖含量显著增加,说明DTA-6处理主要通过增加叶片叶绿素含量和蒸腾作用来促进鼓粒期叶片的光合作用和同化物积累。而S3307处理的叶片净光合速率显著高于DTA-6,说明S3307处理对鼓粒期叶片的光合作用调控效果更佳。两种调节剂对赤豆鼓粒期的生长发育也有一定的调控作用。已有研究表明,对绿豆施用60 mg·L-1S3307或50 mg·L-1DTA-6可增加其干物质积累期,显著提高地上部干物质积累量[33]。本研究也得到相似的结果,即初花期喷施DTA-6和S3307使得赤豆的单株干物质积累量显著提高,并且施用DTA-6也明显提高了赤豆鼓粒期的株高。 氮代谢是植物生命活动的基础过程,植物各器官内氮代谢水平的变化能够调控籽粒中蛋白质的合成[34]。而植株体内氮代谢关键酶活性反映了作物氮素同化、蛋白质的合成能力以及氮代谢整体水平[35]。罗树生等[36]通过研究植物生长调节剂对菠菜氮素代谢系统的调控作用,发现对菠菜施用胺鲜酯和复硝酚钠灌根可提高叶片NR、GS和GOGAT的活性。本研究发现,施用S3307显著提高了赤豆鼓粒期叶片的NR活性,且对GDH活性的促进效果也显著高于DTA-6处理,说明S3307处理主要通过促进NR活性将NO3-还原成为NH4+,再通过促进GDH循环加速对NH4+的同化。施用DTA-6后,赤豆鼓粒期叶片的GOGAT活性优于S3307处理,说明DTA-6处理对NH4+同化的GS/GOGAT循环效果更好。两调节剂对赤豆鼓粒期的氮代谢关键酶活性均有促进作用,这可能是因为GS、GOGAT和GDH的合成发生在叶绿体和线粒体中,施用两种调节剂导致鼓粒期叶片光合作用增强,从而使氮同化关键酶活性增强,进而提高了氮代谢水平。叶片中硝态氮含量能够直接反映作物体内氮素的同化和利用情况[37],而叶片中的全氮含量能够反映出植株的固氮能力[38]。前人研究表明,对薄壳山核桃喷施200 mg·L-1多效唑可促进叶片氮代谢产物积累[39],与本研究结果一致。本研究结果表明,DTA-6和S3307处理均可使赤豆鼓粒期叶片硝态氮含量显著增加,此外施用DTA-6的作用效果显著高于S3307,说明DTA-6更能促进植株硝态氮的吸收,加速氮素的积累。作物的氮素积累量与最终产量密切相关[40]。已有研究证实,对始花期大豆施用6-苄氨基腺嘌呤(6-benzylaminopurine, 6-BA)、DTA-6、S3307后,大豆地上部器官中的氮素含量和氮素积累量以及籽粒中的蛋白质含量均有所提高[41]。本研究中,DTA-6或S3307处理均显著增加了赤豆鼓粒期叶片的氮素积累量,说明两种调节剂均可增加营养器官中氮素的积累,加速叶片中氮素向籽粒转移,从而促进最终产量的形成。有研究表明,DTA-6和S3307可改善芸豆产量构成因素,从而提高产量[42]。刘春娟等[43]认为调节剂提高大豆产量的主要原因是对单株荚数、单株粒数和百粒重等均有一定的调控作用,最终显著增产。本试验也得到相似的结果,本研究中,S3307处理显著提高了赤豆的单株荚数,DTA-6处理对赤豆单株粒数、单株粒重和百粒重的促进效果要优于S3307处理,说明S3307处理主要通过增加花荚数来促进产量的提高,而DTA-6处理主要通过增加单株粒数和单株粒重来增加产量。本研究仅针对赤豆鼓粒期的植株形态、光合参数及氮同化关键酶等指标进行了分析,而调节剂对赤豆鼓粒期叶片光合作用和氮代谢的调控,还可能受多种关键酶以及植物内源激素系统的变化和基因的调控,其机理还需进一步深入挖掘。 本研究结果表明,施用DTA-6和S3307能够促进赤豆鼓粒期的植株生长,增加单株干物积累质量,同时有效调控叶片的光合参数以促进光合作用,显著增加叶片蔗糖和可溶性糖含量。两调节剂通过促进叶片的氮同化关键酶活性,增加了叶片中硝态氮含量和氮素积累量,进而促进了赤豆鼓粒期的氮代谢水平。此外,DTA-6和S3307处理能够改善赤豆产量构成因素,进而提升产量。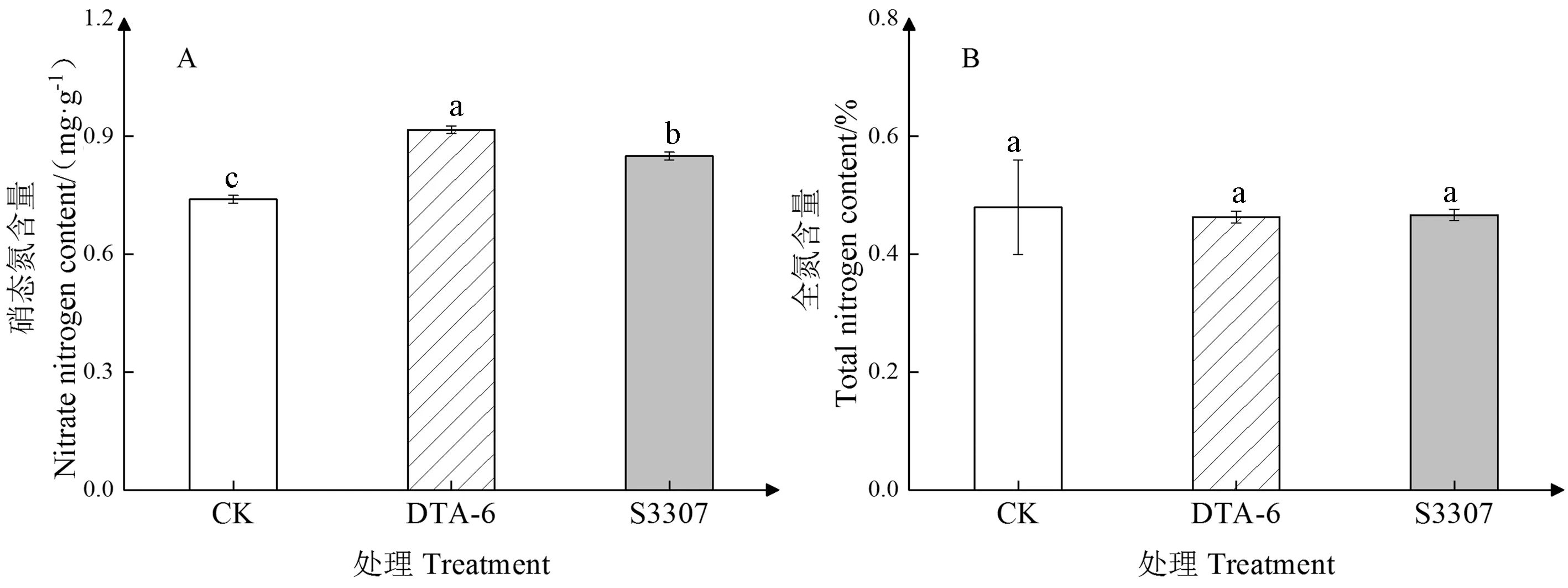
2.6 DTA-6和S3307对赤豆产量及产量构成因素的影响

3 讨论
4 结论
